Рак щитовидной железы (РЩЖ) является наиболее распространенным эндокринным злокачественным новообразованием. Среди всех онкологических заболеваний РЩЖ встречается от 1 до 4% случаев [1]. При правильном лечении дифференцированный РЩЖ имеет благоприятный прогноз по сравнению с другими злокачественными новообразованиями. 20-летняя выживаемость больных дифференцированным РЩЖ приближается к 90% [2]. Для медуллярного РЩЖ характерны агрессивное течение, раннее и обширное метастазирование, худший прогноз в отношении выживаемости по сравнению с дифференцированными гистотипами опухоли [3]. Учитывая высокую выживаемость большинства больных РЩЖ, важное значение приобретает частота рецидивов злокачественного заболевания. Выявление опухолевого поражения в лимфоузлах и отдаленных органах после 6 месяцев от начала специализированного лечения приравнивается к рецидиву болезни [3]. Авторами исследования на большой выборке пациентов установлено, что из 784 больных дифференцированным РЩЖ после хирургического лечения рецидивы заболевания встречались в 32,5% случаев. В преобладающем большинстве (84,3%) рецидивы наблюдались у пациентов с папиллярным РЩЖ и в 15,7% – при фолликулярной карциноме щитовидной железы. В 46,7% случаев рецидивы были диагностированы в первые 12 месяцев после операции. В 68,3% случаев рецидивы были выявлены в области оперативного вмешательства и в 20,7% – в отдаленных органах [2].
К настоящему моменту обозначен узкий круг биомаркеров, используемых для диагностики злокачественных заболеваний щитовидной железы, послеоперационной оценки эффективности хирургических и радиоабляционных воздействий или химиотерапевтического лечения [4]. К ним можно отнести кальцитонин, тиреоглобулин, антитела к тиреоглобулину. При этом отмечается недостаточное количество биомаркеров, разделяющих на хирургическом этапе лечения злокачественные поражения низкого и высокого риска прогрессирования. Сложилась практическая потребность в выявлении молекулярных биомаркеров, которые могут дополнить традиционные методы послеоперационного наблюдения и помочь своевременно выделить группу высокого риска больных с неблагоприятным течением болезни.
Цель исследования – определить прогностическую информативность содержания и экспрессии фибронектина 1 в опухоли для формирования прогноза в отношении развития рецидивов РЩЖ.
Материал и методы исследования
Исследование проведено на 63 больных с впервые выявленным РЩЖ 1-й (n=49) и 2-й стадий (n=14). Число женщин в группе составило 51 (81%), а мужчин – 12 (19%). Средний возраст больных соответствовал 47,9±1,8 года и колебался от 22 до 64 лет. Критерием включения пациентов в исследование явилось отсутствие экстратиреоидной инвазии опухоли, а также локорегиональных и отдаленных метастазов. Критерии исключения – противоопухолевое лечение до операции, наличие онкологических заболеваний иной локализации. По итогам гистологического исследования операционных образцов опухолевых образований папиллярная карцинома встречалась в 69,8% случаев (n=44), фолликулярная карцинома – в 20,6% случаев (n=13), медуллярный рак щитовидной железы – в 9,5% случаев (n=6). Распределение больных в зависимости от стадии pTNM по итогам послеоперационного обследования было следующим: T1aN0M0 – 7 (11,1%), T1bN0M0 – 13 (20,6%), T2N0M0 – 24 (38,1%), T3aN0M0 – 19 (30,2%). Всем пациентам клинической группы проводили радикальное хирургическое лечение.
Все больные подписывали добровольное информированное согласие на участие в исследовании. Исследование одобрено Локальным этическим комитетом ФГБОУ «Ростовский государственный медицинский университет» Минздрава России.
Для приготовления гомогената опухоли образцы тканей помещали на лед и доставляли в лабораторию. Образцы опухоли и нормальной ткани гомогенизировали в фосфатно-солевом буфере PBS (EURx, Польша) в соотношении 9:1 (объем PBS / вес ткани). Гомогенизацию проводили с помощью гомогенизатора Bio-Gen PRO200 (PRO Scientific Inc., США) при скорости 10000 об/мин. После центрифугирования отбирали супернатант.
Для определения концентрации фибронектина 1 в гомогенате ткани применяли иммуноферментный анализ. При этом использовали набор Fibronectin ELISA Kit (Technoclone, США).
Оценку экспрессии фибронектина в опухолевых клетках и перифокальной зоне осуществляли иммуногистохимическим методом. Операционные образцы опухолевой ткани фиксировали в 10%-ном забуференном формалине в течение 24 часов, а затем заливали в парафин. Гистологические срезы толщиной 4 мкм обрабатывали с помощью набора Histostain-Plus (Invitrogen, США). При оценке экспрессии фибронектина использовали кроличьи моноклональные антитела на фибронектин человека (DakoСytomation, Дания) в разведении 1:1000. В случаях положительного окрашивания фибронектина 1 гранулы локализовались в цитоплазме. Образцы исследовали под микроскопом с увеличением х400. Оценку экспрессии осуществляли путем подсчета числа окрашенных клеток: 0 баллов – менее 25% окрашенных клеток, 1 балл – 25–50%, 2 балла – 51–75%, 3 балла – более 75%.
За 2 года наблюдения в клинической группе у 7 (11,1%) пациентов был выявлен рецидив заболевания. Результаты лабораторного и иммуногистохимического исследования ретроспективно сопоставляли с фактом рецидива заболевания.
Статистическую обработку результатов осуществляли с помощью программ Statistica 12.0 (StatSoft, США) и MedCalc (Software Ltd, США).
Результаты исследования и их обсуждение
Клеточная нерастворимая форма фибронектина 1 является основным компонентом внеклеточного матрикса. Доказано, что фибронектин 1 участвует в развитии карцином желудка [5], молочной железы [6], толстой кишки [7], щитовидной железы [8], светлоклеточного рака почки [9]. При этом экспрессия фибронектина 1 в раковых клетках повышена [10]. Адгезия клеток карциномы к фибронектину 1 усиливает туморогенность и придает устойчивость к химиотерапевтическим агентам, индуцирующим апоптоз [10]. Фибронектин 1 рассматривают как потенциальный биомаркер радиорезистентности, его экспрессию анализируют при формировании прогноза течения злокачественного заболевания [11].
В гомогенате опухоли у больных РЩЖ всей группы медиана концентрации фибронектина 1 составила 128,9 нг/мл с межквартильным диапазоном 110,3–156,5 нг/мл. В подгруппе пациентов с развитием рецидива заболевания уровень фибронектина 1 соответствовал 149,3 [139,4–158,2] нг/мл и был выше на 17,5% (p<0,001) по сравнению с безрецидивным течением болезни (127,1 [109,4–148,1] нг/мл (рис. 1).
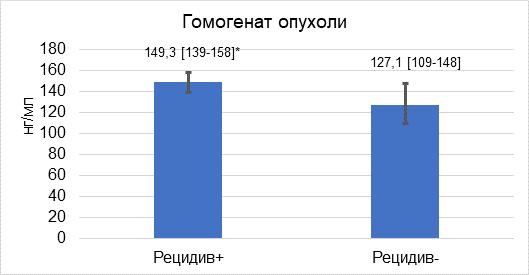
Рис. 1. Концентрация фибронектина 1 (медиана и межквартильный диапазон) в гомогенате опухоли операционных образцов у больных РЩЖ в зависимости от последующего развития рецидива заболевания. * – статистически значимые различия по критерию Манна–Уитни
В гомогенате опухолевой ткани уровень фибронектина 1 возрастал от Т1 до Т3 соответственно от 114,5 [111,2–118,9] нг/мл до 135,7 [131,3–139,7] нг/мл (р=0,002) (табл. 1).
Таблица 1
Концентрация фибронектина 1 в гомогенате опухоли у больных РЩЖ в зависимости от клинических характеристик заболевания
|
Признак |
Ранг признака |
Фибронектин 1 в гомогенате опухоли, нг/мл |
р |
|
|
Медиана |
[25–75] |
|||
|
Стадия Т |
Т1а (n=7) |
114,5 |
[111,2–118,9] |
0,002 |
|
Т1b (n=13) |
117,4 |
[113,7–124,8] |
||
|
T2 (n=24) |
129,1 |
[126,5–134,1] |
||
|
T3a (n=19) |
135,7 |
[131,3–139,7] |
||
|
Диаметр опухоли |
До 2 см (n=20) |
115,4 |
[111,6–118,2] |
0,001 |
|
Более 2 см (n=43) |
132,6 |
[127,3–138,1] |
||
|
Гистотип опухоли |
ПК (n=32) |
128,2 |
[123,6–133,4] |
0,218 |
|
ФК (n=13) |
124,3 |
[121,8–129,6] |
||
|
ФВ ПК (n=12) |
127,9 |
[123,5–134,5] |
||
|
МК (n=6) |
134,7 |
[130,2–138,7] |
||
|
Онкогенные мутации |
Есть (n=32) |
136,9 |
[133,5–140,2] |
<0,001 |
|
Нет (n=31) |
118,0 |
[111,5–124,7] |
||
Примечание: [25-75] – межквартильный диапазон, р – уровень значимости определен по критерию Краскела–Уоллиса при сравнении показателей четырех рангов и Манна–Уитни при попарном сравнении.
При диаметре опухоли более 2 см концентрация биомаркера в изучаемой среде была на 15% выше (р=0,001) по сравнению с пациентами, у которых размер опухоли в диаметре составлял менее 2 см (табл. 1). Концентрация фибронектина 1 в опухоли у больных РЩЖ статистически значимо не зависела от гистологического типа опухоли (табл. 1). При наличии онкогенных генетических мутаций в генах BRAF, KRAS, NRAS, HRAS, TERT, RET, PTC, PAX8, PPARG уровень фибронектина 1 в опухолевом гомогенате был выше на 16% (р<0,001), в отличие от пациентов с отсутствием мутаций (табл. 1).
Таким образом, концентрация фибронектина 1 в опухолевом гомогенате зависела от размера опухоли, наличия онкогенных мутаций и развития рецидива заболевания в последующем.
Поскольку фибронектин 1 является компонентом внеклеточного матрикса, на следующем этапе проводили оценку экспрессии белка в опухолевой ткани и в перифокальной зоне. При иммуногистохимическом исследовании экспрессии фибронектина 1 в опухолевой ткани установлено, что гиперэкспрессия изучаемого белка опухолевыми клетками наблюдалась в половине случаев (49,2%). Умеренная экспрессия белка раковыми клетками имела место в 44,4% случаев, а низкая экспрессия – в 6,3%. В перифокальной зоне в большинстве случаев (74,6%) экспрессия фибронектина 1 клетками была низкой (табл. 2).
Таблица 2
Распределение больных РЩЖ в зависимости от выраженности экспрессии фибронектина 1 в опухолевой ткани и перифокальной зоне
|
Экспрессия, баллы |
Опухолевая ткань, абсолютное число (%) |
Перифокальная зона, абсолютное число (%) |
р |
|
0 |
– |
6 (9,5) |
p<0,001 (c2=81,78) |
|
1 |
4 (6,3) |
47 (74,6) |
|
|
2 |
28 (44,4) |
10 (15,9) |
|
|
3 |
31 (49,3) |
– |
|
|
Всего |
63 (100,0) |
63 (100,0) |
|
Примечание: доверительную вероятность р определяли путем сравнивания трех долей по критерию Пирсона с поправкой Йетса на непрерывность.
У всех больных с рецидивами злокачественного заболевания в ближайшие 2 года после операции наблюдалась исходная гиперэкспрессия фибронектина 1 раковыми клетками (табл. 3).
Таблица 3
Распределение больных РЩЖ в зависимости от выраженности экспрессии фибронектина 1 в опухолевой ткани
|
Опухолевая экспрессия, баллы |
Рецидив есть, абсолютное число (%) |
Рецидива нет, абсолютное число (%) |
р |
|
0 |
0 |
0 |
p=0,017 (c2=8,13) |
|
1 |
0 |
4 (7,1) |
|
|
2 |
0 |
28 (50,0) |
|
|
3 |
7 (100,0) |
24 (42,9) |
|
|
Всего |
7 (100,0) |
56 (100,0) |
|
Примечание: доверительную вероятность р определяли путем сравнивания трех долей по критерию Пирсона с поправкой Йетса на непрерывность.
Следовательно, исходное повышение фибронектина 1 в гомогенате опухоли у больных с последующим развитием рецидивов было обусловлено гиперэкспрессией протеина раковыми клетками.
Поскольку содержание фибронектина 1 в опухолевом гомогенате у пациентов с рецидивами заболевания отличалось от аналогичного показателя у пациентов при безрецидивном течении, на следующем этапе оценивали прогностическую информативность маркера с помощью ROC анализа.
Больным с рецидивами заболевания присваивали ранг 1, а без рецидивов – ранг 0. Далее сопоставляли чувствительность и специфичность разделения пациентов на два ранга при различных концентрациях фибронектина 1 в гомогенате опухоли.
Разделительный уровень фибронектина 1 в супернатанте опухоли составил 136,4 нг/мл. При превышении концентрации фибронектина 1 в гомогенате опухолевого образца более 136,4 нг/мл с диагностической чувствительностью 99,87% и специфичностью 76,79% можно говорить о высоком риске рецидива заболевания у больных РЩЖ (рис. 2).
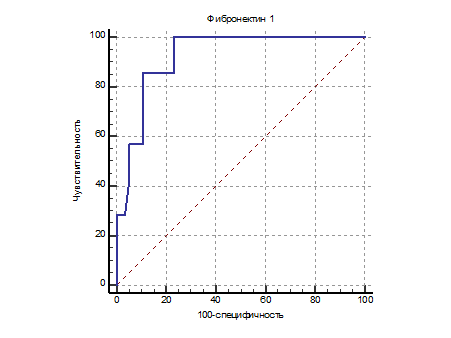
Рис. 2. Сопоставление чувствительности и специфичности оценки риска рецидива РЩЖ по содержанию фибронектина 1 в гомогенате опухоли
Площадь под ROC кривой до опорной линии имела величину 0,922±0,039 (доверительный интервал 0,826–0,975) и значимо отличалась от диагонали (z=10,839 при p<0,001).
При превышении в гомогенате опухоли уровня 136,4 мкг/мл риск рецидива РЩЖ повышался в 4,31 раза (p<0,001).
Таким образом, прогностическая информативность определения фибронектина 1 в гомогенате опухоли высокая и может быть использована для выявления больных с выраженным риском рецидива заболевания после операции.
Выводы
1. Повышение концентрации фибронектина 1 в гомогенате опухоли операционных образцов ткани вследствие усиления экспрессии белка раковыми клетками ассоциировано с последующим развитием рецидива локализованного рака щитовидной железы.
2. При превышении концентрации фибронектина 1 в гомогенате опухолевого образца более 136,4 нг/мл риск развития рецидива заболевания в ближайшие два года после операции у больных локализованным раком щитовидной железы возрастает в 4,31 раза (p<0,001).
Библиографическая ссылка
Альникин А.Б. ОПТИМИЗАЦИЯ ПРОГНОЗА РАЗВИТИЯ РАННИХ РЕЦИДИВОВ ЛОКАЛИЗОВАННОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ // Современные проблемы науки и образования. 2024. № 3. ;URL: https://science-education.ru/ru/article/view?id=33511 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33511



