Согласно современной международной гистологической классификации ВОЗ опухолей женской репродуктивной системы, изданной в 2020 г., новообразования яичников подразделяют на эпителиальные и неэпителиальные. К последним относят герминогенные неоплазии, стромальные опухоли, новообразования полового тяжа, смешанные опухоли стромы и полового тяжа и ряд других [1]. Герминогенные опухоли яичников (ГОЯ) – это гетерогенная группа неоплазий, происходящая из примитивных зародышевых клеток, которые в процессе гистогенеза участвуют в формировании половых желез, а также в гаметогенезе [2, 3]. ГОЯ занимают 20–25 % в структуре всех опухолей яичников, но лишь 1–5 % из них являются злокачественными [4, 5]. Редко встречающиеся злокачественные герминогенные опухоли яичников (ЗГОЯ) наиболее часто диагностируются у подростков и молодых женщин, занимая до 70 % от всех злокачественных новообразований яичников у детей [5, 6]. Следует учитывать, что данная возрастная группа больных социальная значима и пациентки заведомо активны в плане деторождения [5].
В зависимости от гистологических подтипов ЗГОЯ разделяют на дисгерминомы, опухоли желточного мешка (эндодермального синуса), злокачественные (незрелые) тератомы, эмбриональные карциномы, первичные хориокарциномы яичника (негестационные) и смешанные опухоли половых клеток [1, 7]. Незрелая тератома яичника является одним из наиболее распространенных гистологических вариантов ЗГОЯ [8].
Незрелая тератома яичника составляет менее 3 % от всех тератом яичников [9]. Структура незрелой тератомы содержит элементы, происходящие из трех зародышевых листков со стромой, инфильтрированной лимфоцитами [7, 10]. В ходе гистогенеза примитивная унипотентная половая клетка теряет потенциал к дальнейшей дифференцировке, при этом копируя в искаженном виде неограниченное количество клеток, соответствующих по развитию начальным стадиям гистогенеза [1, 8]. При гистологическом исследовании в составе опухоли определяются незрелые клетки эпителия (рис. 1), мезенхимы и нейроэктодермы [11]. Наиболее изученными иммуногистохимическими маркерами являются END-эндодерма, NEP-нейроэпителий, STR-строма [12, 13].
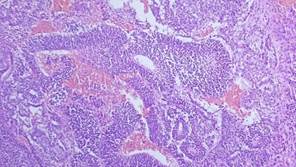
Рис. 1. Нейроэктодермальный компонент (незрелая тератома) представлен незрелым нейроэпителием с образованием розеткоподобных структур из клеток со скудной цитоплазмой и гиперхромными ядрами, митотической активностью
Клетки, формирующие структуру новообразования в яичнике, также могут распространяться за пределы опухоли, непосредственно прорастать капсулу новообразования и/или формировать узелки (импланты) серого или белого цвета, обычно размером 1–3 мм, разбросанные по брюшине, чаще в малом тазу, сальнике [14]. Ряд авторов выявил специфичную для незрелой тератомы яичника диссеминацию в виде глиоматоза брюшины. Импланты нейроглиальной ткани растут под мезотелиальным покровом, при этом не прорастают в органы брюшной полости [1, 15, 16]. Злокачественные тератомы так же способны к лимфогенному метастазированию, при котором наиболее часто поражаются забрюшинные лимфатические узлы. Отмечено вторичное поражение печени, легких, головного мозга при гематогенной диссеминации данной неоплазии [17, 18].
Макроскопически незрелые тератомы обычно бывают больших размеров. По своей структуре преимущественно имеют дольчатое, солидное строение, с включением большого количества кист. Последние заполнены серозным или муцинозным содержимым, коллоидом или жировыми включениями [1, 10].
Недисгерминомные опухоли яичников, которые помимо незрелой тератомы включают в себя опухоли желточного мешка, эмбриональные карциномы, первичные хориокарциномы, смешанные опухоли яичников, объединяет схожая клиническая картина. Эти опухоли характеризуются односторонним поражением, а также быстрым ростом, в результате чего у пациенток отмечается значительное увеличение живота в объеме. Возможно развитие болевого синдрома, возникающего при сдавлении соседних анатомических структур и органов капсулой увеличивающегося новообразования [5, 8]. У пациенток с малыми размерами опухоли так же может развиться болевой синдром, лихорадка. Примерно в 10 % случаев течение заболевания острое, что связано с перекрутом ножки измененного яичника, растяжением и/или разрывом, некрозом капсулы неоплазии и кровотечением. У каждой пятой пациентки выявляется асцит [8]. Важно отметить, что диагностика и лечение данных пациенток должны проводиться в кратчайшие сроки в условиях специализированных медицинских организациях, имеющих опыт ведения данной когорты больных [19, 20].
Наиболее часто, когда опухоль еще не послужила причиной для развития вышеописанной симптоматики, на ее наличие может косвенно указать ряд лабораторных изменений в сыворотке крови, такие как увеличение показателей ЛДГ, щелочной фосфатазы. Следует отметить, что для незрелой тератомы характерно довольно значительное повышение уровня маркеров бета-ХГЧ, АФП, СА-125 [1, 8]. Злокачественные тератомы в 6–8 % случаев имеют в своем составе гигантские клетки синцитиотрофобласта, обуславливающие повышение уровня бета-ХГЧ [17]. Уровень АФП, вырабатываемый опухолевыми клетками, коррелирует с размером неоплазии и позволяет провести динамическую оценку эффективности при лечении хирургическим и/или химиотерапевтическим методами, а также диагностировать прогрессирование заболевания [17]. Повышение уровня бета-ХГЧ и АПФ в случае гистологически верифицированной зрелой тератомы говорит о неоднородности структуры имеющейся опухоли и наличии в ней элементов незрелой тератомы [17, 21]. Учитывая наличие специфических лабораторных изменений в сыворотке крови при ЗГОЯ, актуально просвещать гинекологов женских консультаций о необходимости расширения диагностической панели маркеров у молодых женщин при наличии новообразования яичника.
Диагностика незрелой тератомы требует комплексного подхода, основываясь не только на клинической картине и лабораторных данных, но и на использовании инструментальных методов. Важно использовать все методы визуализации в совокупности. Так, по данным УЗИ, МРТ и КТ опухоль обычно представлена гетерогенной структурой, имеющей в своем составе многокамерные кисты, разделенные солидными очагами и кальцинатами [14]. Структура незрелой тератомы в 26 % случаев может включать дермоидную кисту, а в 10 % киста обнаруживается в противоположном яичнике [11, 14].
Прогностическими факторами при незрелой тератоме являются возраст, стадия заболевания, степень злокачественности опухоли. Дифференцировка тератом зависит от степени их зрелости и определяется по процентному соотношению нейроэктодермы к другим клеткам опухоли на одно поле зрения [17]. Так, 10 % клеток нейроэпителия в одном поле зрения соответствует I степени (grade 1, G1), от 10 до 33 % – II степени (grade 2, G2), а более 33 % – III степени (grade 3, G3) злокачественности [22]. Выживаемость больных при опухолях G1 значительно выше, чем при G2 и G3 (95, 62, 30 % соответственно) [14, 23]. Следует учитывать, что насущной проблемой является оценка и интерпретация результатов гистологического, иммуногистохимического исследования, последнее требует высокой подготовки врача-патологоанатома [23].
В настоящее время установлено, что в отличие от эпителиальных опухолей яичников 60–70 % ЗГОЯ, в том числе незрелая тератома, диагностируются на I стадии заболевания. Таким образом, данная группа пациенток потенциально курабельна, так как имеет сравнительно высокую продолжительность жизни. Стадия III насчитывает приблизительно 25–30 % случаев ЗГОЯ. Относительно редко встречаются II и IV стадии, в среднем до 5 % [14, 24, 25].
Биологическая схожесть ЗГОЯ со значительно более изученными аналогичными опухолями у мужчин позволила экстраполировать диагностические и лечебные подходы, применяемые при герминогенных опухолях яичка, на женщин [6, 26]. Из-за относительной редкости ЗГОЯ, в частности незрелой тератомы яичника, отсутствия рандомизированных исследований, посвященных данному заболеванию, опыт лечения в настоящее время накоплен в крупных федеральных онкологических центрах, где актуально проводить лечение данной когорты больных. Решающим этапом в диагностике и лечении пациенток при подозрении на наличие злокачественной тератомы яичника является хирургия. Принципы хирургического стадирования ЗГОЯ такие же, как и для эпителиальных опухолей. Определение стадии злокачественной тератомы проводится по системе FIGO и классификации TNM, применяемой при эпителиальных новообразованиях яичников [21, 25].
Современным принципом хирургического вмешательства при незрелой тератоме яичника у молодых пациенток является односторонняя сальпингоофорэктомия с сохранением контралатерального яичника и матки. Подобное органосохраняющее лечение проводится даже в случае распространенной стадии заболевания в связи с высокой чувствительностью опухоли к химиотерапии [22, 27, 28].
Важно, что такие консервативные операции всегда должны сопровождаться процедурами хирургического стадирования. Особенно это необходимо выполнять у пациенток с клинически ранними стадиями злокачественной тератомы яичника, которым в дальнейшем может быть предложено наблюдение. Так, женщинам детородного возраста с IА стадией (поражение одного яичника) и степенью дифференцировки неоплазии G1, после проведения органосохраняющего хирургического вмешательства с выполнением процедур стадирования, рекомендуется тщательное динамическое наблюдение [21, 22, 29]. Пациенткам, незаинтересованным в сохранении детородной функции, при всех стадиях незрелой тератомы яичника следует выполнить экстирпацию матки с придатками.
В настоящее время, согласно клиническим рекомендациям, хирургическое стадирование ЗГОЯ, в том числе и при незрелой тератоме, включает одностороннюю сальпингоовариоэктомию (рекомендуемый объем хирургического вмешательства вне зависимости от распространенности процесса у пациентов, желающих сохранить фертильность), резекция и/или биопсия контралатерального яичника выполняется только при макроскопических признаках поражения (во избежание снижения овариального резерва сохраненного яичника), резекция большого сальника по поперечной ободочной кишке, биопсия подозрительных участков брюшины. Обязателен забор смывов с париетальной брюшины диафрагмы, латеральных каналов, малого таза для цитологического исследования. Подвздошная и/или парааортальная лимфодиссекция выполняется у пациентов только при наличии увеличенных лимфоузлов, диагностированных рентгенологическими методами на дооперационном этапе или при интраоперационной ревизии. Целесообразно проводить срочное интраоперационное гистологическое исследование удаленного яичника для определения адекватного хирургического объема [21, 24, 25].
Остается спорным и до конца не определенным вопрос об объеме хирургического вмешательства, которое необходимо выполнить для полного стадирования незрелой тератомы яичника. Вышесказанное делает актуальным проведение проспективных многоцентровых исследований по лечению больных ЗГОЯ, в частности незрелой тератомы яичника. Так, если пациентке по результатам до- и интраоперационного обследования планируется проведение адъювантной химиотерапии, то выполнение полного стадирования, принятого при эпителиальном раке яичников, не имеет практического значения [6, 20].
Следует отметить, что при дисгерминоме яичника вероятность вовлечения регионарных лимфоузлов при I стадии составляет 10 %. По результатам, полученным рядом авторов, пятилетняя выживаемость статистически значимо не отличалась между группами без выполненной системной лимфаденэктомии, с лимфаденэктомией и отрицательными лимфоузлами и с положительными узлами (96,9; 97,7; 93,4 % соответственно). Полученные результаты подтверждают высокую чувствительность данной неоплазии к химиотерапии вне зависимости от стадии опухолевого процесса [6, 26, 28]. Следовательно, системная лимфаденэктомия при стадировании герминогенных опухолей яичников не является обязательной, но увеличенные лимфоузлы, как и другие подозрительные образования в брюшной полости, в рамках циторедуктивной операции должны быть удалены.
В случае двустороннего поражения яичников (IВ стадия), которое встречается достаточно редко при незрелой тератоме, стремлении пациентки к сохранению детородной функции предпочтительным является выполнение цистэктомии или резекции яичников, так как послеоперационная химиотерапия позволяет элиминировать опухолевые клетки в сохраненном яичнике [6, 14, 25].
При II–IV стадиях злокачественной тератомы в отсутствие поражения опухолью матки и контралатерального яичника и желании женщины сохранить фертильность, приемлемым является выполнение односторонней сальпингоовариоэктомии, резекции большого сальника [6, 22]. Данный объем хирургического вмешательства достаточен в связи с тем, что незрелая тератома редко поражает противоположный яичник. Так же стоит учитывать то, что данная неоплазия высоко чувствительна к платиносодержащим схемам химиотерапии и остаточная опухоль будет элиминирована из сохраненного яичника и вовлеченных в опухолевый процесс органов. По результатам ряда исследований сохранение части единственного яичника после его резекции не ухудшает отдаленные результаты лечения [5, 14, 20].
Актуальным в настоящее время принципом хирургического лечения при распространенных стадиях незрелой тератомы яичника является удаление всех видимых метастатических образований в брюшной полости, но без резекции смежных органов. Циторедуктивное вмешательство при данной гистологической форме опухоли должно стремиться к оптимальному объему, но без обширных, калечащих операций. Такой подход снижает риск развития послеоперационных осложнений, которые могут задержать начало химиотерапии [7, 20, 21].
Злокачественная тератома яичников высокочувствительна к платиносодержащим схемам химиотерапии, таким как BEP (блеомицин, этопозид, цисплатин), EP (этопозид, цисплатин) [6, 21, 22]. Применение схемы BEP достоверно увеличивает пятилетнюю выживаемость с 74,6 до 93,6 % по сравнению с другими режимами[4]. Проведение трех адъювантных курсов BEP является адекватным для пациенток без остаточной опухоли при IА G2, G3-III стадии заболевания. В случае наличия остаточной опухоли после проведения циторедуктивной операции и при IV стадии болезни, оптимальным является проведение четырех курсов химиотерапии [4, 6, 26].
Важно отметить, что резидуальная опухоль после окончания химиотерапии более 1 см является показанием для ее удаления. Это позволяет исключить наличие живой опухолевой ткани, развитие синдрома «растущей зрелой тератомы» [6, 25]. Нередко такой подход в лечении не соблюдается, если пациентка проходит терапию в онкологическом стационаре, не имеющем опыта в лечении данной редкой патологии, что ведет к прогрессивному росту остаточной опухоли. Еще одной отличительной, благоприятной особенностью незрелой тератомы является то, что в случае проведения неоадъювантной химиотерапии платиносодержащие схемы помогают достичь полного перехода незрелой тератомы в более высокодифференцированный вариант – зрелую тератому [6, 22, 24]. Вероятнее всего, данная гистологическая трансформация лежит в основе более длительной продолжительности жизни данной группы пациенток.
Отличительной особенностью динамического наблюдения пациенток с ЗГОЯ является увеличение периодичности и длительности осмотров в сравнении с эпителиальным раком яичников. График обследований при мониторинге пациенток после первичного или повторного лечения ЗГОЯ включает в себя физикальный и гинекологический осмотр, определение уровня АФП, бета-ХГЧ, выполнение ультразвукового исследования органов брюшной полости и малого таза каждые два месяца в течение первого года. Далее исследования проводятся раз в три месяца на второй и третий год наблюдения. Затем один раз в шесть месяцев в течение четвертого года, далее ежегодно, суммарно до 10 лет. Рентгенография или КТ органов грудной клетки выполняется каждые шесть месяцев первые два года, далее ежегодно, суммарно до 5 лет [21].
Стоит подчеркнуть, что соблюдение всех актуальных этапов лечения и проведение строгого динамического контроля позволяет увеличить продолжительность жизни данной когорты молодых, социально значимых пациенток. Так, пятилетняя выживаемость по данным отечественной и мировой литературы у пациенток с I стадией незрелой тератомы яичников составила 98,3 %, II стадией – 93,2 %, III и IV стадией – 82,7 и 72,0 % соответственно [6, 30].
Вследствие того, что злокачественной тератомой и рядом других ЗГОЯ страдают преимущественно девочки-подростки и молодые женщины репродуктивного возраста, одним из важнейших приоритетов у данной категории пациенток является сохранение гормональной и детородной функции. Как уже было отмечено, хирургическое вмешательство в основном несет органосохранный характер, а наиболее эффективная схема химиотерапии (BEP) обладает невыраженным тератогенным эффектом. Так, восстановление менструальной функции происходит у 85–95 % пациенток в течение 12 месяцев после окончания лекарственного лечения. Частота наступления беременности по данным литературы составляет 80–90 %, а количество выкидышей не превышает общие популяционные показатели [22, 31]. Если желаемая беременность не наступает самостоятельно, то возможно применение вспомогательных репродуктивных технологий после исключения всех факторов бесплодия. Показано, что на клетках герминогенных опухолей отсутствует экспрессия гормональных рецепторов, поэтому пациентке без значимого онкологического риска возможно проведение индукции суперовуляции с последующим ЭКО через 6 месяцев и более после последнего курса химиотерапии [22].
Представляется очевидной актуальность проведения адекватного лечения ЗГОЯ, в частности незрелой тератомы, учитывая молодой возраст пациенток и благоприятные показатели выживаемости. Высокая эффективность комбинации этопозида, цисплатина и блеомицина позволила воздержаться от выполнения расширенных циторедуктивных операций даже при распространенных формах заболевания, тем самым были созданы условия для сохранения овариальной и репродуктивной функции у молодого контингента больных.
Цель исследования – провести анализ клинического случая успешного лечения незрелой тератомы гигантских размеров, сопровождавшегося выраженным сдавлением нижней полой вены, мочеточников и значительной потерей массы тела, а также провести оценку сроков восстановления овариальной функции у пациентки после химиотерапии и проследить продолжительность безрецидивного периода для данной больной.
Материалы и методы исследования
В исследовании представлено клиническое наблюдение пациентки З. 1995 г.р., получавшей лечение в НМИЦ онкологии им. Н.Н. Блохина. Проведен анализ представленных в истории болезни данных физикального осмотра, лабораторных и инструментальных исследований, морфологического исследования, результатов химиотерапевтического и хирургического лечения, динамического наблюдения за пациенткой.
Результаты исследования и их обсуждение
Пациентка З., 28 лет, обратилась в поликлиническое отделение НМИЦ онкологии им. Н.Н. Блохина в марте 2023 г. с жалобами на значительное увеличение живота в объеме и боли во всех его отделах, общую слабость. Анамнез не отягощен. Пациентка замужем, беременностей не было. Менструальная функция не нарушена. При физикальном исследовании визуально и пальпаторно было выявлено умеренно болезненное опухолевое образование, занимающее всю брюшную полость и малый таз. Пациентка самостоятельно не передвигалась, только в медицинской коляске. ECOG-3.
Из анамнеза известно, что пациентка считает себя больной с ноября 2022 г., когда отметила увеличение живота в объеме. По месту жительства в медицинском учреждении была исключена патология со стороны желудочно-кишечного тракта. В связи с продолжающимся ростом размеров живота и появлением болевого синдрома, в феврале 2023 г. выполнена КТ органов брюшной полости (ОБП) и органов малого таза (ОМТ) с внутривенным контрастированием (рис. 2).
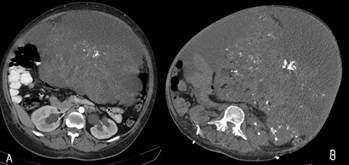
Рис. 2. А – КТ ОБП от 05.02.2023 г. В – КТ ОБП от 06.06.2023 г.
Срез на уровне почечных сосудов
Обнаружено кистозно-солидное образование размерами 22х17 см, занимающее весь малый таз и брюшную полость, предположительно исходящее из правого яичника. По капсуле правой доли печени определялись единичные опухолевые диссеминаты до 1–2 см. Отмечено двустороннее расширение ЧЛС почек справа до 32 мм, слева до 40 мм. По результатам лабораторных методов диагностики выявлено повышение концентрации опухолевых маркеров в сыворотке крови: АФП – 6013 МЕ/мл, ЛДГ – 751 Ед/л, бета-ХГЧ повышен незначительно.
По решению онкологического консилиума, учитывая возраст пациентки, высокий уровень маркеров АФП, ЛДГ, быстрый рост опухоли, размеры и структуру неоплазии по результатам УЗИ, КТ, МРТ, данная клиническая ситуация была расценена как ЗГОЯ, вероятнее всего незрелая тератома. В связи с тяжелым общим состоянием (ECOG-3) пациентки, распространенностью опухолевого процесса (большие размеры образования яичника, рентгенологические признаки наличия диссеминатов по капсуле печени), а также настойчивое желание больной сохранить детородную функцию, принято решение о проведении трех курсов неоадъювантной химиотерапии без морфологического подтверждения неоплазии.
Химиотерапия проведена по схеме ВЕР (блеомицин 30 мг 1, 3, 5 дни, этопозид 100 мг/м2 1–5 дни, цисплатин 20 мг/м2 1–5 дни). Перед началом лечения выполнена нефростомия с двух сторон для предотвращения дальнейшего расширения ЧЛС вследствие компрессии мочеточников. Проведение химиотерапевтического лечения в межкурсовых интервалах протекало с развитием нейтропении 1–2 степени, анемии 2–3 степени, тошноты 1 степени. Проводилась сопроводительная терапия: антиэметогенная, инфузионная, антибактериальная, гемотрансфузионная терапия, коррекция нейтропении стимуляторами гемопоэза. По результатам лекарственного лечения, которое было закончено в мае 2023 г., отмечено снижение уровня опухолевых маркеров: АФП до 922 МЕ/мл, бета-ХГЧ 1,7 мМЕ/мл, ЛДГ до 600 Ед/л. При контрольном УЗИ ОБП и ОМТ отменено незначительное уменьшение размеров новообразования, предположительно исходящего из правых придатков матки. Общее состояние пациентки улучшилось (ECOG-1). После повторного онкологического консилиума принято решение о проведении циторедуктивного хирургического вмешательства в качестве второго этапа лечения.
Следует отметить, что пациентка на плановую госпитализацию в июне 2023 г. для проведения хирургического лечения не явилась. Повторно больная обратилась в поликлинику НМИЦ онкологии им. Н.Н. Блохина через месяц, в июле 2023 г., в тот же день пациентка была экстренно госпитализирована в отделение онкогинекологии НИИ клинической онкологии им. Н.Н. Трапезникова.
При поступлении в стационар состояние пациентки оценивалось как среднетяжелое (ECOG-3). Данная клиническая картина была обусловлена большим размером опухоли, кахексией, анемией средней степени тяжести, массивным тромбозом глубоких вен левой нижней конечности. Самостоятельно пациентка не передвигалась, занимала в кровати вынужденное положение лежа на боку из-за гигантских размеров опухоли. Обращала на себя внимание выраженная отечность обеих нижних конечностей, больше слева и трофические нарушения кожного покрова левой голени.
Тем не менее отмечено дальнейшее снижение уровня опухолевых маркеров (июль 2023 г.): АФП – 96 МЕ\мл, β-ХГЧ – 1,30 мМЕ/мл, ЛДГ– 240 Ед/л. По результатам КТ ОБП и ОМТ с внутривенным контрастированием в июле 2023 г. (рис. 2) выявлена рентгенологическая картина гигантского кистозно-солидного образования, размерами 407х324х229 мм, активно накапливающего контрастный препарат, с четкими крупнобугристыми контурами, последнее занимает весь малый таз и брюшную полость. Яичники отдельно не определяются, матка распластана по нижнему полюсу новообразования. Органы брюшной полости сдавлены, без патологии. Очаги по капсуле печени не определяются. Достоверных признаков увеличения лимфатических узлов таза, брюшной полости и забрюшинного пространства нет. Просвет нижней полой вены (НПВ) ниже места отхождения почечных вен не визуализируется на протяжении 2 см. Выявлен окклюзивный тромбоз НПВ ниже места ее сдавления опухолью.
По итогам ультразвукового исследования почек и вен нижних конечностей в рамках последней госпитализации в июле 2023 г. определено, что нефростомы с обеих сторон функционируют, при этом ЧЛС незначительно расширены. В просвете глубоких вен левой нижней конечности определяются тромботические массы с переходом на сафено-феморальное соустье, подвздошные вены слева и НПВ. Проведена консультация сердечно-сосудистого хирурга, учитывая наличие окклюзивного тромбоза НПВ ниже уровня почечных вен, рекомендовано имплантировать кава-фильтр в НПВ в раннем послеоперационном периоде, так как технически выполнить его установку на предоперационном этапе невозможно из-за щелевидного сужения НПВ извне опухолью.
Учитывая общее состояние пациентки и сопутствующую патологию, проводилась предоперационная подготовка в виде инфузионной терапии, гемотрансфузий, антикоагулянтной терапии низкомолекулярными гепаринами в лечебных дозах, также была инициирована парентеральная нутритивная поддержка (рис. 3).
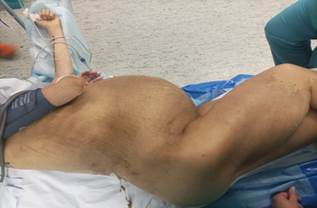
Рис. 3. Пациентка на операционном столе
После анестезиологической подготовки 18.07.2023 г. проведено плановое хирургическое вмешательство в объеме аднексэктомии справа, резекции левого яичника, резекции большого сальника по поперечной ободочной кишке, аортокавальной лимфаденэктомии, множественной биопсии брюшины. Произведены смывы с брюшины малого таза, латеральных каналов и диафрагмальных поверхностей для цитологического исследования.
Из протокола операции: при ревизии брюшной полости установлено, что опухоль кистозно-солидного строения примерно 40–45 см в диаметре исходит из правого яичника. Левый яичник, матка и маточные трубы интимно спаяны с опухолью. После выделения из спаек визуализирован левый яичник, который несколько увеличен, с кистозным плотным образованием до 3–4 см в зоне ранее подпаянного новообразования правого яичника. Верхний полюс опухоли граничит с левой и правой долей печени, желчным пузырем, левым куполом диафрагмы, при этом петли тонкой кишки «распластаны» на новообразовании и оттеснены вверх. Капсула правой и левой доли печени, большой сальник визуально не изменены. На большом протяжении опухоль в сращениях с нисходящей ободочной, сигмовидной кишкой, ректосигмоидным отделом толстой кишки и их брыжейкой. Визуализируются расширенные до 1–1,5 см в диаметре с двух сторон мочеточники. Нижний полюс опухоли расположен глубоко в прямокишечно-маточном пространстве, в спайках с брюшиной малого таза. После удаления опухоли (рис. 4) при повторной тщательной ревизии забрюшинного пространства выявлено, что в аортокавальном промежутке определяются увеличенные до 1–1,5 см плотные лимфатические узлы. Визуально париетальная и висцеральная брюшина верхнего отдела брюшной полости и малого таза не изменена.
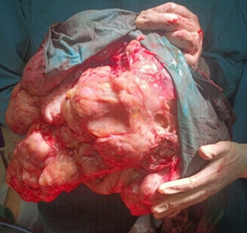
Рис. 4. Удаленная опухоль
Интраоперационно проведен консилиум с химиотерапевтами отделения противоопухолевой лекарственной терапии № 4 НИИ клинической онкологии им. Н.Н.Трапезникова. Учитывая предполагаемый гистологический тип опухоли (незрелая тератома) правого яичника, отсутствие данных за диссеминацию опухолевого процесса по брюшной полости, малому тазу по результатам интраоперационной ревизии, а также молодой возраст и настойчивое желание пациентки сохранить репродуктивную функцию, принято решение о выполнении органосохранного хирургического вмешательства. Время операции составило 3 часа 30 мин. Кровопотеря 600 мл, гемотрансфузия не проводилось.
После пробуждения из состояния наркоза пациентка в сопровождении анестезиологической бригады была переведена в операционную рентгенохирургического отделения НИИ клинической и экспериментальной радиологии НМИЦО им. Н.Н. Блохина. Ниже места отхождения почечных вен в просвете нижней полой вены установлен кава-фильтр. Далее пациентка находилась под наблюдением в отделении реанимации № 1 НИИ клинической онкологии им. Н.Н. Трапезникова. На вторые сутки больная переведена в отделение онкогинекологии. Пациентка активизирована на вторые послеоперационные сутки, проводилась парентеральная нутритивная поддержка, инфузионная, антибактериальная, антикоагулянтная терапия. Течение послеоперационного периода без осложнений. При контрольном УЗИ мочевыделительной системы установлено, что ЧЛС обеих почек не расширена. В плановом порядке на седьмые послеоперационные сутки выполнена внутривенная урография, при которой выявлено, что мочеточники проходимы, нефростомы удалены. Пациентка выписана в удовлетворительном состоянии на девятые послеоперационные сутки с рекомендациями о продолжении длительно антикоагулянтной терапии.
По данным гистологического исследования операционного материала имеет место многоузловой опухолевый узел размерами 42х30х19 см, на разрезе солидно-кистозного вида. Кисты с гладкой внутренней поверхностью, заполнены полупрозрачным содержимым, солидный компонент представлен плотноэластичной белесовато-желтой тканью. Узел представлен обширными очагами некроза, гиалинизированной фиброзной тканью, хрящевой, жировой и костной тканью, а также кистами, выстланными многослойным плоским и интестинальным эпителием, злокачественные опухолевые клетки не обнаружены (рис. 5). С учетом данных анамнеза морфологическая картина соответствует герминогенной опухоли с признаками полного лечебного патоморфоза злокачественного компонента, резидуальная опухолевая ткань представлена структурами зрелой тератомы. В 1 из 17 аортокавальных лимфоузлов морфологическая картина соответствует метастазу герминогенной опухоли с признаками полного лечебного патоморфоза. В резецированной части левого яичника, большом сальнике, брюшине данных за метастатическое поражение не обнаружено. Установлена по системе стадирования рака яичников TNM и FIGO патоморфологическая стадия заболевания pT1c1N1M0, IIIC.
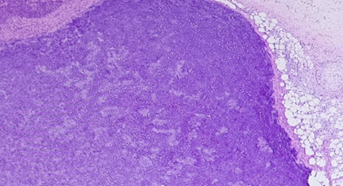
Рис. 5. Зрелая тератома, представлена мезодермальным компонентом: хрящом и жировой тканью
Пациентка повторно обсуждена на онкологическом консилиуме. Учитывая нормальный уровень маркеров, отсутствие остаточной опухоли в малом тазу и брюшной полости по результатам интраоперационной ревизии, данные морфологического исследования о полном лечебном патоморфозе неоплазии, пациентке рекомендовано динамическое наблюдение. Больная информирована о строгой периодичности мониторинга при выбранной тактике.
Через два месяца после окончания лечения при контрольном осмотре в поликлинике НМИЦ онкологии им. Н.Н. Блохина состояние пациентки оценено как ECOG-1. Опухолевые маркеры АПФ, бета-ХГЧ, ЛДГ в пределах нормы. По данным гинекологического осмотра и инструментальных методов обследования без признаков рецидива заболевания. Пациентка отметила прибавку в весе на 5 кг. На фоне продолженной антикоагулянтной терапии по результатам УЗИ тромботические массы в венах нижних конечностей не определяются. Рекомендовано удаление кава-фильтра через 3–4 месяца.
Дальнейшее наблюдение за пациенткой в течение 10 месяцев не обнаружило признаков прогрессирования болезни. Менструальная функция восстановилась через 7 месяцев после окончания химиотерапии, что вселяет надежды на сохранение фертильности. В перспективе пациентка планирует беременность.
Заключение
Продемонстрированный клинический случай лечения пациентки с гигантской незрелой тератомой является ярким примером развития данного вида опухолей у социально значимой группы людей, а именно молодых женщин. Неспецифичность клинической картины незрелой тератомы у данной пациентки потребовала комплексного подхода к диагностике, используя не только клинико-лабораторные данные, но и рентгенорадиологические методы. Учитывая молодой возраст женщины, органосохраняющие лечение являлось приоритетным, несмотря на наличие распространенной стадии заболевания и отягощенного соматического статуса (ECOG-3). Проведение комплексного лечения с использованием платиносодержащей схемы химиотерапии, а именно BEP, с последующим хирургическим лечением позволило сохранить гормональную и детородную функции с соблюдением правил онкологической безопасности.
Данное клиническое наблюдение демонстрирует актуальность дальнейшего изучения и совершенствования аспектов диагностики и лечения ЗГОЯ и, как следствие, улучшение качества и продолжительности жизни пациентов. В частности, незрелая тератома яичников является редкой неоплазией с относительно благоприятным течением, которая обычно поражает женщин молодого возраста. Стоит учитывать, что данная когорта больных является потенциально курабельной и социально значимой группой.
Описанный клинический случай можно рассматривать как пример своевременно начатого и тактически правильного лечения. Платиносодержащая химиотерапия, консервативная хирургия и последующее строгое динамическое наблюдение позволили добиться излечения больной, сохранить фертильность, естественный гормональный фон молодой пациентке, избежать возникновения резистентности опухоли к химиопрепаратам, тем самым дать шанс на полное излечение и реализацию детородной функции.
Следует подчеркнуть, что, учитывая редкость незрелой тератомы и ЗГОЯ в целом, данные пациентки должны маршрутизироваться в специализированные медицинские центры, имеющие опыт лечения больных герминогенными опухолями. Таким образом, также будут созданы условия для проведения проспективных рандомизированных исследований в подгруппах больных с различными прогностическими вариантами болезни, что позволит расширить когорты пациенток, которым можно безболезненно отказаться от проведения химиотерапии после хирургического лечения. Другим приоритетным направлением является разработка наиболее эффективных схем лечения химиорезистентных злокачественных герминогенных неоплазий яичников. Еще одной тенденцией последующих исследований по изучению ЗГОЯ, в том числе и при злокачественной тератоме яичников, является пристальное внимание к длительному наблюдению за девушками и молодыми женщинами, их овариальной и репродуктивной функции, с акцентом на изучение тератогенного эффекта после проведенной химиотерапии.
Библиографическая ссылка
Трошнина Е.А., Мустафина Е.А., Князев Р.И., Шевчук А.С., Анохин А.Ю., Мальцева С.Д. КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ ОРГАНОСОХРАНЯЮЩЕГО ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ГЕРМИНОГЕННОЙ ОПУХОЛИ ЯИЧНИКОВ С ОБЗОРОМ ЛИТЕРАТУРЫ // Современные проблемы науки и образования. 2024. № 3. ;URL: https://science-education.ru/ru/article/view?id=33500 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33500



