Старение является основным фактором риска развития многих заболеваний. Клеточное старение – это гомеостатический биологический процесс, направленный на предотвращение размножения поврежденных клеток и опухолевой трансформации. Имеются доказательства того, что стареющие клетки накапливаются в тканях систем органов и могут предрасполагать к возникновению возрастзависимых заболеваний или усугублять их течение. Считается, что накопление повреждений происходит случайным образом, что объясняет большое разнообразие фенотипов старения, даже у монозиготных близнецов. Взаимодействие между генетическим фоном, факторами окружающей среды и случайным характером возрастного накопления необратимых повреждений ДНК организма также может определять вероятность развития конкретного возрастного заболевания. Исследованиям старения препятствуют его вариабельность и отсутствие универсального маркера для однозначного выявления стареющих клеток.
Существует множество триггеров клеточного старения: укорочение теломер, активация онкогенов, присутствие активных форм кислорода. Старение может быть связано с дисфункцией митохондрий, их слиянием или фрагментацией. Стареющие клетки также претерпевают морфологические изменения. Клетки становятся крупнее, уплощаются и приобретают неправильную форму [1]. Эти изменения более заметны in vitro, чем in vivo и, по-видимому, вызваны перестройками цитоскелета и изменениями состава клеточных мембран. Чтобы лучше понять роль стареющих клеток в физиологических и патологических состояниях, важно иметь возможность визуализировать их. До сих пор исследованиям клеточного старения препятствовало отсутствие универсального, специфичного и широко применимого показателя клеточного старения. В данной работе авторы рассматривают липофусцин в качестве наиболее универсального маркера старения. Липофусцин – сложный комплекс химических веществ, имеющий различные морфологические физические и химические свойства, при этом обладающий флюоресценцией [2].
Не обладая гомогенным составом, структура липофусцина может варьироваться – как в различных тканях, так и среди разных видов животных. Основными компонентами являются белки (30–70%), жиры (20–50%) и следовые количества (1–3%) металлов (Fe3+, Fe2+, Cu2+, Zn2+, Al3+, Mn2+, Ca2+) с небольшим количеством углеводородов [3]. Согласно некоторым источникам, атомный состав пигмента представлен C (57%,) H (9,3%), N (9,1%) и S (1,6%) [4].
Окисленные белки как основная часть липофусцина наиболее гетерогенны и являются набором различных аминокислот. Триглицериды, свободные жирные кислоты, холестерол и фософлипиды – основные составные части липидного профиля липофусцина [5].
Есть ряд теорий, объясняющих накопление липофусцина. Большинство из них строятся вокруг окисления белков и липидов свободными радикалами.
Теория свободно-радикального окисления, изначально изложенная Д. Харманом в 1956 г., и затем расширенная многими авторами, подразумевает формирование реактивных форм кислорода при участии дефектных митохондрий. Впоследствии образуются альдегиды, и происходит сшивка с аминогруппами лизосомальных ферментов, что, вероятно, объясняет неспособность лизосом к разрушению составных компонентов липофусцина. Группе ученых удалось сформировать искусственный липофусцин в тканях печени, почек, мозга и сердечной мышцы пероксидацией белков и липидов в ультрафиолетовом свете [6]. Флюоресцентный спектр полученного цероида совпадал с аналогичным спектром естественного липофусцина.
Кроме того, известно, что липофусцин способен самостоятельно блокировать активность лизосомальных ферментов in vitro, протеаз, снижая активность некоторых из них на 90%, формируя таким путем порочный круг [7].
Благодаря процессам окислительной модификации и полимеризации белков в составе липофусцина они становятся невосприимчивы к ферментативному расщеплению и выведению из клетки, накапливаясь в лизосомах и клеточной цитоплазме. Клетки, активно участвующие в делении, эффективно разбавляют пигмент и имеют низкий уровень последнего в цитоплазме. Напротив, в постмитотических клетках накопление приводит к сенесценции. В результате процессов окислительной модификации и полимеризации белков в составе липофусцина они становятся устойчивыми к ферментативному расщеплению и выводу из клетки, накапливаясь в лизосомах и цитоплазме. Клетки, активно участвующие в делении, успешно снижают уровень липофусцина, поэтому его концентрация остается низкой. Однако в постмитотических клетках накопление липофусцина вызывает старение. Эти процессы взаимосвязаны, поэтому многие исследователи считают липофусцин надежным маркером старения клеток [8, 9].
Клеточная сенесценция – один из основных механизмов как нормального развития и гомеостаза, так и многих патологических процессов [10, 11].
Гистологически включения липофусцина желто-коричневые с широким спектром оттенков и интенсивностью. Формы включений варьируют от крупных овальных до мелкозернистых. Ультраструктурно липофусцин окружен трехслойной мембраной, аналогичной лизосомальной. При электронной микроскопии можно выделить ряд форм: гранулярные, гомогенные, пластинчатые и смешанные [12]. Выявляется пигмент как при рутинных окрашиваниях парой гематоксилин/эозин, так и специальными методами окраски, такими как Судан черный Б, по Шморлю, Люксол и др.
Липофусцин обладает естественной аутофлуоресценцией, но из-за гетерогенности состава спектр эмиссии колеблется в широких пределах. Основные волновые характеристики эмиссии находятся в диапазоне от 400 до 700 нм, с максимумом на 578 нм, возбуждение с максимумом на 364 нм [13]. В связи с гетерогенной структурой белков специфических антител не существует.
Судан черный Б – краситель, известный более 60 лет. Он обладает высоким родством к липидам и включениям, содержащим липиды, окрашивает включения в парафиновых срезах в черно-коричневый цвет, в замороженных срезах – в сине-черный; при связывании с липофусцином нивелирует естественную аутофлуоресценцию, что используется для иммуногистохимического окрашивания с целью снижения шума фоновой флуоресценции и повышения отношения сигнал/шум [14].
Окраска проста и дает стабильные и воспроизводимые результаты при применении. Работает как на замороженных срезах, так и на парафиновых, в том числе и архивном материале. К слову, данные свойства выгодно отличают методику определения липофусцина от способа идентификации известного маркера старения – β–галактозидазы (SA–β–gal), окрашиваемого хромогенным субстратом X-gal. Так, при различных условиях культивирования клеток уровень SA–β–gal может повышаться, давая ложноположительный результат. Ограничивает спектр применения данного анализа тот факт, что его можно использовать только на свежих или замороженных тканях (в отличие от идентификации липофусцина) [15, 16].
Кроме того, большинство перечисленных способов определения признаков старения достаточно дорогостоящие и затруднительны в приобретении. В отечественной литературе способ определения липофусцина в качестве маркера старения используется неоправданно редко. Таким образом, целью данного практически ориентированного исследования является характеристика распределения и локализации скоплений липофусцина у старых крыс с применением различных способов окрашивания липофусцина как одного из признаков старения в гистологических срезах.
Материалы и методы исследования
В исследовании были использованы самцы белых беспородных лабораторных крыс, составившие группу молодых (n=25) и группу старых (n=28) особей: молодые 6–7 месяцев, с массой тела 197–221г, и старые (старше 20 месяцев, массой тела 565–619г). Животные предоставлены виварием лаборатории физиологии, морфологии, генетики и биомедицины ФГБОУ ВО «Астраханский государственный университет» (Россия, Астрахань). В работе авторы руководствовались рекомендациями Commission of the European Communities, 86/609/EEC, а также «Положением о содержании и использовании лабораторных животных в ФГБОУ ВО Астраханский ГМУ Минздрава России».
Вырезку ткани почки осуществляли вертикальным разрезом через пазуху, верхний, нижний полюс и наружный край.
Препараты печени извлекались продольным разрезом от ворот печени до диафрагмальной поверхности, таким способом, чтобы площадь препарата составляла не менее 120 мм2.
Блоки сердечной мышцы извлекались вырезкой от верхушки сердца до основания аорты через левый желудочек. Для идентификации гранул липофусцина использовали участки препарата с продольным, структурированным расположением мышечных волокон, без видимых признаков травмы, некроза и инфильтрации.
После фиксации в 4%-ном параформе и стандартной гистологической проводки препаратов изготавливались парафиновые срезы в 4–6 мкм толщиной для окраски парой гематоксилин-эозин, Судан черный Б и по Шморлю.
Окраска гематоксилином-эозином производилась классическим методом, а Суданом черным Б – в модифицированном варианте, где депарафинирование завершалось на этапе 70% спирта в силу нерастворимости Судана в воде. Окраску среза производили, накрыв каплю покровным стеклом во избежание высыхания спиртового раствора при продолжительной экспозиции (более 15 минут), контрокрашивание ядер – нейтральный красный. Окраска по Шморлю 10 минут – хлорид железа 1% и Гексацианоферрат (III) калия 1%, приготовленные непосредственно перед окрашиванием.
Изображения препаратов отцифровывались с помощью ImageView вер. 4.11.22913 и микроскопа Meiji Techno MT6000 с CMOS камерой.
Вычисляли размеры включений липофусцина, площадь и процент заполнения ткани в 0,1 мм2. Морфологический анализ и сегментацию оцифрованных гистологических препаратов производили в QuPath 0.51.
Статистика. Нормальность вариационных рядов определяли с помощью критериев Шапиро–Уилка и Колмогорова–Смирнова. Данные представлены в виде средней величины (М) и стандартного отклонения (s). Если вариационные ряды не соответствовали распределению Гаусса, то статистическую обработку осуществляли непараметрическим методом с помощью дисперсного анализа с вычислением медианы (Ме) и P5-, P95-процентилей. Уровень значимости различий признаков соответствовал р≤0,05. Анализ производили с помощью дискриптивных статистических методик программы Statistica 11,0 (США, StatSoft).
Результаты исследования и их обсуждение
Почка
Включения липофусцина отметили в 28,5% препаратов старых крыс со средней площадью 0,63±0,08 µм2. В группе молодых животных около 8% препаратов содержали небольшие включения липофусцина. Следует сказать, что извитая часть проксимального канальца состоит из 2 отдельных сегментов (S1 и S2), различающихся по уровню трансмембранного транспорта метаболитов. Метаболиты, отфильтрованные клубочком, реабсорбируются из первичной мочи клетками S1 через апикальную мембрану (рис. 1).
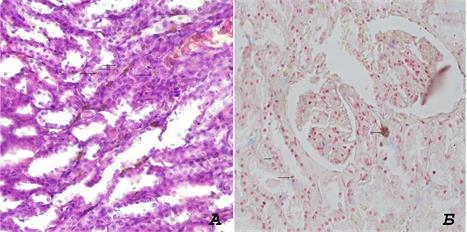
Рис. 1. Ткань почки. (А) окраска гематокислином-эозином. (Б) Судан черный Б. Увеличение х400. Стрелками указаны скопления липофусцина
В то же время клетки S2 имеют высокое содержание рецепторов базолатеральных переносчиков жирных кислот и органических анионов, которые могут импортировать субстраты непосредственно из крови. Более того, они более плотно упакованы пероксисомами, которые могут генерировать липидные субстраты путем бета-окисления длинноцепочечных жирных кислот. Между тем, избыток переносчиков свободных жирных кислот в клетках S2 может накапливаться в специализированных многослойных образованиях, обнаруженных в этой области, для предотвращения липотоксичности [17]. Данное исследование подтвердило, что в 87,5% установленных случаев пигмент локализовался в cегментах S2 проксимальных извитых канальцев, накапливаясь ближе к основанию микроворсинок кубического эпителия. В 12,5% случаев в сегментах S1 проксимальных канальцев почки и единичные включения в дистальных извитых канальцах мозгового вещества почки. В последнем случае липофусцин аккумулировался в крупные образования диаметром до 26 µм.
Интенсивная фоновая окраска цитозоля эпителия проксимальных канальцев осложняет выделение включений липофусцина и их идентификацию. Оптимальным способом окраски почечной ткани является Судан черный Б благодаря большей контрастности включений.
Печень
В ткани печени 25% препаратов старых крыс содержали включения липофусцина. Среди молодых животных зарегистрирован всего 1 случай, или 4% от общего числа.
Пигмент концентрировался вокруг центральной вены и вдоль синусоидных капилляров, при этом диффузно заполняя цитоплазму гепатоцитов на 64–72%, с крупными включениями высокой интенсивности и средней площадью 1,38±0,1 µм2, имеющими тенденцию к слиянию в крупные агломераты до 69 µм2 (рис. 2).
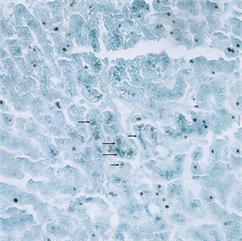
Рис. 2. Печень. Окраска по Шморлю. Увеличение х400. Стрелками указаны скопления липофусцина
Присутствие пигмента в печени (и почках) часто сочеталось с патоморфологическими изменениями ткани в виде фиброза, склерозирования и других признаков дегенерации. Наблюдаемый комплекс морфологических изменений можно объяснить функциональным перенапряжением метаболических процессов в оставшихся неповрежденных клетках и нарастающим оксидативным стрессом [18]. В печени, которая является метаболически высокоактивным органом, выделение липофусцина затруднено из-за большого количества других типов пигментов. Могут встречаться железосодержащие пигменты, скопления желчных кислот, жировые включения, формалиновый пигмент и иные, которые выглядят сходно при окрасках ШИК или парой гематоксилин и эозин. Использование такой специфичной окраски, как Судан черный Б, позволяет избежать ошибочной идентификации.
Сердечная мышца
В первой группе не обнаружили липофусцин-положительных клеток.
Среди всего массива препаратов сердечной мышцы старых крыс в 14,2% случаев авторы обнаружили зоны интерстициального фиброза, отека и гипертрофии мышечных волокон. Включения липофусцина в сердечной мышце преимущественно наблюдались в перинуклеарной зоне цитоплазмы в виде веретенообразных скоплений. Включения, как правило, овальной формы, с эксцентриситетом в 0,72±0,03. Средняя площадь гранул составила 0,42±0,02µм2. Площадь включений в зоне 0,1мм2 у животных старше 24 месяцев составляла 0,92%, в группе молодых – 0,13% (рис. 3).
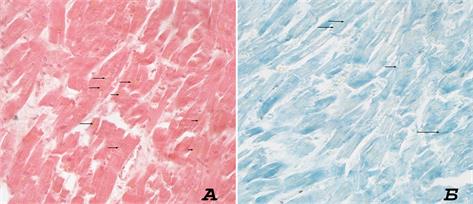
Рис. 3. Миокард. (А) окраска гематокислином-эозином. (Б) по Шморлю. Увеличение х400. Стрелками указаны скопления липофусцина
Данные исследования согласуются с большим количеством ранее проведенных работ, в которых доказано наличие обратной связи между возрастом и количеством накопленного липофусцина в тканях [10, 11, 19, 20].
Согласно полученным данным, выраженность и интенсивность пигментации у животных старшей возрастной группы действительно были выше. Среди трех исследуемых органов сердце оказалось наиболее подверженным образованию цероида, но при этом включения носили мелкоочаговый характер, не имея тенденцию к слиянию, составляя незначительную часть цитоплазмы.
Два других органа – печень и почки – значительно реже подвергались накоплению липофусцина. Принимая во внимание, что исследование ограничивалось использованием микроскопии в светлом поле, включения липофусцина размером менее 0,5мкм могли остаться незамеченными или представлять сложность для идентификации. Это обстоятельство, вероятно, служит объяснением относительно низкого процента липофусцин-положительных тканей у молодых животных.
Во всех случаях наблюдений было отмечено, что пигмент локализуется в клеточных зонах с высокой метаболической активностью (транспорт жирных кислот клетками S2 проксимальных канальцев) и большим количеством митохондрий (вокруг центральной вены печеночной дольки, а также в перинуклеарной зоне цитоплазмы кардиомиоцитов. Известно, что примерно 25–30% цитоплазмы клеток сердца занято митохондриями, обеспечивающими сократительную функцию миофибрилл. Эпителий проксимальных канальцев почки, активно участвующий в реабсорбции, гепатоциты печеночных долек также относятся к высокоактивным клеткам с большим количеством митохондрий. Аккумуляция липофусцина находится в тесной взаимосвязи с процессами аутоокисления ненасыщенных жирных кислот и оксидативным стрессом в целом, при этом нарушения функции митохондрий выступают в роли основного источника продуктов оксидации.
Печень, почки и сердце играют важную роль в поддержании обмена веществ, удалении продуктов распада, постоянстве химического состава, осмотического давления и устойчивости основных физиологических параметров организма. Чрезмерная функциональная нагрузка на уровне данных органов способствует отложению липофусцина в их клетках, что приводит к их патологии и снижению способности поддерживать гомеостаз с возрастом.
Дизайн исследования намеренно включал два гистохимических метода выявления – Судан черный Б и окраску по Шморлю – для сравнения удобства и информативности полученных препаратов. Оказалось, что окраска по Шморлю обладает определенной неспецифичностью и интенсивно окрашивала цитоплазму проксимальных извитых канальцев почки, что сильно затрудняло поиск включений. Напротив, цитоплазма мышечных волокон при окраске по Шморлю, обладая низким восстановительным потенциалом, хорошо контрастировала с темно-голубыми включениями липофусцина. Кроме того, был замечен необычный эффект интенсивной положительной окраски эндотелия и внутренней эластической пластинки артерий крупного и среднего калибра почки, чего не наблюдалось в других органах.
Заключение
В результате проведенного исследования удалось выявить локализацию скопления липофусцина и дать характеристику его распределения: локализация и паттерн распространения включений липофусцина не изменялись в разных возрастных группах, лишь затрагивали выраженность и количество включений. Липофусцин – один из надежных признаков клеточной сенесценции.
Судан черный Б подтвердил свой статус золотого стандарта, продемонстрировав слабое фоновое окрашивание цитоплазмы клеток, что существенно упростило обнаружение включений липофусцина.
Проведенное исследование позволяет говорить о возможной целесообразности включения предложенного метода окрашивания срезов при проведении рутинного гистологического исследования по показаниям таких тканей, как миокард, почка, печень, в дополнение к существующим методам.
Библиографическая ссылка
Тризно М.Н., Куртусунов Б.Т., Тризно Е.В., Мажитова М.В. ВЫЯВЛЕНИЕ КЛЕТОК ВИСЦЕРАЛЬНЫХ ОРГАНОВ, ГИПОРЕЗИСТЕНТНЫХ К ЛИПОФУСЦИНОГЕНЕЗУ // Современные проблемы науки и образования. 2024. № 3. ;URL: https://science-education.ru/ru/article/view?id=33499 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33499



