Колоректальный рак (КРР) является четвертым наиболее распространенным видом рака и третьей по значимости причиной смертности во всем мире [1]. Около 25% пациентов с КРР на момент постановки диагноза имеют метастазы, чаще всего метастазы в печени [2], а у 50% пациентов, получавших химиолучевую терапию, развиваются метастазы в брюшную полость [2]. Развитие КРР представляет собой многоэтапный процесс, включающий ряд гистологических, морфологических и генетических аномалий, трансформирующих здоровые эпителиальные ткани кишечника в аденомы, которые в конечном итоге прогрессируют в злокачественные опухоли.
Воспаление кишечника – известный фактор риска КРР, который формирует локальную воспалительную среду, обогащенную опухолевыми, эндотелиальными клетками, опухоль-ассоциированными фибробластами, иммунными клетками, обладающими супрессорными свойствами, и секретируемыми ими цитокинами и факторами роста. Сложные взаимодействия аберрантно экспрессируемых цитокинов, хемокинов, факторов роста и ферментов ремоделирования матрикса способствуют патогенезу КРР и вызывают системные реакции, которые влияют на исход заболевания [2, 3].
Известно, что для 80% всех опухолевых клеток характерно наличие экспрессии или гиперэкспрессии EGFR (рецептора эпидермального фактора роста человека), что коррелирует с менее благоприятным прогнозом выживаемости пациентов и высоким риском метастазирования. Гиперэкспрессия EGFR является фактором прогрессирования колоректального рака [4, 5], однако в то же время служит показанием для проведения таргетной терапии.
Разработка нейтрализующих антител, нацеленных на EGFR, таких как цетуксимаб и панитумумаб, создала прорыв в лечении метастатического колоректального рака (мКРР) [4–6]. Антитела против EGFR в сочетании с химиотерапией продлевают выживаемость у пациентов с мКРР и являются стандартным компонентом терапии [4–6]. Однако многие пациенты оказываются невосприимчивы к этому лечению, а у тех, кто реагирует на него, со временем повышается риск развития вторичной резистентности [7, 8]. По мнению исследователей, механизмы устойчивости опухолевых клеток могут включать либо приобретение новых мутаций, либо негеномную активацию альтернативных сигнальных путей, что сопряжено с изменением продукции различных биологически активных соединений, в том числе и цитокинов [4, 8, 9, 10].
В настоящее время продолжается поиск наиболее эффективных диагностических тестов и биомаркеров, которые позволят определить возможность применения терапии против EGFR и выбрать комбинированные подходы к таргетной терапии при КРР [11].
Учитывая взаимосвязь опухолевого роста, ответа на лечение и состояния иммунной системы больных, а также то, что цетуксимаб и панитумумаб являются антителами, представляет несомненный интерес оценка участия факторов иммунной системы в развитии эффекта анти-EGFR терапии.
Целью исследования являлось определение влияния проведения анти-EGFR терапии на цитокиновый профиль крови у больных метастатическим КРР при различном эффекте лечения.
Материалы и методы исследования
В исследование включены 25 пациентов, проходивших лечение в отделении противоопухолевой лекарственной терапии ФГБУ «НМИЦ онкологии» Минздрава России г. Ростова-на-Дону. Средний возраст – 59,4±10,8 года, мужчин – 13 (52%) и женщин – 12 (48%). Все пациенты имели морфологически подтвержденный диагноз мКРР. Все пациенты подписывали информированное согласие на участие в исследовании. На доклиническом этапе проводилась оценка мутационного статуса обследуемых, в результате которой мутаций в генах KRAS, NRAS и BRAF не выявлено, MSI также не выявлена. Больные получали 4 цикла химиотерапии по схеме mFOLFOX6 и таргетную анти-EGFR терапию цетуксимабом или панитумумабом, после чего проводили оценку ее эффективности согласно международным критериям оценки ответа солидных опухолей на терапию (Response Evaluation Criteria in Solid Tumors (RECIST), версия 1.1 (2016)). На основе полученных данных пациенты были разделены на подгруппы в зависимости от ответа на терапию.
Забор периферической крови с последующим выделением сыворотки осуществляли до начала лечения и после завершения 4-го курса лечения. Сыворотку крови аликвотировали и хранили при –800С до проведения анализа с применением набора Bio-Plex Pro Human Immunotherapy 20-Plex Panel (Био Рад, США), позволяющего определить концентрации GM-CSF, IFN-γ, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-13, IL-15, IL-17A, IL-18, IP-10, MCP-1, MIG, MIP-1α, MIP-1β, RANTES, TNF-α. Оценку результатов анализа осуществляли на Luminex 200 Analyser (BIO-RAD, USA) с программным обеспечением Bio-Plex Manager Software; результаты выражали в пг/мл.
Статистический анализ выполняли с использованием STATISTICA 13,3 (StatSoft Inc., США). Характер распределения показателей оценивали методом Шапиро–Уилка. Так как в нашем исследовании распределение данных не соответствовало нормальному, они представлены в виде медианы (Me) и интерквартильного размаха – 25-го и 75-го процентилей (Ме [LQ; UQ]). Уровень значимости отличий между выборками оценивали непараметрическим критерием Манна–Уитни, а результаты считались статистически значимыми при p<0,05.
Результаты исследования и их обсуждение
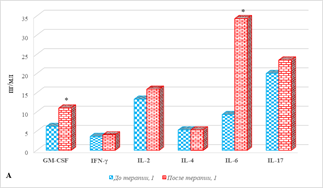
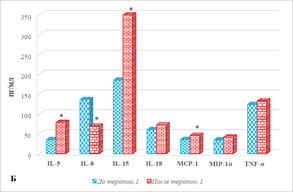
Результаты оценки цитокинового состава больных мКРР без разделения на группы в зависимости от эффекта лечения в его динамике представлены на рисунке 1, из которого видно, что проведение анти-EGFR терапии сопровождается изменением содержания ряда цитокинов. Показано выраженное увеличение в сыворотке крови больных после проведения терапии концентрации IL-6 и IL-5, соответственно на 269% и 122% (рис. 1А, 1Б). Менее выраженное увеличение содержания по сравнению с соответствующими значениями аналогичных показателей до лечения было отмечено для концентраций IL-15 (89%), GM-CSF (77%), MCP-1 (28%), р<0,05 (рис. 1А, 1Б).
|
|
|
|
|
|
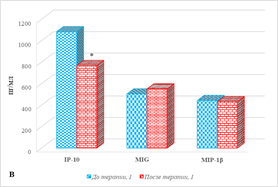
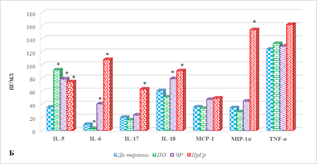
Рис. 1. Цитокиновый состав сыворотки крови больных мКРР до и после анти-EGFR терапии. * – р<0,05. А – диапазон концентрации от 0 до 35, пг/мл; Б – диапазон концентрации от 0 до 350, пг/мл; В – диапазон концентрации от 0 до 1200, пг/мл
При этом выявлено снижение содержания IL-8 и IP-10 (рис. 1Б), соответственно на 49% и 28%, (р<0,05), а концентрации остальных 10 из 20 определяемых цитокинов (IFN-γ, IL-2, IL-4, IL-17, IL-18, MIG, MIP-1α, MIP-1β, RANTES, TNF-α) не менялись. Следует отметить, что в образцах обследованных пациентов как на этапе до, так и после лечения IL-7, IL-10 и IL-13 имели нулевые значения.
Анализ эффективности проведенного лечения (4-го курса химиотерапии в комбинации с анти-EGFR – цетуксимабом или панитумумабом) показал, что полный ответ достигнут у 5 (20%) пациентов, частичная регрессия зарегистрирована у 14 (56%) исследуемых, прогрессирование заболевания выявлено у 6 (24%).
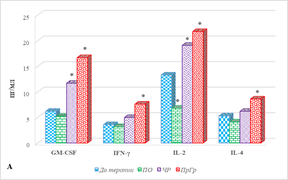
Характеристика цитокинового профиля больных с разным результатом терапии представлена на рисунке 2, из которого видно, что большинство цитокинов демонстрировали различную динамику при разном ответе, кроме IL-5, оказавшегося единственным цитокином, уровень которого повышался после лечения независимо от ответа на него (рис. 2А).
|
|
|
|
|
|
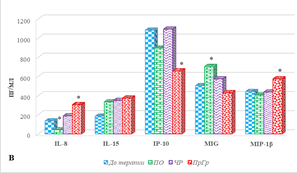
Рис. 2. Цитокиновый состав сыворотки крови больных мКРР при различном ответе на анти-EGFR терапию. * – р<0,05. А – диапазон концентрации от 0 до 25, пг/мл; Б – диапазон концентрации исследуемых цитокинов от 0 до 180, пг/мл; В – диапазон концентрации от 0 до 1200, пг/мл
При полном ответе на терапию наблюдается увеличение концентрации IL-15 с 153,9(151,9;174,9) до 334,9 (253,4;358,6) пг/мл (на 82%), MIG на 40%, р<0,05 (рис. 2В). Кроме того, обнаружено снижение концентрации IL-8 с 136,3 (85,2;157,4) до 42,7 (33,4;66,8) пг/мл (на 69%), IL-6 с 20,0 (16,8;30,8) до 3,1 (2,4;5,8) пг/мл (на 67%) и IL-2 (на 49%), (рис. 2А, 2Б, 2В). Не выявлено значимого изменения содержания 11 цитокинов: GM-CSF, IFN-γ, IL-4, IL-17, IL-18, IP-10, MCP-1, MIP-1α, MIP-1β, TNF-α (рис. 2) и RANTES, а содержание IL-7, IL-10 и IL-13 имело нулевые значения, как до, так и после лечения.
При частичном ответе на проводимое лечение с использованием анти-EGFR препаратов наблюдается либо увеличение концентрации цитокинов (9 из 20 определяемых молекул), либо отсутствие значимого изменения содержания (7 из 20 цитокинов). Наиболее выраженное увеличение по сравнению с исходными значениями обнаружено для IL-6, концентрация которого возросла с 9,0 (7,8;10) до 40,5 (20,2;55,6) пг/мл (на 335%), р˂0,05 (рис. 2Б). Несколько меньшее увеличение показано для IL-15 и GM-CSF (на 89%), р˂0,05 (рис. 2А, 2В). Выявлено увеличение содержания IL-2 по сравнению с исходными значениями в общей группе на 44%, IL-8 и IFN-γ – на 39%, р˂0,05 (рис. 2). Кроме того, на 32% и 31% соответственно увеличивалась концентрация MCP-1 и IL-18, р˂0,05 (рис. 2Б). IL-7, IL-10 и IL-13 не были выявлены, а значимого изменения содержания IL-4, IL-17, IP-10, MIG, MIP-1β, RANTES, TNF-α не обнаружено (рис. 2).
Прогрессия заболевания, несмотря на проведение анти-EGFR терапии, сопровождается увеличением концентрации 14 из 20 определяемых молекул. При этом наибольшее увеличение концентрации показано для IL-6 – в 11,6 раза по сравнению с значениями в общей группе (с 9,3 (5,8;12,1) до 108,2 (90,3;120,4) пг/мл), несколько менее выраженное нарастание выявлено для MIP-1α – на 343%, IL-17 – на 216%, GM-CSF – на 169%, IL-8 – на 124%, IFN-γ – на 111%, IL-5 – на 109%, IL-2 – на 64%, IL-4 – на 62%, IL-18 – на 50%, MCP-1 – на 38%, MIP-1β – на 30% (для всех показателей р˂0,05). При этом показано снижение концентрации только одного цитокина – IP-10, содержание которого было на 39% ниже значений до лечения в общей группе больных (р˂0,05), а значимых изменений содержания MIG (рис. 2В) и RANTES после лечения не выявлено.
На протяжении десятилетий авторы многих исследований идентифицировали и охарактеризовали факторы, способствующие развитию онкогенеза КРР, как опосредованные воспалением кишечника. Помимо вклада диеты и кишечной микробиоты в онкогенез КРР, эти исследования показали, что дисрегуляция цитокиновой сети, в том числе хемокинов, факторов роста, ферментов ремоделирования межклеточного матрикса, лежит в основе воспаления кишечника и способствует развитию КРР [12]. Баланс про- и противовоспалительных цитокинов, стадия опухоли, уровень экспрессии цитокиновых рецепторов и состояние активации стромальных клеток являются определяющими факторами ответа опухоли на лечение, в чем особая роль принадлежит цитокинам, обусловливающим межклеточную коммуникацию и модулирующим функциональную активность различных соматических клеток. Они могут продуцироваться как опухолевыми, так и другими клетками, включая клетки иммунной системы, и поступать в кровь из опухоли и из различных других очагов, например воспалительных. При КРР показано значение многих из них, прежде всего, высоких уровней провоспалительных IL-6, IL-8, IL-17А, которые считаются факторами неблагоприятного прогноза вследствие их проонкогенного и неоангиогенного действия [13]. В литературе отмечено, что IL-6 и TNF-α синергически активируют STAT3 и NF-κB, способствуя росту клеток КРР in vivo [2, 14]. IL-6, секретируемый в строме КРР собственной пластинкой слизистой оболочки, Т-клетками и макрофагами, считается основным провоспалительным цитокином, препятствующим апоптозу, способствующим хроническому воспалению и прогрессированию КРР [2, 15]. Повышенные уровни IL-6 и TNF-α в сыворотке связаны с поздней стадией, метастазированием в печень и короткой общей выживаемостью пациентов с КРР [2].
В нашем исследовании установлены разнонаправленные изменения цитокинового состава сыворотки крови больных мКРР при различном эффекте лечения с применением таргетной анти-EGFR терапии. Ее положительный эффект оказался связан со снижением уровней IL-6, IL-8, IL-17А, а отсутствие эффекта – с возрастанием их концентрации, хотя последнее касается не только этих, но и ряда других цитокинов. Например, повышение уровня интерферона IFN-γ, отмеченное нами при неблагоприятном эффекте лечения, казалось бы, противоречит хорошо известной роли этого цитокина как стимулятора противоопухолевого иммунитета, однако, возможно, такое его действие связано со стимуляцией экспрессии белка PD-L1 (programmed cell death) на опухолевых клетках, защищающей их от цитотоксического действия Т-киллеров, что и характеризует негативный прогноз [16]. При этом полный эффект анти-EGFR терапии сопровождался повышением уровня MIG – монокин-индуцированного гамма-интерферона, что соответствует его функции, описанной в литературе, а именно стимуляции миграции Т-клеток, особенно цитотоксических Т-лимфоцитов (ЦТЛ), в опухоль, усилению поляризации Т-хелперов в сторону Тх1 и их ответа на IFN-γ [17], а также способствует ответу на ингибиторы ИКТ (иммунных контрольных точек) [18]. Таким образом, по-видимому, интерферон-гамма в организме онкологических больных играет двойственную роль, как и многие другие цитокины. Например, IL-18 известен как противоопухолевый, однако есть данные и о том, что его высокий уровень наряду с IL-10 свидетельствует о неблагоприятном прогнозе при КРР [19], а при множественной миеломе показано, что гиперпродукция IL-18 клетками костного мозга вызывает стимуляцию иммуносупрессивных миелоидных клеток MDSC (myeloid-derived suppressor cells) [20] и также служит фактором неблагоприятного прогноза. В отношении других цитокинов (GM-CSF, M-CSF, IL-6, IL-10, IL-1β, PGE2 и TGF-β) предполагается сходный механизм иммуносупрессии [21].
IL-4 известен как стимулятор эпителиально-мезенхимального перехода [22], поэтому его повышение у исследованных нами больных после неэффективного лечения представляется закономерным. Уровень моноцитарного хемотаксического протеина-1 MCP-1 (monocyte chemoattractant protein-1, или CCL2) повышен при КРР и описан в литературе как предиктор метастазирования в печень [2]; по-видимому, полученное нами его повышение у больных мКРР говорит о недостаточной их чувствительности к анти-EGFR препаратам. Воспалительные белки макрофагов MIP-1α и MIP-1β (macrophage inflammatory proteins) являются хемоаттрактантами, обладают провоспалительным действием, привлекая в опухоль нейтрофилы, проонкогенная роль которых хорошо известна [23].
Полный эффект, полученный в группе исследованных нами больных, характеризуется повышением уровня одного из важнейших гомеостатических цитокинов IL-15, и это единственный цитокин, у которого не описано двойственное (потенциально онкогенное) действие на опухолевый рост. В литературе он характеризуется как стимулятор цитотоксической активности CD8+ Т-лимфоцитов; описано его успешное применение для адаптивной клеточной иммунотерапии.
Итак, полученные в нашем исследовании результаты указывают на то, что как мКРР, так и различные варианты его ответа на анти-EGFR терапию характеризуются целым рядом изменений цитокинового состава периферической крови. Прогрессирование заболевания, видимо, связанное с резистентностью к анти-EGFR препаратам, сопровождается значительным увеличением содержания в сыворотке крови больных, главным образом, провоспалительных цитокинов: IL-6, MIP-1α, IL-17, IL-8, IFN-γ, MCP-1, MIP-1β и TNF-α. Полученные результаты не только согласуются с данными литературы, но и позволяют выявить новые особенности цитокинового баланса крови больных мКРР. В соответствии с современными представлениями, при локальном воспалении провоспалительные цитокины, продуцируемые иммунными клетками кишечника [2], стимулируют сложные, до конца не изученные варианты взаимодействия между остальными клетками, в том числе энтероцитами, клетками Панета, бокаловидными клетками, макрофагами, результатом чего является индукция хронического воспаления при воспалительных заболеваниях кишечника, таких как язвенный колит и болезнь Крона, а также при КРР.
Таким образом, дисрегуляция цитокиновой сети способствует изменению гомеостаза тканей кишечника и является важным механизмом воспаления и онкогенеза, что делает цитокины привлекательной мишенью для разработки новых методов лечения.
Заключение
Исследование цитокинового профиля крови пациентов с мКРР является актуальным направлением, что доказывают приведенные данные литературы и результаты нашего исследования, так как иммунные клетки принимают непосредственное участие в воспалительных процессах, способствующих прогрессированию КРР и опосредованно влияющих на результат противоопухолевой терапии. Таким образом, представленные результаты определения концентрации цитокинов у больных мКРР после проведения анти-EGFR терапии указывают на ряд особенностей цитокинового статуса сыворотки крови: так, полный ответ на терапию анти-EGFR сопровождается увеличением концентраций IL-15 и MIG при снижении IL-2, IL-6 и IL-8, тогда как пациенты с частичной регрессией и прогрессированием заболевания имели обратно направленные изменения концентрации цитокинов IL-2, IL-6 и IL-8; уровень IL-5 повышался при лечении независимо от эффекта. Полученные данные могут быть использованы для прогнозирования эффективности проводимого лечения.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов. Соответствие нормам этики. Все пациенты подписывали информированное согласие на участие в исследовании.
Библиографическая ссылка
Кит О.И., Владимирова Л.Ю., Сагакянц А.Б., Златник Е.Ю., Тишина А.В., Дженкова Е.А., Новикова И.А., Шульгина О.Г., Закарян К.М., Ульянова Е.П., Сторожакова А.Э., Удаленкова И.А., Шапошников А.В. ДИНАМИКА ЦИТОКИНОВОГО ПРОФИЛЯ КРОВИ БОЛЬНЫХ С МЕТАСТАТИЧЕСКИМ КОЛОРЕКТАЛЬНЫМ РАКОМ ПРИ ПРОВЕДЕНИИ АНТИ-EGFR ТЕРАПИИ // Современные проблемы науки и образования. 2024. № 4. ;URL: https://science-education.ru/ru/article/view?id=33487 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33487