В последние годы проблема ожирения приобрела глобальный масштаб и тревожит общественность больше, чем голод. В городе Астрахани сохраняется высокая распространенность детей с избыточной массой тела и ожирением. Вызывает тревогу рост детей с ожирением III степени, при котором избыток массы тела превышает 50% от возрастной нормы [1]. Детское ожирение часто связано с вкусовыми пристрастиями в семье. У тучных детей имеется определенное пищевое поведение: тяга к фастфуду, ограничение в рационе растительных продуктов, многократные перекусы, изобилие высококалорийных блюд на основе крахмала, муки, масла, сахара, сладких напитков и подслащенного чая [2]. В качестве подсластителя часто используется фруктоза, поскольку в равных количествах она слаще глюкозы или сахарозы [3]. Учитывая это свойство фруктозы, ее стали широко использовать для подслащивания безалкогольных газированных напитков. Начиная с 1980-х годов в Северной Америке в пищевую промышленность внедрен кукурузный сироп, содержащий фруктозу. Вместе с ростом потребления сладких напитков отмечен рост ожирения. Как известно, фруктоза преимущественно входит в состав семечковых плодов, фруктов, ягод, меда, в меньшей степени она содержится в овощах. Соединение альфа-глюкозы и бета-фруктозы (сахароза) носит бытовое название «столовый сахар». Именно фруктозный компонент в сахарах влияет на уровень мочевой кислоты в крови. Фруктоза почти в полном объеме подвергается экстракции в печени, и только незначительная ее часть поступает в системный кровоток. Поступающая в изобилии с пищей фруктоза, стимулирует избыточный синтез и накопление энергетических субстанций, приводя к чрезмерному образованию ацетил-коэнзима А, усилению образования жирных кислот и триглицеридов, а также к сокращению резервов аденозинтрифосфата (АТФ). Надо отметить, что этот процесс протекает независимо от избыточного потребления калорий, приводя к индукции окислительного стресса и дисфункции митохондрий. Следовательно, наряду с энергоемкостью пищи и напитков липогенезу могут способствовать промежуточные продукты их метаболизма. Образованная вследствие обменных процессов фруктозы в печени мочевая кислота становится самостоятельным катализатором липогенеза [4].
Эффекты, вызываемые мочевой кислотой, многочисленны и многогранны. Так, гиперурикемия усиливает адгезию и агрегацию тромбоцитов, вызывает эндотелиальную дисфункцию стенок сосудов, отрицательно воздействует на эндоплазматический ретикулум, реологические параметры крови [5]. Высокий уровень мочевой кислоты коррелирует с риском смерти, создает условия для формирования и прогрессирования заболеваний кровеносных сосудов и сердца, потенцируя воспалительный ответ, метаболический стресс, инсулинорезистентность. Гиперурикемия в данном исследовании занимала четвертое место среди метаболических проявлений, следуя за гипертонией, гипергликемией и гиперлипидемией, связанными с перееданием и низкой двигательной активностью. Следует отметить, что единых диагностических критериев для определения метаболического синдрома в детском и подростковом возрасте на сегодняшний день не существует. Принято считать, что основными признаками, определяющими МС, являются: нарушение метаболизма глюкозы, артериальная гипертензия, дислипидемия и абдоминальное ожирение.
В исследовании китайских ученых, изучавших показатели мочевой кислоты и креатинина в сыворотки крови у 4699 взрослых пациентов, проходивших диспансеризацию, было установлено, что уровни мочевой кислоты и креатинина были достоверно связаны (p<0,001) с метаболическим синдромом и его компонентами у взрослых китайцев с избыточной массой тела и ожирением [6]. К похожим заключениям пришли и авторы долгосрочного (9-летнего) исследования, в ходе которого было обнаружено, что более высокий уровень мочевой кислоты связан с повышенным риском ожирения [7]. Появились данные, подтверждающие взаимосвязь чрезмерного употребления фруктозы и метаболических нарушений у детей. Установлено, что развитие неалкогольного стеатогепатита достоверно коррелирует с концентрацией мочевой кислоты и потреблением фруктозы [8]. В свою очередь, резкое похудение пациентов в результате проведения хирургических операций приводило к оптимизации показателей мочевой кислоты. Норвежские исследователи обнаружили, что мальчики чаще ведут нездоровый образ жизни, чем девочки, в том числе потребляют больше калорий и менее физически активны, что подвергает их более высокому риску ожирения [9]. В данном исследовании обращающиеся за лечением мальчики-подростки с ожирением имели значительно худший профиль кардиометаболического риска, чем девочки, включая неблагоприятные показатели окружности талии, артериального давления, триглицеридов и холестерина, липопротеидов высокой плотности. Кроме того, большая доля мальчиков придерживалась нездорового образа жизни (большее количество времени, проведенного перед экраном, более высокое потребление подслащенной газировки и меньшее потребление овощей), чем девочки. Однако распространенность метаболического синдрома существенно не различалась между полами, и более высокая доля девочек, чем мальчиков, регулярно пропускала завтрак. Наконец, большинство кардиометаболических факторов риска не были достоверно связаны с образом жизни.
Таким образом, изменение характера, состава и кратности питания наряду с гиподинамичным образом жизни и стрессовыми факторами явились одними из главных причин пандемии ожирения среди населения планеты в XXI веке. Гиперурикемия у больных с ожирением служит фактором риска ишемической и гипертонической болезни сердца, эндотелиальной дисфункции, стеатогепатита, сахарного диабета, резко увеличивая коморбидные состояния в популяции [10, 11, 12].
Цель исследования. Изучить содержание отдельных маркеров метаболического синдрома (мочевой кислоты в крови и моче, липопротеидов высокой и низкой плотности, бета-липопротеидов, триглицеридов в крови), а также микроальбуминурию у детей с избыточной массой тела и ожирением.
Материал и методы исследования. Проведен анализ биохимических результатов: мочевой кислоты (МК) в крови и моче, липопротеидов высокой (ЛПВП) и низкой плотности (ЛПНП), бета-липопротеидов (β-ЛП), триглицеридов в крови (ТГ), а также микроальбуминурии у 186 пациентов (96 девочек и 90 мальчиков) с избыточной массой тела (ИзМТ) и конституционально-экзогенным ожирением (КЭО). Группа с ИзМТ составила 37 детей (медиана SDS ИМТ +1,5 [+1,1; +1,9]), с ожирением I степени – 57 человек (+2,3 [+2,0; +2,5] SDS), II степени – 49 детей (+2,75 [+2,6; +3,0] SDS), III степени – 31 ребенок (+3,4 [+3,1; +3,9] SDS), IV степени – 12 детей (+ 4,0 [+4,0; +4,5] SDS). Медиана возраста всех детей составила 13 лет [min 3,9; max 17]. Достоверность различий распределения сравниваемых показателей устанавливали с помощью общепринятых методов математической статистики (критерий Фишера, критерий хи-квадрат). Различия считались значимыми при вероятности принятия гипотезы р<0,01.
Результаты исследования и их обсуждение. Проведенное исследование обнаружило отклонения в ряде биохимических показателей у детей с ИзМТ и ожирением I–IV степени, что позволяет выделить пациентов с конституционально-экзогенным ожирением в группу риска по метаболическому синдрому (табл. 1).
Таблица 1
Биохимические показатели, ассоциируемые с метаболическим синдромом при избыточной массе тела и ожирении
|
Наименование лабораторного исследования |
Обследуемые дети с избыточной массой тела и ожирением |
Нормальные значения |
Единица измерения |
|
|
Медиана (Ме) |
Среднее значение (Ср) |
|||
|
Мочевая кислота, кровь |
Все дети – 370,5 [123; 564]; Ж-339,0 [123; 540]; М-391,0 [287;564] |
Все дети – 378,4±106,5 Ж-343,0±120,9 М-413,8±78,6 |
<14 лет 120–320; >14 лет 150–350 (ж); >14 лет 210–420 (м) |
мкмоль/л |
|
Мочевая кислота, суточная моча |
5,99 [1,49; 12,28] |
6,18±2,855
|
1,48–4,43 |
мкмоль/л |
|
β-ЛП, кровь |
3,46 [1,69; 7,99] |
3,59±1,37
|
< 4,5 |
г/л |
|
ТГ, кровь |
1,02 [0,32; 2,35] |
1,146±0,566
|
< 10 лет менее 1,3; > 10 лет менее 1,7 |
ммоль/л |
|
ЛПВП, кровь |
Все дети – 1,87 [0,6; 4,01]; Ж-1,915 [0,65; 4,01]; М-1,69 [0,6; 2,75] |
Все дети – 1,855±0,73; Ж-1,88±0,823; М-1,69±0,665
|
>1,03 для девочек
>0,9 для мальчиков |
ммоль/л |
|
ЛПНП, кровь |
2,24 [1,0; 3,9] |
2,344±0,675 |
<3,0 |
ммоль/л |
Анализ биохимических параметров крови и мочи демонстрирует у 83,3% пациентов с ИзМТ и ожирением I–V степени гиперурикозурию и у 73,3% – гиперурикемию. Далее в порядке убывания следовали микроальбуминурия (53,3%), триглицеридемия (28,1%), снижение липидов высокой плотности (21,05%), повышение бета-липопротеидов (17,3%) и липидов низкой плотности (16,2%), (рис. 1).
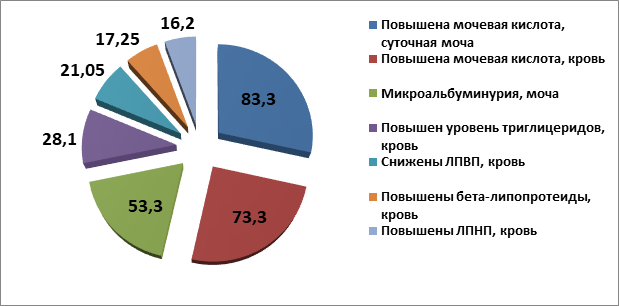
Рис. 1. Распределение отдельных патологически измененных лабораторных показателей у детей с избыточной массой тела и ожирением по частоте их регистрации (%)
Медиана мочевой кислоты в крови всех детей составляла 370,5 [min 123; max 564], а среднее значение соответствовало 378,4±106,5 мкмоль/л. Уровень МК в суточном объеме мочи составил 5,99 [min 1,49; max 12,28], Ср – 6,18±2,855. Эти показатели у детей с ИзМТ и ожирением I–IV степени выше верхней границы референсных значений для здоровых детей в возрасте младше 14 лет (320 мкмоль/л и 4,43 мкмоль/л соответственно) (рис. 2).
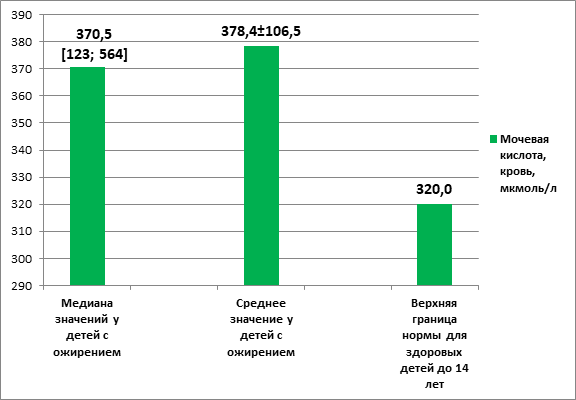
Рис. 2. Показатели мочевой кислоты в крови у детей с избыточной массой тела и ожирением в сравнении с верхней границей нормы
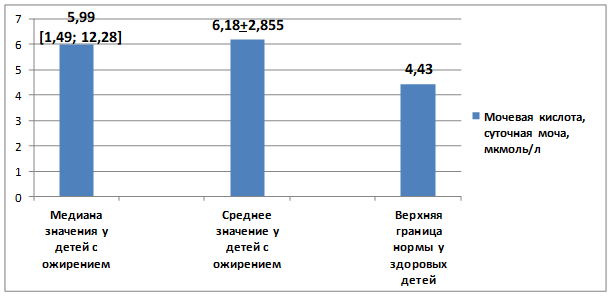
Рис. 3. Показатели мочевой кислоты в моче у детей с избыточной массой тела и ожирением в сравнении с верхней границей нормы
Выявлено, что удельный вес детей с гиперурикемией и гиперурикозурией увеличивался со степенью избытка массы тела: при избыточной массе тела только 8,1% пациентов имеют повышение уровня мочевой кислоты, при ожирении I степени – 17,6% обследуемых, при ожирении II степени – 20,4% детей, при ожирении III степени – 25,8%, при ожирении IV степени – 50,0% пациентов (табл. 2).
Таблица 2
Гиперурикемия и гиперурикозурия у детей с избыточной массой тела и ожирением
|
Степень ожирения |
Всего пациентов |
Число пациентов с гиперурикемией и гиперурикозурией |
% |
|
Избыточная масса тела |
37 |
3 |
8,1 |
|
Ожирение I степени |
57 |
10 |
17,6 |
|
Ожирение II степени |
49 |
10 |
20,4 |
|
Ожирение III степени |
31 |
8 |
25,8 |
|
Ожирение IV степени |
12 |
6 |
50,0 |
Число обследуемых из группы детей с ожирением IV степени, имевших биохимические дисметаболические «события», достоверно преобладало над ИзМТ (F=0,004129, χ2=10,013, p=0,002). Количество детей с ожирением IV степени, у которых обнаружено ≥3 измененных лабораторных метаболических показателя у одного пациента, статистически превалирует над группой ИзМТ (F=0,001430, χ2=13,970, p=0,000186). По результатам исследования крови и мочи только для группы детей с ожирением IV степени характерно наличие у одного ребенка ≥4 метаболических «знаков».
Проведено сравнение трех отдельно взятых групп детей с избыточной массой тела, ожирением I–III степени с самым тяжелым ожирением IV степени по частоте выявления повышенного уровня мочевой кислоты в биологических средах (моча, кровь). Между группами установлены статистические различия. Выявлено, что при ИзМТ и ожирении I степени повышенные показатели мочевой кислоты регистрируются достоверно реже по сравнению с ожирением IV степени (F=0,0038, 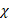 2=10,61, p=0,00113; F=0,025,
2=10,61, p=0,00113; F=0,025, 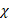 2=5,86, p=0,0156).
2=5,86, p=0,0156).
Таким образом, при морбидном ожирении (IV степени) достоверно чаще регистрируется 3 и более биохимических метаболических «знака» у одного пациента. Биохимические дисметаболические признаки статистически чаще выявляются при ожирении IV степени по сравнению с избыточной массой тела.
В группе детей с КЭО определялись также нарушение реполяризации миокарда желудочков на фоне артериальной гипертензии (38,5%), повышение триглицеридов (28,1%), артериальная гипертензия (23,6%), снижение ХС-ЛПВП (21,05%), повышение бета-липопротеидов (17,25%) и ХС-ЛПНП (16,2%) в сыворотке крови, «плоская» сахарная кривая (14,0%), гипертоническая болезнь (7,7%), нарушение толерантности к глюкозе (НТГ) (7,0%), дисметаболическая нефропатия (3,3%), а также черный акантоз (2,15%).
Лабораторные сдвиги усиливались в возрасте 13 лет (табл. 3).
Таблица 3
Распределение детей с ожирением и лабораторными метаболическими знаками по возрасту
|
Возраст детей с ожирением и метаболическими знаками |
%% |
|
9 лет |
22,30% |
|
10 лет |
26,10% |
|
11 лет |
– |
|
12 лет |
25,00% |
|
13 лет |
44,50% |
|
14 лет |
15,00% |
|
15 лет |
– |
|
16 лет |
26,70% |
|
17 лет |
23,10% |
По всей видимости, это связано с тем, что к 14 годам заканчивается формирование всей хронической патологии и возраст детства в официальных документах медицинской статистики характеризуется 0–14 годами жизни. По этой же причине рутинные скрининговые обследования детям проводятся в возрасте 13–14 лет. При сравнении разных возрастных групп детей с метаболическими изменениями на фоне ожирения достоверных различий в присутствии метаболических «знаков» в зависимости от возраста не выявлено (p>0,05) (рис. 4).
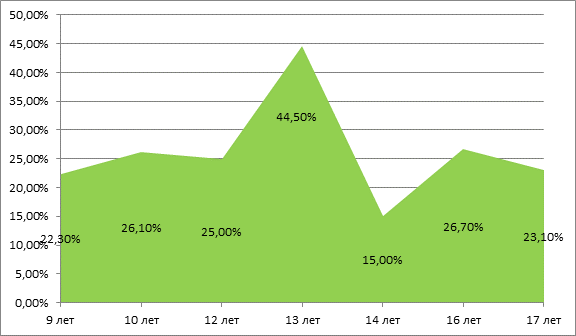
Рис.4. Распределение детей с метаболическими знаками на фоне ожирения по возрасту (%)
Проведенный в ходе исследования корреляционно-регрессионный анализ между возрастом и частотой регистрации метаболических «знаков» также не выявил достоверных различий (r = –0,03143, p>0,05). Скорее всего, это связано с тем, что на частоту возникновения метаболического синдрома влияет не столько возраст, сколько степень ожирения и наследственные факторы.
Таким образом, профилактика ожирения и метаболического синдрома должна начинаться уже в детском возрасте. Проведенные исследования подтвердили, что патологический процесс метаболического синдрома начинается в детском и подростковом возрасте [13, 14]. Детское и подростковое ожирение, как правило, переходит во взрослое состояние. Следовательно, ранняя диагностика и профилактика метаболического синдрома в детском и подростковом возрасте имеют решающее значение для предотвращения метаболических сдвигов и связанных с ними хронических заболеваний во взрослом возрасте. Учитывая уникальные, специфичные для пола характеристики физического роста и изменений в развитии детей и подростков, очень важно учитывать гендерные и возрастные различия, чтобы понять влияние этих изменений на распространенность метаболических сдвигов при ожирении и обеспечить индивидуальное ведение детей и подростков.
Заключение. У детей с избыточной массой тела и ожирением наблюдаются существенные отклонения в лабораторных показателях, составляющих основу метаболического синдрома (повышение мочевой кислоты в крови и моче, триглицеридов, липопротеидов низкой плотности), микроальбуминурия. Максимальные лабораторные сдвиги отмечаются в группе детей с морбидным ожирением. Наиболее часто у обследуемых регистрируется повышение мочевой кислоты в крови и моче, что позволяет отдельно выделить данный маркер в списке метаболических знаков у детей с конституционально-экзогенным ожирением. Раннее выявление и лечение конституционально-экзогенного ожирения у детей и подростков, основанное на наиболее значимых и предсказуемых сопутствующих факторах, может оказывать долгосрочное влияние на показатели здоровья во взрослом возрасте.
Библиографическая ссылка
Безрукова Д.А., Отто Н.Ю., Джумагазиев А.А., Филипчук А.В., Безрукова Д.Д. МЕТАБОЛИЧЕСКИЕ ЗНАКИ У ДЕТЕЙ С КОНСТИТУЦИОНАЛЬНО-ЭКЗОГЕННЫМ ОЖИРЕНИЕМ // Современные проблемы науки и образования. 2024. № 3. ;URL: https://science-education.ru/ru/article/view?id=33471 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33471



