Диеты с ограничением калорийности питания вызывают перепрограммирование метаболических процессов в опухолевых клетках и в клетках опухолевого микроокружения, оказывая влияние на патогенез и прогрессию опухоли [1, 2]. Одной из стратегических целей противоопухолевой терапии является преодоление метаболической пластичности [3]. Диета и питание являются одними из наиболее значимых модифицируемых внешних факторов, регулирующих метаболизм опухолевых клеток [4]. Меланома – злокачественное новообразование, заболеваемость которым быстро увеличивается в большинстве регионов мира, наблюдается устойчивый рост показателей заболеваемости и смертности населения от этой опухоли [5]. В ряде исследований показано положительное влияние ограничения калорийности при злокачественных новообразованиях и, в частности, при меланоме [6]. Возможное управление калорийностью пищи может иметь практическое значение в контексте канцерогенеза. Однако механизмы опухольсупрессивного эффекта ограничения калорийности поняты далеко не полностью.
Таким образом, целью данного исследования является выявление влияния 30%-ного снижения калорийности питания мышей с экспериментальной меланомой В16 на поведенческие аспекты при использовании теста «Открытое поле».
Материал и методы исследования
Для исследования влияния ограничения калорийности питания на рост и развитие опухоли были использованы половозрелые мыши-самки линии С57Bl/6 в возрасте 7–8 недель со средней массой тела 16,5 г. Животные были предоставлены НИЦ «Курчатовский институт» «ПЛЖ «Рапполово». Температура воздуха в помещении поддерживалась на уровне 20–22ºС. Исследование было одобрено этическим комитетом ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России (протокол 119 от 07.06.2023 г.).
Лабораторные животные подвергнуты рандомизации, сформированы четыре группы:
1-я группа – интактные мыши, базовая диета (питание вволю – ad libitum) (n=10);
2-я группа – мыши на ограничении калорийности (ОК) питания (на 30% от физиологических потребностей) (n=10);
3-я группа – мыши на базовой диете (питание вволю), перевивка опухоли (n=10);
4-я группа – мыши на ОК питания (30%), трансплантация клеток меланомы В16 (n=10).
Животные групп № 1 и № 3 содержались в индивидуальных клетках при естественном освещении с неограниченным доступом к воде и корму. Животные групп № 2 и № 4 содержались в индивидуальных клетках при естественном освещении с неограниченным доступом к воде, но питание этих животных осуществлялось в режиме ограничения калорийности из расчета 70% от диеты, удовлетворяющей физиологические потребности животных, исходя из веса животных, в течение 3 месяцев. Для питания животных всех групп использовался полнорационный сухой гранулированный корм для содержания лабораторных мышей «ЧАРА» (ООО «Фаворит, Россия). Экспериментальным группам животных № 3 и № 4 через 3 месяца была произведена трансплантация клеток меланомы. Для воспроизведения модели меланомы линии B16 мы вводили подкожно в боковую поверхность живота 1x106 суспензии клеток до формирования солидной опухоли в размере 20 мм. Культура клеток меланомы была любезно предоставленаФГБНУ «НИИ фундаментальной и клинической иммунологии». Формирование опухолевого узла происходило в течение 15 суток после имплантации клеток меланомы.
Для оценки двигательной и исследовательской активности животных использовался тест «Открытое поле» [7]. Установка представляет собой открытую арену диаметром 63 см с высотой бортиков по периметру 30 см (производство НПК «Открытая Наука», РФ). Поверхность арены разделена на центральную (диаметр 32 см) и периферическую зоны. Животные проходили тестирование дважды. Каждая сессия длилась 8 минут. Для фиксирования пройденной дистанции, скорости передвижения, времени замираний использовалась видеозапись с последующей обработкой информации с помощью программного обеспечения ANY-MAZE.
Экспериментальные данные обрабатывали с помощью пакета прикладных программ Microsoft Office Excel 2019. Определяли средние значения, доверительный интервал и ошибку среднего. Достоверность различий между выборками оценивали с помощью критерия Манна–Уитни. Значимыми считали различие при p<0,05.
Результаты исследования и их обсуждение
Первая сессия экспериментов была проведена с группами контрольных мышей № 1 и № 2, которые находились на базовой диете и на диете с ограничением калорийности питания соответственно. Вторая сессия была проведена для групп мышей с перевитой экспериментальной меланомой В16 № 3 и № 4, которые соответственно находились на базовой диете и на диете ОК питания.
Анализ результатов выявил, что пройденная дистанция была статистически значимо выше в группе мышей, находящихся на ОК питания, для животных контрольной группы (для группы № 1 – 47,7±1,3; для группы № 2 – 53,0±1,6; р=0,039 критерий Манна–Уитни) (рис. 1). Кроме того, статистически значимо пройденная дистанция была выше и в группе опытных мышей, находящихся на диете с ограничением калорийности питания (49,8±1,6) по сравнению с группой животных, находящихся на базовой диете (40,2±2,0) (р=0,042 критерий Манна–Уитни) (рис. 2).
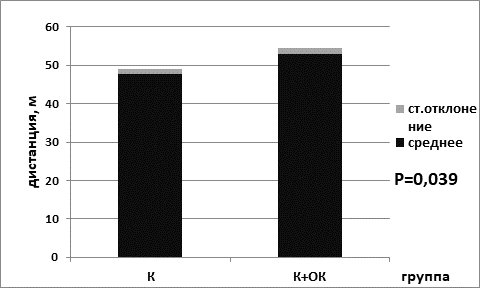
Рис. 1. Пройденная дистанция в группе контрольных мышей на базовой диете (К) и в группе контрольных мышей на диете с ограничением калорийности питания (К+ОК)
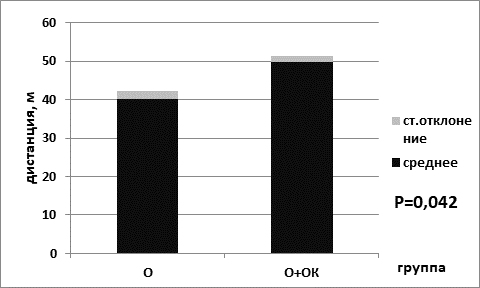
Рис. 2. Пройденная дистанция в группе опытных мышей на базовой диете (О) и в группе опытных мышей на диете с ограничением калорийности питания (О+ОК)
Средняя скорость в группе мышей без перевивки опухолевых клеток, находящихся на базовой диете (0,099±0,003), была статистически значимо ниже показателя средней скорости для группы на ограничении калорийности питания (0,109±0,003) (р=0,035 критерий Манна–Уитни) (рис. 3). В сессии для групп мышей с перевитыми клетками опухоли для показателя средней скорости наблюдались аналогичные статистически значимые изменения. В группе животных с ограничением питания средняя скорость была выше (0,099±0,003), чем в группе, находящейся на базовой диете (0,081±0,002) (р=0,002 критерий Манна–Уитни) (рис. 4).
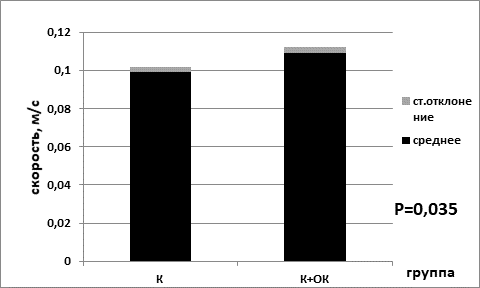
Рис. 3. Средняя скорость в группе контрольных мышей на базовой диете (К) и в группе контрольных мышей на диете с ограничением калорийности питания (К+ОК)
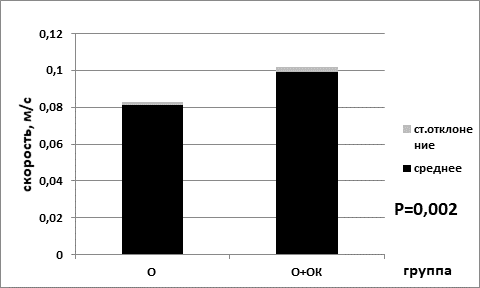
Рис. 4. Средняя скорость в группе опытных мышей на базовой диете (О) и в группе опытных мышей на диете с ограничением калорийности питания (О+ОК).
По показателю «время замирания» не выявлено статистически значимой разницы ни в сессии для мышей контрольных групп (52,5±4,1 для группы мышей на базовой диете; 44,5±3,1 для группы на ОК питания), ни в сессии для групп животных с экспериментальной меланомой В16 (50,2±6,1 для группы мышей на базовой диете; 44,4±2,1 для группы животных, находившихся на диете с ограничением калорийности).
Таким образом, полученные результаты указывают на то, что в группах мышей с рестрикцией питания общая локомоторная активность по показателям пройденной дистанции и средней скорости движения по всей территории арены была выше, чем у животных на базовой диете. Причем эта закономерность регистрируется как для сессии контрольных групп мышей, так и для сессии групп мышей с экспериментальной меланомой В16. Следует отметить, что выявлена статистически значимая разница для показателей пройденной дистанции при сравнении групп контрольных мышей на базовой диете и мышей с экспериментальной меланомой, также находящихся на базовой диете (р=0,003 критерий Манна–Уитни). Также выявлена статистически значимая разница между группой контроля на диете с рестрикцией питания и группой с меланомой, также находящейся на диете с ограничением калорийности (р=0,034 критерий Манна–Уитни). Следовательно, развитие опухолевого процесса оказывает влияние на двигательную активность мышей. Однако для групп животных, находящихся на базовой диете (питание вволю), изменения при влиянии опухолевого процесса значительно выше и составляют 16%, тогда как при диете с ограничением калорийности питания уменьшение показателя пройденной дистанции, хоть и является статистически значимым, тем не менее, разброс между контрольной группой мышей и животных с опухолевым процессом составляет только 6%. Вполне возможно, что данные изменения не являются случайными и указывают на менее выраженные нарушения в организме мышей с опухолевым процессом, находящихся на диете с рестрикцией питания.
Сообщается, что ограничение калорий улучшает физическую активность за счет индукции митохондриального биогенеза и модулирует антиоксидантные и воспалительные реакции на острую физическую нагрузку [8]. Согласно результатам многих исследований, ограничение калорий приводит к снижению расхода энергии, определяя метаболическую адаптацию [9]. Такое перепрограммирование метаболических процессов вызывает уменьшение окислительного повреждения и задерживает возрастные изменения физиологических функций. Метаболическая адаптация, вызванная ограничением калорийности, связана с потерей массы тела, снижением секреции инсулина, снижением уровня гормонов щитовидной железы и лептина, а также повышением эффективности использования энергии митохондрий [10].
При режиме питания с ограничением калорийности происходит переход на метаболические модели, связанные с уменьшением воспаления без нарушения функции иммунной системы, что может способствовать защите от различных заболеваний, в том числе опухолевых [11]. В предыдущих исследованиях авторов выявлены положительные изменения параметров опухоли и пролиферативной активности при экспериментальной меланоме В16 у мышей при рестрикции питания. Кроме того, зафиксированы позитивные изменения антиоксидантной активности для данной экспериментальной модели, которые могут способствовать замедлению прогрессии опухоли [12]. Высокие показатели локомоторной активности групп мышей, находящихся на диете с ограничением калорийности, указывают на метаболическое перепрограммирование в пользу повышения стрессоустойчивости и повышения уровня поисковой активности животных, что, в том числе, связано с активацией биогенеза митохондрий. При ограничении калорийности питания организм переходит в режим поддержания жизнеспособности, что реализуется за счет замедления процессов роста и репродукции [13]. Активация программ стрессоустойчивости приводит к выраженным изменениям внутриклеточных процессов: активации репаративных процессов, повышению стабильности ДНК, изменению скорости метаболизма и продолжительности жизни клеток [4]. Снижение калорийности питания модулирует NAD+ метаболизм в печени, что способствует усилению глюконеогенеза и повышению энергетических резервов организма [14]. Активация двигательной функции мышей в режиме рестрикции питания является одной из составляющих программ стрессоустойчивости, и, хотя это сопряжено с дополнительными энергетическими тратами организма, в целом данное переключение поведенческих программ требует меньших энергетических ресурсов, нежели программы роста и репродукции. Для иллюстрации изменений двигательной активности мышей на рисунке 5 приведены треки пройденной дистанции для мыши, находящейся на базовой диете, и мыши на диете с ограничением калорийности питания.
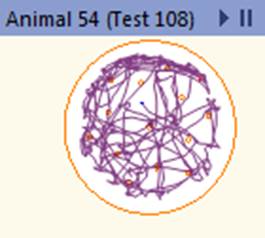
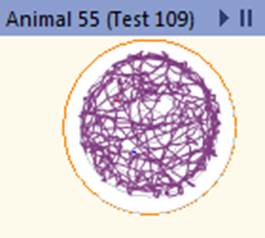
Рис. 5. Трек пройденной дистанции для мыши из группы на базовой диете и мыши из группы на диете с ограничением калорийности питания
Заключение
Можно сделать предположение, что изменения локомоторной активности мышей при ограничении калорийности питания на 30% в данной экспериментальной модели укладываются в концепцию о повышении работоспособности и энергоэффективности за счет перепрограммирования метаболических процессов в пользу программ стрессоустойчивости. Включение данных программ выражается, в том числе, в активации двигательной и поисковой активности мышей. И, хотя энергетическая стоимость локомоторной активности, безусловно, выше в группах мышей с ограничением калорийности питания по сравнению с группами мышей на базовой диете (по показателям пройденной дистанции и средней скорости движения), включение режима поддержания жизнеспособности приводит к угнетению более энергоемких программ клеточного роста и деления. Данные изменения происходят как в группах мышей без опухолевого процесса, так и в группах мышей с экспериментальной меланомой В16, что указывает на существенные резервы энергетических ресурсов при режиме рестрикции питания даже для мышей с экспериментальной меланомой В16 за счет принципиальной перестройки метаболических процессов.
Библиографическая ссылка
Фефелова Ю.А., Сергеева Е.Ю., Шерстнев А.П., Мутьев Н.С., Полякова Т.С. ПОВЕДЕНЧЕСКИЕ ФУНКЦИИ МЫШЕЙ С ЭКСПЕРИМЕНТАЛЬНОЙ МЕЛАНОМОЙ В16 ПРИ РЕЖИМЕ РЕСТРИКЦИИ ПИТАНИЯ // Современные проблемы науки и образования. 2024. № 3. ;URL: https://science-education.ru/ru/article/view?id=33470 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33470



