Биологическая безопасность определяется наличием правил проведения диагностических, производственных или экспериментальных работ с патогенными биологическими агентами, а также при производстве вакцин против инфекционных заболеваний [1]. Изучение взаимодействий человеческого организма и возбудителей инфекционных болезней на клеточном и молекулярном уровнях выходит в ряд первоочередных задач человечества. Именно в этой области развития мировой науки эксперты-футурологи ожидают существенного прорыва уже в первой половине XXI века. Базируясь на получаемых иммунологами и микробиологами сведениях молекулярно-биологического уровня, медицина находит все больше возможностей для решения ранее, казалось бы, неразрешимых проблем практического характера [2]. Известно, что иммунная система отвечает не на всю клетку возбудителя, а на отдельные антигены. В этой связи необходимо найти наиболее важные для создания иммунитета компоненты бактерий [3; 4].
Защита микроорганизма от бактериальной атаки складывается из последовательного включения в борьбу с возбудителем факторов естественной резистентности и специфического иммунного ответа [5]. Возбудитель (бактериальная клетка) распознается в первую очередь факторами врожденного и затем только адаптивного (антигенспецифического) иммунитета [6; 7]. Тем не менее бактерии нередко выживают в условиях функциональной активности макроорганизма, ускользают от реакций как врожденного, так и адаптивного иммунитета, персистируют в макроорганизме, что приводит к развитию хронического воспалительного процесса [8-10]. Понимание механизмов, с помощью которых патогенные бактерии выживают в тканях и органах хозяина, поможет глубже понять сложные взаимодействия между патогенными бактериями и иммунной системой. Более того, позволит понять сложную тактику уклонения патогена от реакции иммунной системы, разработать новые стратегии борьбы с ними, новые вакцины, которые будут направлены на защиту от новых бактериальных заболеваний, имеющих важное значение для общественного здравоохранения [7; 11].
Следует отметить, что все находки, полученные при изучении механизмов взаимодействия в системе «бактерия - иммунная система макроорганизма», сделаны в системе in vivo [2; 7; 8; 12]. Перекрестная реакция макроорганизма на убитые культуры стафилококка и стрептококка остается вообще малоизученной. Для более полного понимания механизмов функционирования иммунной системы и ее взаимодействия с бактериями построены математические модели, но прогностическая ценность таких моделей пока незначительна [13].
Целью настоящей работы являлось исследование характера влияния автоклавированной культуры стафилококка (Staphylococcus aureusи) или стрептококка (Streptococcus piogenes) и их лизатов на функциональную активность иммунокомпетентных клеток крови мышей in vivo и in vitro.
Материалы и методы исследования. Работа выполнена на 30 мышах линии BALB/c. Мыши-самцы массой не менее 20 г получены из питомника Центра технологий Академии наук Туркменистана. Было выделено 3 группы животных по 10 в каждой. Мышам первой группы внутрибрюшинно вводили 0,5 мл стерильного 0,9% раствора хлорида натрия (NaCl), мышам второй – по 0,5 мл автоклавированной культуры Staphylococus aureus (АК СТФ), мышам третьей – 0,5 мл автоклавированной культуры Streptococcus piоgenеs (АК СТР). Культуры бактерий получены из музея штаммов кафедры микробиологии Государственного медицинского университета Туркменистана им. М.Гаррыева. Перед введением животным суточную культуру бактерий, содержащую в 1 мл рабочей взвеси 5х109 микробных тел (по стандарту мутности), автоклавировали в течение 45 минут при 1,5 атм.
О характере реакции организма животных на введение автоклавированной культуры бактерий in vivo и in vitro судили по результатам реакции торможения миграции лейкоцитов (РТМЛ) в модификации [14]. Результаты выражали в виде индекса миграции лейкоцитов (ИМЛ). В качестве индуктора миграции использовали лизат той же культуры бактерий, которую вводили животным – ЛЗстр и ЛЗстф соответственно. Лизат получали пятикратным замораживанием-оттаиванием культуры с последующим центрифугированием в течение 30 минут при 3000 об./мин. Надосадочную жидкость пропускали через фильтровальную бумагу. Полученный фильтрат автоклавировали в течение 45 минут при 1,5 атм. Лизат хранили при -19°С не более 1 месяца. Одновременно у животных всех групп определяли величину гранулоцитарного индекса (ГИ) – отношение суммы циркулирующих полинуклеаров к сумме мононуклеаров [15]. Животных обследовали до внутрибрюшинного введения культуры и на 3, 7, 14 и 21-е сутки после введения АКстф и АКстр. Полученные данные математически обработаны при помощи программы SPSS (USA).
Результаты исследования и их обсуждение. Исследование показало, что введение ЛЗстф и ЛЗстр в среду культивирования капилляров с кровью интактных мышей стимулирует миграцию лейкоцитов (табл. 1). Как видно из таблицы, ИМЛ интактных мышей в присутствии ЛЗстр и ЛЗстф практически не различается (p>0,05). Величина ГИ у животных до введения АК бактерий соответствует норме у данной линии животных. После внутрибрюшинного введения мышам АКстф величины ИМЛ и ГИ существенно изменяются. Уже на 3-и сутки ИМЛ в присутствии in vitro лизата одноименной культуры (ЛЗстф) снижается в 1,9 раза (p<0,01) по отношению к исходному уровню.
Таблица 1
ИМЛ и ГИ мышей, получивших АК стф, в зависимости от индуктора реакции
|
Время обследования |
ИМЛ в зависимости от группы и индуктора миграции |
ГИ В/б АКстаф
|
||
|
Контрольная (+ЛЗ стф in vitro) |
В/б АКстаф (+ЛЗ стф in vitro) |
В/б АКстаф (+ЛЗ стр in vitro) |
||
|
До в/б введения АКстф |
130,6±10,7 |
125,5±7,9 |
127,9 ±10 |
1,3±0,08 |
|
3 сут. |
125,7±10,0 |
65,3±4,9** |
77,6±3,7* |
0,47±0,01** |
|
7 сут. |
110,5±3,8 |
67,1±3,8** |
82,5±5,1* |
1,08±0,02* |
|
14 сут. |
115,9±4,2 |
72,7±6,7* |
54±3,8** |
0,56±0,01** |
|
21 сут. |
133±7,2 |
57,3±3,3** |
62,6±4,1** |
0,35±0,02** |
Примечание. Здесь и далее: P – статистически значимые изменения между данными до введения лизата и в динамике исследования: * – P <0,05; ** – P <0,01.
В присутствии ЛЗстр in vitro ИМЛ снизился в меньшей степени – в 1,74 раза, различие по отношению к исходному уровню (p<0,01). У мышей, получивших АКстф, величина ИМЛ в присутствии как ЛЗстф, так и ЛЗстр продолжала снижаться на протяжении всего периода наблюдения (21 сутки) (рис. 1А).
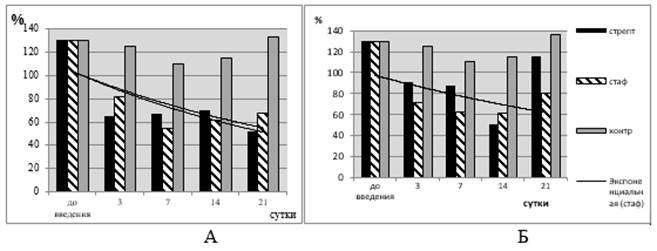
Рис. 1. Величина ИМЛ в динамике ответа на введение АКстф (А) и АКстр (Б)
К 21 суткам значение ИМЛ в присутствии ЛЗстф и ЛЗстр составляет 46,5% и 48,8% от исходного уровня соответственно. Линия тренда на графике показывает, что независимо от вида индуктора выражена тенденция к снижению значения ИМЛ в течение 21 суток (рис. 1Б).
При внутрибрюшинном введении мышам АКстр наблюдаются те же изменения величины ИМЛ, что и в предыдущей серии экспериментов (табл. 2, рис. 1 А, Б).
Таблица 2
ИМЛ мышей, получивших АК стр, в зависимости от индуктора реакции
|
Время обследования |
ИМЛ в зависимости от группы и индуктора миграции |
ГИ В/б АКстр |
||
|
Контрольная (+ЛЗ стр in vitro) |
В/б АКстр (+ЛЗ стр in vitro) |
В/б АКстр (+ЛЗ стф in vitro) |
||
|
|
||||
|
До введения |
120,6±8,9 |
111,7± 8,2 |
115,3±7,6
|
1,3±0,07 |
|
3 сут. |
129,7±8,0 |
71,0±4,7* |
91,3±6,2 |
1,8±0,02** |
|
7 сут. |
111,5±7,5 |
63,5±5,1* |
88,6±5,8 |
1,1±0,04* |
|
14 сут. |
115,9±6,2 |
61,0±4,1** |
51,2±4,7 |
0,73±0,07** |
|
21 сут. |
135±9,2 |
80,7±6,6* |
116,0±7,3 |
0,4±0,09** |
Величина ИМЛ прогрессивно снижается и особенно значительно на 7-14-е сутки после инъекции. На 21-е сутки она несколько увеличивается, но остается ниже исходной (p<0,05). Любопытно, что ЛЗстф in vitro тоже тормозит миграцию лейкоцитов мышей, получивших АКстр, но в меньшей степени (рис. 1). На 21-е сутки в присутствии ЛЗстф значение ИМЛ соответствует исходному уровню (табл. 2). Таким образом, лейкоциты мышей, получивших in vivo АКстф, in vitro реагируют на присутствие как ЛЗстф, так и на ЛЗстр, но в большей степени реагируют на ЛЗ «знакомых» бактерий. Значит ли это, что АКстф и АКстр имеют общие термостабильные антигены, покажут дальнейшие исследования. Динамика значений ГИ в этой группе отличается от таковой у животных, получивших инъекции АКстф.
Гранулоциты – одна из самых активных субпопуляций лейкоцитов, контролирующих гомеостаз организма [10; 11]. Гранулоцитарный индекс – отношение суммы циркулирующих полинуклеаров к сумме мононуклеаров - четко характеризует реакцию организма на вторжение патогена. Настоящее исследование включало определение величины ГИ в динамике ответа животных на введение автоклавированной культуры бактерий (табл. 1 и 2). Были выявлены довольно существенные различия в зависимости от вида возбудителя (рис. 2).
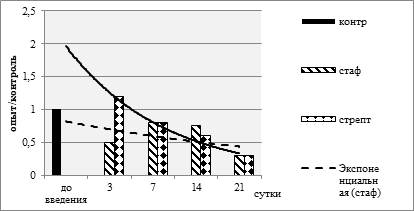
Рис. 2. Степень изменения по отношению к контролю величины гранулоцитарного индекса в зависимости от группы животных. За 1 принят уровень контроля
На диаграмме хорошо видно, что в группе мышей, получивших АКстф, на 3-и сутки величина ГИ резко снижается (р<0,01 против исходного уровня). В дальнейшем – на 7-е и 14-е сутки она достоверно увеличивается (р<0,01) и снова довольно резко снижается к 21-м суткам (р<0,01). В группе мышей, получивших АКстр, величина ГИ на 3-и сутки достоверно увеличивается (р<0,01), затем прогрессивно снижается и на 21-е сутки становится в 3,25 раза ниже исходной, но соответствует таковой в группе животных, получивших АКстф (p>0,05). Линии тренда на диаграмме иллюстрируют различия, но в целом свидетельствуют о тенденции к снижению величины ГИ в обеих группах.
По всей видимости, автоклавированные бактерии сохраняют ряд термостабильных поверхностных антигенов. Во всяком случае, высокое значение ИМЛ в группе интактных мышей в присутствии ЛЗстф и ЛЗстр in vitro свидетельствует о циркуляции в их периферической крови лейкоцитов, специфически сенсибилизированных к антигенам бактерий. По всей видимости, снижение величины ИМЛ после внутрибрюшинного введения животным АКстф и АКстр связано со снижением активности системы распознавания антигена и началом процесса формирования иммунного ответа в организме животных. Создается впечатление, что величина ИМЛ в присутствии ЛЗ бактерий in vitro соответствует двум основным фазам иммунного ответа in vivo: фазе распознавания (высокий ИМЛ) и фазе адаптивного иммунитета в виде формирования специфических антител или сенсибилизированных лейкоцитов (низкий ИМЛ). Таким образом, в результате введения животным автоклавированной культуры бактерий формируется специфический иммунный ответ, то есть имеет место процесс иммунизации организма к определенным термостабильным антигенам стафилококков и стрептококков.
Прошло уже более 100 лет с момента проведения первой вакцинации для индукции полноценного иммунного ответа и защиты макроорганизма от инфекции. Было доказано, что иммунитет основан на реакции организма на бактериальный антиген. Далее была доказана роль иммунной системы в реакции на антиген и создании иммунитета к инфекционному агенту. Но главное значение имеет антиген, на который иммунная система реагирует формированием либо антител, либо цитотоксических лимфоцитов.
Для более полного понимания механизмов функционирования иммунной системы и ее взаимодействия с бактериями построены математические модели. Прогностическая ценность таких моделей пока незначительна. Следовательно, остается актуальным поиск адекватных моделей функционирования системы «иммунная система-бактерия».
Несмотря на общее происхождение антимикробной и иммунологической науки, создание в микробиологии определенных парадигм наложило ограничения на иммунологический аспект понимания механизмов взаимодействия бактерии и макроорганизма. Это привело к тому, что эти механизмы исследуются и понимаются только in vivo.
Заключение. Настоящее исследование в известной степени позволило объединить изучение взаимодействия бактерий и макроорганизма in vivo и in vitro. Определение величины ИМЛ и ГИ у иммунизированных животных является перспективным в плане разработки объективного и доступного критерия оценки in vitro фоновой антибактериальной активности иммунной системы и определения динамики формирования специфического иммунного ответа животных и человека на бактериальный антиген in vivo.
Библиографическая ссылка
Плескановская С.А., Семина И.Ф., Довлетов Д.Х., Аннабердыева М.К. ВЗАИМОДЕЙСТВИЕ АВТОКЛАВИРОВАННОЙ КУЛЬТУРЫ ГРАМПОЛОЖИТЕЛЬНЫХ БАКТЕРИЙ С КЛЕТКАМИ ИММУННОЙ СИСТЕМЫ IN VIVO И IN VITRO // Современные проблемы науки и образования. 2024. № 3. ;URL: https://science-education.ru/ru/article/view?id=33434 (дата обращения: 25.02.2026).
DOI: https://doi.org/10.17513/spno.33434



