С глобальной точки зрения в мире продолжается пандемия ВИЧ-инфекции, и с присоединением пандемии COVID-19 (КВИ) возникают трудности своевременной и дифференциальной диагностики поражений органов дыхания такими патогенами, как микобактерии туберкулеза, атипичные микобактерии, Pneumocystis jiroveci и др., у больных ВИЧ-инфекцией [1].
Пневмоцистная пневмония (ПП) является одним из распространенных оппортунистических заболеваний при ВИЧ-инфекции. В мире регистрируют около 400 000 новых случаев в год [1; 2]. Несмотря на наличие эффективной антиретровирусной терапии (АРВТ) и химиопрофилактики оппортунистических инфекций, летальность при ПП по-прежнему остается высокой, составляя 10–20% [1-3]. Pneumocystis jirovecii поражает интерстициальную ткань легких, как и коронавирус SARS-CoV-2. Схожесть клинических проявлений и радиологического симптома «матового стекла» характерна для обоих заболеваний, что усложняет процесс постановки своевременного диагноза [1].
Для экссудативной фазы диффузного альвеолярного повреждения при КВИ пневмонии описаны следующие гистологические признаки: внутриальвеолярный отек, гиалиновые мембраны по контуру альвеол, реже респираторных бронхиол, пролиферация альвеолоцитов 2 типа, десквамация альвеолярного эпителия в просвет альвеол в виде пластов, наличие уродливых и многоядерных клеток, наличие в просветах альвеол макрофагов, лимфоцитов, единичных нейтрофилов, микротромбов в капиллярах межальвеолярных перегородок, мелких ветвях легочных артерий и вен [4-6]. Вирус SARS-CoV-2 играет важную роль в инициировании острого повреждения не только легочной ткани, но и других органов. Частым проявлением повреждения пораженных органов у пациентов с COVID-19 является инвагинальный ангиогенез (ИА). При ИА существующий сосуд изменяется за счет инвагинации эндотелия и образования внутри просветной перегородки, что в конечном итоге приводит к образованию двух новых просветов. Изменение гемодинамики внутри сосуда приводит к потере ламинарного потока и его замене турбулентным, неоднородным кровотоком. ИА, возникающий из-за ишемии вследствие тромбоза, сам по себе является фактором риска образования дальнейших микротромбов; они были обнаружены в легких, сердце, печени, почках, мозге и плаценте пациентов с COVID-19 [7]. Это само по себе может являться причиной развития полиорганной недостаточности [6; 7].
Процесс постановки диагноза и дифференциации КВИ от оппортунистических и СПИД-индикаторных заболеваний усложняется неспецифическими клиническими проявлениями в виде сухого кашля, фебрильной или субфебрильной лихорадки, слабости и нарастающей дыхательной недостаточности [1; 8]. Решение, какой патоген играет ведущую роль в прогрессии заболевания и развитии осложнений, представляет собой сложную клиническую задачу у пациентов с иммунодефицитом [1; 9]. В исследовании, проведенном и описанном ранее [8], где пациенты были проанализированы, в том числе и по показателям (CD4+ Т-лимфоциты, вирусная нагрузка ВИЧ, ПЦР РНК SARS-CoV-2), была выявлена заметной тесноты обратная взаимосвязь между уровнем СД4+ Т-лимфоцитов и длительностью вирусовыделения SARS-CoV-2 (r = - 0,529, p = 0,007, статистический анализ проводился по формуле парных статистических связей – коэффициент корреляции Пирсона). Вышеописанное вызывает необходимость изучения присутствия SARS-CoV-2 в аутопсийном материале среди пациентов, умерших от сочетанной патологии COVID-19 и ВИЧ-инфекции.
В статье приведен клинический случай пациента с ВИЧ-инфекцией с полиэтиологичной пневмонией, вызванной сочетанным воздействием SARS-CoV-2, Pneumocystis jiroveci (ПП) и атипичных микобактерий.
Цель исследования: изучить частоту выявления РНК SARS-CoV-2 у больных ВИЧ-инфекцией в аутопсийном материале и оценить морфологические изменения у пациента, умершего от CОVID-19 на фоне ВИЧ-инфицирования.
Материалы и методы исследования
Был проведен ретроспективный анализ 32 историй болезни пациентов с сочетанной инфекцией COVID-19 на фоне ВИЧ-инфекции, которые закончились летальным исходом, за период с января по ноябрь 2022 г. на базе ГАУЗ «РКИБ им проф. А.Ф. Агафонова». Для анализа поражения органов и систем вирусом SARS-CoV-2, а именно его выявления из аутопсийного материала, всем пациентам проводилось микробиологическое исследование мазка из носоглотки, ткани правого и левого легкого, трахеи и селезенки, методом ПЦР. Все биоматериалы были обследованы на РНК вируса SARS-CoV-2, исследование проводилось на базе ФБУЗ «Центр гигиены и эпидемиологии в РТ». Гистологические исследования аутопсийного материала проводились на базе ГАУЗ «Республиканское бюро судебно-медицинской экспертизы МЗ РТ».
Результаты исследования и их обсуждение
Анализ выявления РНК вируса SARS-CoV-2 показал присутствие патогена во всех видах биоматериалов только у 9,4% умерших. Обращала на себя внимание история болезни одного из этих пациентов, где было диагностировано более двух возбудителей при поражении органов дыхания. Пациент был госпитализирован на 9-й день болезни (д.б.), находился в стационаре 4 койко-дня, летальный исход наступил на 13-й д.б., 4-й день госпитализации (д.г.). Коронавирусная инфекция (COVID-19), подтвержденная методом ПЦР РНК SARS-CoV-2, проявилась в тяжелой степени тяжести. Состояние усложнялось наличием у пациента IVВ стадии ВИЧ-инфекции, прогрессирующей без АРВТ. Такое сочетание создавало дополнительную нагрузку на иммунную систему пациента, делая его более уязвимым для других инфекций. У пациента был диагностирован микобактериоз, ПП, которые могут вызвать ряд пульмонологических осложнений, и ВИЧ-ассоциированное нейрокогнитивное расстройство с токсико-дисметаболической энцефалопатией [10]. Кроме того, было выявлено серьезное осложнение - сепсис, вызванный Salmonella enteritidis. Все эти состояния требуют интегрированного и тщательно продуманного подхода как к диагностике, так и к лечению, с особым вниманием к возможным взаимодействиям между различными патогенами и к выбору оптимальной терапевтической стратегии.
Клиническое наблюдение
Пациент С., 1980 года рождения, был доставлен СМП в апреле 2022 года в реанимационное отделение ГАУЗ «РКИБ им. профессора Агафонова» г. Казани в тяжелом состоянии вследствие респираторного синдрома, ДН1, интоксикации, гипотонии и выраженной кахексии, в истощенном состоянии (недостаточность питания тяжелой степени, ИМТ 13,7). Жалобы и анамнез собраны со слов сопровождающего ввиду тяжести состояния пациента. Известно, что заболевание манифестировало за 8 дней до госпитализации с астеновегетативного синдрома и интоксикации, на 9-й день присоединилась выраженная слабость. У пациента имелось наличие ВИЧ-инфекции, давность инфицирования составляла 10 лет. Выполнена КТ органов грудной клетки, по данным которой наблюдались изменения, типичные для инфильтративного туберкулеза легких. Анамнез жизни: в анамнезе были указания на прием АРВТ и туберкулез легких в 2020 г. Эпидемиологический анамнез без особенностей: пациент не привит от НКВИ, гриппа и пневмококковой инфекции, за пределы Республики Татарстан в последний год не выезжал. В ПДО РКИБ ИХА на КВИ отрицательно. Госпитализируется в отделение реанимации и интенсивной терапии (ОРИТ) с клиническим диагнозом: В20 стадия 4В, прогрессирование без АРВТ. Кахексия. Пневмоцистная пневмония? ДН1. КТ0. Туберкулез легких?
При поступлении в ОРИТ имел место резко выраженный дефицит массы тела (вес 35 кг при росте 162 см, ИМТ 13,7). Уровень нарушения сознания составлял 13 баллов по шкале Глазго (сознание было сохранено, но быстро истощался) (умеренное оглушение). При осмотре обращали на себя внимание положение пациента – прон-позиция (на боку/спине), проявления синдрома интоксикации в виде субфебрильной лихорадки и слабости, одышка смешанного характера, страдальческое выражение лица. Физикальное обследование пациента выявило нестабильную гемодинамику с тенденцией к гипотонии (АД 84/61 мм рт. ст., тахикардия с ЧЧС 136 уд./мин., Т- 36,4 °С, ЧДД - 20), компенсированную респираторную недостаточность (гипоксемия pSO2 93%), аускультативно выслушивалось жесткое дыхание по всем легочным полям и определялась смешанная одышка. По шкале NEWS 7 баллов. В отделении был установлен уретральный катетер, продолжена оксигенотерапия в режиме Low flow – 10 л/мин. и начата кардиотоническая поддержка: норадреналин 0,1 мкг/кг/мин. По данным ЭКГ: без острой коронарной патологии, синусовая тахикардия с ЧЧС 136 уд./мин., вертикальное положение ЭОС, угол альфа +90°. Глубокие S V5-V6. ЭХОКГ выявил умеренный пролапс митрального клапана (МК) с митральной регургитацией 1-2 степени, уплотнение створок МК. Избыточной жидкости в полости перикарда не было. При РКТ органов грудной клетки обнаружено: большое количество мелких очаговых изменений до 4-5 мм в диаметре, также в S6 и S10 левого легкого определялись очаги с полостями - расцененные как типичные изменения для инфильтративного туберкулеза легких. В общем анализе крови у пациента наблюдалась гипохромная анемия (RBC-4.01х1012/л, Hb-110 г/л), тромбоцитопения (132х109/л), нейтрофильный сдвиг в лейкоформуле (neu-73.3%, lim-13.7%, mon-6.8%), Leu -5,8 109/л. В биохимическом анализе крови: гипоальбуминемия (20.1 г/л), повышенный билирубин (28.7 мкмоль/л), АЛТ (20.2 Ед/л) АСТ (67.2 Ед/л), ЛДГ (295,0 Ед/л), мочевина (20.5 ммоль/л), креатинин (253 мкмоль/л), СРБ (69.4 мг/л, ферритин -740.8 нг/мл), прокальцитонин - 8.746 нг/мл, глюкоза 6.9 ммоль/л. По данным коагулограммы, удлинение протромбинового времени (11.9 сек.) и тромбинового времени (20.50 сек.). В анализе мочи в 1 д.г. следы белка (0,3 г/л), прозрачная, эпителий плоский 1-2 в п./зр., лейкоциты 1-3 в п./зр., слизь присутствует, гиалиновые цилиндры 1-2 в п./зр. УЗИ органов брюшной полости, почек, плевральных полостей выявило признаки диффузных изменений печени по фиброзно-жировому типу, негомогенного содержимого желчного пузыря, нефропатии; на момент осмотра плевральных полостей - справа свободная жидкость не визуализировалась. ПЦР на РНК SARS-CoV-2 из носо/ротоглотки – положительно, вирус идентифицирован в первые сутки госпитализации. SOFA составляло 8 баллов, qSOFA - 2 балла, последний показатель указывал на вероятное присутствие инфекции в варианте сепсиса (назначено бактериологическое исследование крови на стерильность).
Получал терапевтическую дозу триметоприм-сульфаметаксазола по 1920 мг в/в капельно, антибактериальную, противогрибковую терапию, инфузионную терапию, респираторную и кардиотоническую поддержку. Согласно ВМР №15 (22.02.2022) получал противовирусную терапию НКВИ – ремдесевир.
В день госпитализации проведенная бактериоскопия мокроты обнаружила M.tuberculosis. Выставлен клинический диагноз: В20 стадия 4В, прогрессирование без АРВТ. Кахексия. Пневмоцистная пневмония? ДН2. КТ0. Туберкулез легких.
Консультирован врачом-фтизиатром. По данным, полученным из ФРБТ: пациент состоял на учете с диагнозом «инфильтративный туберкулез легких» с января 2020 г. Лечение по III ПХТ было начато, но самостоятельно прервано в ноябре 2020 г. По данным РКТ ОГК от 1 д.г. в S6 и S10 левого легкого полости d=1 см, с обеих сторон очаговые тени. В мокроте МБТ (+) бактериоскопия от 1 д.г. Выставлен диагноз: НКВИ. Инфильтративный туберкулез обоих легких в фазе распада и обсеменения. Обострение. В20 4В стадия прогрессирования без АРВТ. Рекомендовано: перевод в РКПД при условии транспортабельности больного и проведение бактериограммы.
Также в 1 д.г. был консультирован врачом-инфекционистом центра ГАУЗ «РЦПБ СПИД и ИЗ МЗ РТ» в г. Казань. Уровень СД 4+ Лимфоцитов – 239 кл/мл, ВН 986 тыс. копий/мл от июня 2020 г. Стаж инфицирования 10 лет, без АРВТ. Было рекомендовано уменьшить дозу бисептола с лечебной до профилактической (с 1920 мг до 480 мг). В анамнезе были указания на прием АРВТ в комбинации (тенофовир+ламивудин+эфавиренз) на протяжении 10 месяцев (с ноября 2019 г. по август 2020 г.), самостоятельно прервал лечение. Таким образом, пациент был не привержен к АРВТ, имел высокую вирусную нагрузку и иммунодефицит, соответствующий стадии 4В.
На 12-й час пребывания в стационаре (АД 112/74, пульс 83, ЧСС 83, Т 36,2 °С, SpO2 98%) состояние сохранялось тяжелым за счет респираторного синдрома, ДН 1ст, ИТС, выраженной кахексии. Отмечалась положительная динамика за счет повышения уровня сознания (14 баллов по шкале Глазго), контакту был доступен, но истощение по-прежнему наступало быстро. Положение прежнее вынужденное - прон-позиция на боку/на спине. Гемодинамика стабилизировалась, кардиотоническая поддержка не требовалась, но склонность к гипотонии сохранялась. Дыхание самостоятельное, с респираторной поддержкой (масочная вентиляция). Бледность кожных покровов и слизистых сохранялась, тургор был снижен. Мочеиспускание по уретральному катетеру.
На вторые сутки пребывания пациента в реанимации (Т 36.2 °С, ЧДД 18, ЧСС 88, пульс 88, АД 110/73 мм рт. ст., SpO2 98%) состояние сохранялось стабильно тяжелым, с небольшой положительной динамикой за счет уменьшения степени ДН, проявлений интоксикации и улучшения уровня сознания (14 баллов шкале Глазго), истощение по-прежнему наступало быстро, но неврологически и физически пациент был более активен в сравнении с 1 д.г. В кислородной поддержке не нуждался. Периодически требовалась кардиотоническая поддержка - подключался норадреналин в дозировке 0,1-0,2 мкг/кг/мин. Кожные покровы, слизистые и по внутренним органам без динамики. По данным общего анализа крови на 2 д.г. у пациента наблюдалось снижение показателей - гипохромной анемии (RBC 3.32 х1012/л, Hb 93 г/л), тромбоцитопения (98х109/л), нейтрофильный сдвиг в лейкоформуле с нарастанием (neu 82%, lim 8,6%, mon 2,5%). По данным коагулограммы: удлинение протромбинового времени (12,1 сек.), а также тромбинового времени (19.50 сек.). В биохимическом анализе крови: мочевина (16,2 ммоль/л), креатинин (202 мкмоль/л) - в динамике со снижением, СРБ (163,06 мг/л) - нарастал, глюкоза 6.4 мл/л.
Консультирован неврологом на 2 д.г., неврологический статус: сознание сохранено, был дезориентирован во времени. Не критичен к своему состоянию. Эйфоричен. Когнитивно грубо снижен. Команды выполняет, обращенную речь понимает, собственная речь слегка дизартрична. ЧМН: поля зрения не нарушены, глазные зрачки и щели равные, фотореакции сохранены. Нистагма нет. Лицо без явной асимметрии. Дисфагии нет. Сила мышц в руках 5 баллов по всем группам, в ногах снижена диффузно до 4 баллов на фоне астенизации. Четких чувствительных нарушений нет. CXP S=D, оживлены. Кистевой аналог Россолимо, рефлексы орального автоматизма с двух сторон. Тонус мышц слегка снижен. Динамической атаксии нет. Менингеальных знаков нет. Выставлен диагноз: ВИЧ-ассоциированное большое нейрокогнитивное расстройство (деменция). Токсико-дисметаболическая энцефалопатия. Рекомендовано: при проведении КТ ОГК в динамике, выполнить КТ головного мозга, витаминотерапия, терапия основного заболевания.
Получены результаты бактериограммы: M.tuberculosis не выделены, но обнаружены атипичные микобактерии. Заключение - Ds: Микобактериоз.
Несмотря на проводимую терапию, состояние пациента оставалось крайне тяжелым, прогноз неопределенным. На 3 д.г. АД 117/78, ЧСС 91, ЧД 22, SpO2 95%, Т 36,2 °С) SOFA – 15 баллов, qSOFA- 2 балла, состояние пациента тяжелое нестабильное. Сепсис, септический шок. Гемодинамическая недостаточность, ДН 1 ст., ИТС, кахексия. Периренальное ОПП? Панцитопения. Гемодинамика нестабильная, необходимость в вазопрессорной поддержке: титрование норадреналина в дозировке 0,2 мкг/кг/мин. Сознание - оглушение 1 ст, ШКГ 13-14 б. На простые вопросы отвечал невнятно, быстро истощался, засыпал. Контакту был доступен с трудом. Кожные покровы бледные, сухие на ощупь, тургор снижен. Дыхание самостоятельное, в респираторной поддержке не нуждался. Тоны сердца приглушены, ритмичные. Мочеиспускание по уретральному катетеру. Частичное энтеральное питание, продолжал получать специфическую, кардиотоническую и инфузионную терапию. По данным общего анализа крови на 3 д.г. у пациента регистрировалась лейкопения 2,2 х109/л, нарастала гипохромная анемия (RBC 2,66 х 1012/л, Hb 75 г/л) и тромбоцитопения (63 х109/л), сохранялся нейтрофильный сдвиг (neu 81,2%, lim 8,7%, mon 2,3%). ПЦР анализ на РНК SARS-CoV-2 на 3 д.г. не обнаружена. Бактериологическое исследование крови выявило Salmonella enteritidis.
На фоне проводимой комплексной интенсивной терапии, состояние пациента продолжало ухудшаться. На 4-й день нахождения в реанимации состояние пациента было крайне тяжелым, сознание динамически за 3 часа сменилось с оглушения до комы (8 баллов по ШКГ), устойчивая гипотония, на фоне постоянной инфузии норадреналина; кожные покровы сохранялись бледными, выраженный акроцианоз; на фоне ингаляций увлажненным кислородом 10 л/мин. дыхание – патологическое с отрицательной динамикой, отмечалось участие вспомогательной мускулатуры; декомпенсированная дыхательная недостаточность явилась показанием к механической вентиляции легких; была произведена интубация трахеи, аппаратная вентиляция, давление на вдохе 20 мбар, содержание кислорода 95%, положительное давление в конце выдоха (ПДКВ) 8 мбар; аускультативно хрипы: единичные, влажные; пальпаторно живот: мягкий, отделяемое из желудочного зонда застойное в умеренном объеме; диурез: снижен; стул: не был; терапия: по карте интенсивной терапии. При явлениях прогрессирования полиорганной недостаточности произошла остановка сердца. Реанимационные мероприятия в полном объеме в течение 30 минут эффекта не достигли, констатирована биологическая смерть.
Заключительный диагноз: коронавирусная инфекция COVID-19 (ПЦР РНК обнаружена) тяжелой степени тяжести на фоне ВИЧ-инфекции, стадия 4В; прогрессирование без АРВТ. Кахексия. Сепсис, обусловленный Salmonella enteritidis. Осложнения: синдром полиорганной недостаточности. Сопутствующие: микобактериоз. ВИЧ-ассоциированное большое нейрокогнитивное расстройство (деменция). Токсико-дисметаболическая энцефалопатия.
Патологоанатомический диагноз: основное заболевание - коронавирусная инфекция, подтвержденная ФБУЗ. Код U07.1. Фоновое заболевание: ВИЧ-инфекция, стадия 4В; прогрессирование без АРВТ. ВПВУ 853. Осложнение основного заболевания: полиэтиологическая пневмония (пневмоцистная, вирусная, бактериальная). Гидроторакс (300 мл). Отек легких. Отек головного мозга. Сопутствующие заболевания: кардиомиопатия. Жировой гепатоз. Хронический гепатит. Микобактериоз.
Макроскопически обращал на себя внимание резко выраженный дефицит массы тела (вес 35 кг при росте 162 см); вес легких составил: левого 700 г, правого 780 г, при норме (350-450 г); наличие выпота в плевральной полости: в левой полости 100 мл, в правой 200 мл; повышенное количество бесцветной прозрачной жидкости в полостях желудочков головного мозга; изменения со стороны миокарда на разрезе - цвет «вареного мяса»; в верхних дыхательных путях - слизистая оболочка трахеи и бронхов серая, с большим количеством желтого, серого содержимого.
Для проведения ПЦР-тестов на аутопсии были взяты образцы тканей левого и правого легкого, трахеи, селезенки и мазок из носоглотки. РНК SARS-CoV-2, по результатам тестирования, обнаружена во всех перечисленных образцах.
При гистологическом исследовании дистальных отделов трахеи выявлены процессы нарушения кровообращения и микрогемореологии в сосудах микроциркуляторного русла подслизистого слоя в виде эритроцитарных сладжей, стазов, формирующихся тромбов, набухания стенок сосудов. Нарушения кровообращения сочетались с процессами апикальной и (или) тотальной десквамацией эпителия, выраженной гиперплазией и гиперсекрецией слизистых желез, воспалительная инфильтрация представлена в виде мелких круглоклеточных периваскулярных инфильтратов, таким образом, установлено наличие неспецифических морфологических признаков, указывающих на катарально-десквамативный трахеит. Паратрахеальные лимфатические узлы резко уменьшены в размерах, имеют признаки фолликулярной инволюции с лимфоидным истощением, что соответствует глубокому иммунодефицитному состоянию пациента на фоне ВИЧ-инфекции стадии 4В, прогрессирование без АРВТ.
В легочной ткани умершего на 13 д.б. определялись патоморфологические признаки, соответствующие экссудативной стадии острого респираторного дистресс-синдрома: гибель альвеолоцитов 1-го типа с формированием «оголения базальных мембран» (явление денудации), гиперплазия альвеолоцитов 2-го типа; десквамация эндотелия сосудов; альвеолярный отек легких, в значительной части полей зрения «микробный альвеолярный отек» (серозный экссудат с примесью преципитатов, единичных нитей фибрина, обращает внимание примесь полиморфной микрофлоры с единичными клетками воспалительного процесса); очаговые интраальвеолярные кровоизлияния; немногочисленные гиалиновые мембраны по контурам альвеолярных ходов, альвеолярных мешочков, альвеол, на стенке межальвеолярных перегородок (рис. 1).
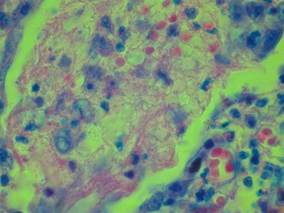
Рис. 1. Полиэкссудативная пневмония: в просвете альвеол пенистые массы, примесь элементов белой крови и нитчатого фибрина. Окраска по Цилю-Нильсену. Об. х20
Внимание привлекло несоответствие стадии ОРДС и длительности основного патологического процесса (13-й день болезни COVID-19) в легких. По данным литературы, с 10-го дня болезни при типичном развитии инфекционного и морфологического процессов в ткани легких наступает пролиферативная стадия, которая длится до 20-го д.б. от начала клинических симптомов. При этом непосредственные причины смерти в этот период, с 10-го по 20-й д.б., наиболее часто связаны с тромбоэмболическими осложнениями и присоединением вторичной (бактериальной) инфекции [11].
У исследуемого пациента была очаговая полиэкссудативная пневмония (серозно-макрофагальная, серозно-гнойная, серозно-фибринозно-гнойная) с преимущественным расположением экссудата в альвеолах, в немногочисленных полях зрения в межальвеолярных перегородках; проявления нарушений микроциркуляции (эритростазы, сладж эритроцитов, малые периваскулярные кровоизлияния), наличие микротромбов (эритрофибриновых), в межальвеолярных перегородках - очаговая периваскулярная круглоклеточная инфильтрация. В значительном количестве полей зрения во всех препаратах легких выявлены проявления ПП в виде скоплений пенистых масс в просветах альвеол с примесью десквамированного эпителия, положительная окраска на цисты Pneumocystis jirovecii (рис. 2).
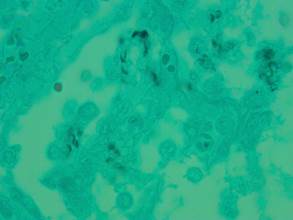
Рис. 2. Пневмоцистная пневмония: цисты Pneumocystis jirovecii в просвете альвеолы. Окраска по Гроккоту. Об. х100
При гистохимической окраске препаратов легких по Цилю – Нильсену получены отрицательные результаты (рис. 3).
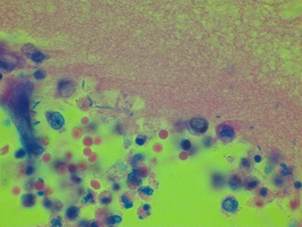
Рис. 3. Полиэкссудативная пневмония: в просвете альвеол - «микробный отек», сформированный пенистыми массами, преципитатами, бактериальной микрофлорой. Об. х100
В препарате поджелудочной железы – на фоне сетчатого фиброза выявлены участки пролиферации протоков, просветы которых выполнены обтурирующими гиалиноподобными массами с набуханием до расслоения стенок протоков, выраженное полнокровие, наличие периваскулярных кровоизлияний и отека стромы, что соответствует отечному интерстициальному панкреатиту, который в свою очередь мог быть как реактивным на фоне острого инфекционного процесса, так и результатом изменений со стороны гепатобилиарной системы на фоне резко выраженного дефицита массы тела.
В препарате сердца – полиморфизм и распространенная дистрофия миокарда, очаговый «студневидный» отек эпикарда, который мог развиться у данного пациента на фоне недостаточности питания.
В препарате печени – распространённая разновеликая жировая дистрофия гепатоцитов с формированием многочисленных жировых микрокист с очагами некрозов отдельных групп гепатоцитов; участки круглоклеточной инфильтрации стромы без выхода клеток инфильтратов в паренхиму. Этиологией жировой дистрофии у данного пациента могли послужить несколько факторов: гипоксия вследствие дыхательной недостаточности, среднетяжёлая гипохромная анемия и белковая недостаточность на фоне резко выраженного дефицита массы тела (рис. 4).
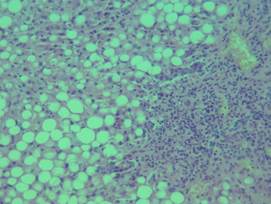
Рис. 4. Паренхиматозная дистрофия печени с образованием жировых микрокист, очаговая круглоклеточная инфильтрация стромы. Окраска гематоксилином и эозином. Об. х20
В препарате почки – отдельные признаки очагового гломерулонефрита (по экстра- и интракапиллярному типу) с перифокальной гипо-, гипертрофией канальцев и круглоклеточной инфильтрации, мембранопатии, цилиндрурии; в просветах части канальцев – наличие грибковой микрофлоры; белковая и гидропическая дистрофия канальцевого эпителия с очагово-диффузным апикальным и (или) тотальным некробиозом; неравномерное кровенаполнение (рис. 5). Лимфоузлы резко уменьшены в размерах, имеют признаки фолликулярной инволюции с лимфоидным истощением.
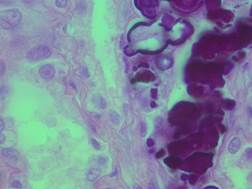
Рис. 5. Паренхиматозная дистрофия канальцев почек, очаговый их некронефроз, скопления микрофлоры в просветах канальцев. Окраска гематоксилином и эозином. Об. х100
Непосредственной причиной смерти явилась легочно-сердечная недостаточность у пациента с НКВИ с развитием полиэтиологической пневмонии на фоне ВИЧ-инфекции в стадии 4В, прогрессирование без АРВТ. В развитии полиэтиологичной пневмонии ведущую роль сыграла Pneumocystis jiroveci, в сочетании с бактериальной флорой. В значительной части полей зрения имеет место «микробный альвеолярный отек» в виде наличия в экссудате полиморфной микрофлоры, скопления пенистых масс в просветах альвеол с примесью десквамированного эпителия и положительной окраской на цисты Pneumocystis jirovecii. Кроме того, обращает внимание иная динамика патологического процесса с удлинением экссудативной фазы диффузного альвеолярного повреждения легких.
Таким образом, частота выявления РНК вируса SARS-CoV-2 у умерших больных сочетанной инфекцией составляет 9,4%. В условиях снижения иммунологической защиты макроорганизма на поздних стадиях ВИЧ-инфекции, изменения в легких у больных CОVID-19 имеют остро прогрессирующий характер, принимают черты осложненного течения, что приводит к неблагоприятному исходу заболевания.
Библиографическая ссылка
Моисеева С.В., Тимерзянов М.И., Хромова А.М., Хаертынова И.М., Фаткуллин Б.Ш., Акберов А.Р. КЛИНИКО-МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА ПОЛИЭТИОЛОГИЧНОЙ ПНЕВМОНИИ У БОЛЬНОГО COVID-19 НА ФОНЕ ВИЧ-ИНФЕКЦИИ // Современные проблемы науки и образования. 2024. № 3. ;URL: https://science-education.ru/ru/article/view?id=33415 (дата обращения: 25.01.2026).
DOI: https://doi.org/10.17513/spno.33415



