COVID-19 остается глобальной проблемой мирового здравоохранения. Заболевание сопряжено с высокой летальностью, особенно у пожилых пациентов, имеющих различную сопутствующую патологию. Патогенез COVID-19 достаточно хорошо изучен. На начальном этапе заражения происходит проникновение SARS-CoV-2 в клетки-мишени, имеющие рецепторы ангиотензинпревращающего фермента II типа (АПФ2), эпителия верхних дыхательных путей, эпителиоциты желудка и кишечника [1, 2]. Основным звеном развития патологического процесса является панваскулит капилляров легких и желудочно-кишечного тракта с развитием системного капилляро-альвеолита и/или гастроэнтероколита [3, 4]. Вирус SARS-CoV-2 способен вызывать повреждение эндотелия сосудов с развитием эндотелиита [3, 5]. По сути, эндотелиит – это механизм альтерации кровеносных сосудов с развитием васкулопатии вследствие прямого цитопатического воздействия вируса на эндотелиоциты и иммуноопосредованного повреждения эндотелия [6, 7].
Вместе с тем остается неопределенным, действительно ли при COVID-19 происходит вовлечение эндотелиальных клеток в патологический процесс, тем самым вызывая сосудистые нарушения. Предположительно, эндотелиит, вызванный SARS-CoV-2, приводит к повреждению сосудистой стенки и способствует развитию кровотечения [8]. Особенно у пациентов с исходно скомпрометированным эндотелием вследствие других заболеваний. Так, сердечно-сосудистые заболевания приводят к эндотелиальной дисфункции, которая сопровождается нарушением целостности гликокаликса, повышением проницаемости эндотелия и апоптозом эндотелиоцитов с формированием дефектов в монослое [9, 10]. Патогенез формирования дисфункции эндотелия на молекулярном уровне происходит путем взаимодействия рецептор/лиганд в зависимости от типа рецептора. Специфичность антигенов рецептора определяет уникальность клеточных изменений. CD31 рецепторы, экспрессируемые на поверхности эндотелиоцитов, способствуют не только ролингу лимфоцитов по поверхности эндотелия и проникновению его в межэндотелиальные щели, но и инициируют каскад внутриклеточных процессов, при помощи которых выделяются цитокины, повышается содержание внутриклеточного кальция и запускается процесс апоптоза эндотелиоцитов, что приводит к раневому дефекту сосудистой стенки [11].
Прогноз COVID-19 нередко связан именно с внелегочными осложнениями. В структуре геморрагических осложнений COVID-19 желудочно-кишечные кровотечения (ЖКК) занимают первое место [12, 13]. Частота их возникновения колеблется по данным различных исследователей от 3,0 до 31,1 % [14, 15]. Значимым осложнением COVID-19 также является развитие спонтанных гематом (СГ) мягких тканей различных локализаций с частотой возникновения от 2,7 до 3,9 % [16, 17].
Цель исследования – на основании комплексного клинико-лабораторного и инструментального обследования определить основные факторы риска развития хирургических геморрагических осложнений у больных COVID-19.
Материалы и методы исследования
Исследование проведено на базе СПб ГБУЗ «Клиническая инфекционная больница им. С.П. Боткина». В исследование включены случаи лечения больных COVID-19, осложненной ЖКК из верхних отделов желудочно-кишечного тракта (ЖКТ) и спонтанными кровотечениями (СК) в мягкие ткани различных анатомических локализаций.
В результате анализа данных клинико-лабораторных и инструментальных методов исследований оценивались факторы, свидетельствовавшие о развитии эндотелиальной дисфункции, которая, в свою очередь, могла являться одним из триггеров развития геморрагических осложнений. При сборе анамнеза наиболее значимыми были сроки от появления первых симптомов COVID-19 до госпитализации в стационар, а также наличие сопутствующих заболеваний. Степень тяжести состояния пациентов определялась по шкале NEWS, оценивалась выраженность дыхательной недостаточности (ДН), способ обеспечения функции внешнего дыхания. Из лабораторных методов оценивались показатели, которые могли свидетельствовать о коагуляционных расстройствах: уровень тромбоцитов, международное нормализованное отношение (МНО), активированное частичное тромбопластиновое время (АЧТВ), фибриноген, D-димер. Всем больным выполнялась спиральная компьютерная томография органов грудной клетки (СКТ ОГК) как наиболее информативный метод определения объема вирусного поражения легочной паренхимы. Визуализация и способы воздействия на источник кровотечения из верхних отделов ЖКТ осуществлялись при помощи эндоскопических методик. При определении тактики лечения спонтанных кровотечений в мягкие ткани учитывались данные СКТ в ангиорежиме. Предпочтение отдавали консервативным способам остановки кровотечения, но в случае признаков экстравазации, выявленной при СКТ в ангиорежиме, наличия напряженной гематомы с прорывом в брюшную полость прибегали к хирургическим методам остановки кровотечения. Микроскопические препараты из аутопсийного материала окрашивались гематоксилином-эозином и по Маллори. С помощью моноклональных сывороток в срезах выявлялись антигены CD31, CD34.
Анализ факторов, оказывающих возможное влияние на развитие ЖКК и СГ в мягкие ткани различных анатомических локализаций, проводился путем построения прогностической модели методом логистической регрессии, прямым способом включения факторов с расчетом критерия Вальда при помощи программы IBM SPSS 21.0.
В период с апреля 2020 г. по декабрь 2022 г. в СПб ГБУЗ «Больница Боткина» проходили лечение 115 больных с COVID-19, у которых развилось ЖКК из верхних отделов ЖКТ (0,24 % от всех больных CОVID-19). Эти пациенты составили I группу: 58 мужчин (50,5 %) и 57 женщин (49,5 %). Во II группу включены 24 пациента (0,05 % от всех больных COVID-19), у которых возникли СК в мягкие ткани различных локализаций. Из них было 4 мужчин (16,7 %) и 20 женщин (83,3 %).
У всех пациентов диагноз COVID-19 был подтвержден молекулярно-биологическим методом – полимеразной цепной реакцией (ПЦР) путем обнаружения РНК SARS-CoV-2 в мазках из носо- и ротоглотки, а также у всех больных были выявлены соответствующие признаки вирусного повреждения легких при лучевых методах диагностики.
Согласно международной классификации возрастов ВОЗ от 2022 г. больные распределились следующим образом: в I группе в возрасте до 59 лет (зрелый и средний возраст) находились 40 (34,8 %) пациентов; в старшей возрастной группе от 60 до 89 лет – 67 (58,3 %) больных, в возрасте 90 и более лет (долгожители) были 8 (6,9 %) пациентов. Во II группе в возрасте до 59 лет было 9 (37,5 %) больных, от 60 до 89 лет – 14 (58,3 %) пациентов, в возрасте 90 и более лет – 1 (4,2 %). Средний возраст больных в I группе составил 65,22 ± 1,59 года, во II группе – 61,6 ± 22 года. В обеих группах в основном превалировали пациенты старшего возраста.
Пациенты обеих исследуемых групп поступали в стационар преимущественно в первую неделю болезни (табл. 1).
Таблица 1
Сроки госпитализации пациентов с COVID-19 и геморрагическими осложнениями от начала заболевания
|
Начало заболевания |
I группа, n = 115 (ЖКК) |
II группа, n = 24 (СК) |
|
До 7 суток |
75 (65,2 %) |
13 (54,2 %) |
|
7–14 суток |
29 (25,2 %) |
10 (41,7 %) |
|
15–22 суток |
7 (6 %) |
1 (25 %) |
|
Более 23 суток |
4 (3,5 %) |
– |
У всех больных обеих групп наблюдались сопутствующие заболевания. При этом у большинства имело место сочетание двух и более заболеваний. Особенно следует отметить во II группе 25 % родильниц с наиболее тяжелым течением заболевания (табл. 2).
Таблица 2
Структура сопутствующих заболеваний у больных c геморрагическими осложнениями COVID-19
|
Сопутствующие заболевания |
I группа (ЖКК), n = 115 |
II группа (СК), n = 24 |
|
|
ИБС: Атеросклеротический кардиосклероз |
64 (55,7 %) |
11 (48,5 %) |
|
|
ИБС: Постинфарктный кардиосклероз |
12 (10,4 %) |
– |
|
|
Артериальная гипертензия |
65 (56,5 %) |
9 (37,5 %) |
|
|
Фибрилляция предсердий и другие формы аритмий |
22 (19,1 %) |
1 (4,2 %) |
|
|
Хроническая сердечная недостаточность |
25 (21,7 %) |
5 (20,8 %) |
|
|
Сосудистая патология головного мозга |
32 (27,8 %) |
6 (25 %) |
|
|
Диффузно-узловое поражение щитовидной железы |
17 (14,8 %) |
2 (8,3 %) |
|
|
Хроническая обструктивная болезнь легких |
11 (9,6 %) |
3 (12,5 %) |
|
|
Бронхиальная астма |
5 (4,3 %) |
3 (12,5 %) |
|
|
Туберкулез легких в анамнезе (ремиссия) |
1 (0,9 %) |
– |
|
|
Перенесенные операции на желудке (в анамнезе) |
8 (6,9 %) |
– |
|
|
Язвенная болезнь желудка и двенадцатиперстной кишки |
11 (9,6 %) |
1 (4,2 %) |
|
|
Желчнокаменная болезнь |
19 (16,5 %) |
13 (14,6 %) |
|
|
Мочекаменная болезнь |
22 (19,1 %) |
2 (8,3 %) |
|
|
Сахарный диабет 1 типа |
2 (1,7 %) |
– |
|
|
Сахарный диабет 2 типа |
24 (20,9 %) |
4 (16,7 %) |
|
|
Хроническая почечная недостаточность 3–4 стадии |
3 (2,6 %) |
– |
|
|
Хроническая почечная недостаточность 5 стадии |
23 (20 %) |
2 (8,3 %) |
|
|
ХВГ В |
3 (2,6 %) |
– |
|
|
ХВГ С |
3 (2,6 %) |
– |
|
|
Цирроз печени |
9 (7,8 %) |
– |
|
|
ВИЧ-инфекция |
5 (4,3 %) |
– |
|
|
Ожирение |
16 (13,9 %) |
– |
|
|
Беременность |
3 (2,6 %) |
6 (25 %) |
|
Результаты исследования и их обсуждение
При поступлении в стационар в соответствии с клиническими рекомендациями всем пациентам проводилась оценка тяжести состояния по балльной шкале NEWS. В I группе от 1 до 4 баллов набрали 47 (40,9 %) больных, 4–6 баллов – 14 (12,2 %) и более 7 баллов – 44 (38,3 %). Во II группе от 1 до 4 баллов – 11 (45,8 %) пациентов, 4–6 баллов – 6 (25 %) и более 7 баллов 7 (29,2 %) больных. В обеих группах в основном наблюдались пациенты, набравшие более 4 баллов, что свидетельствовало о нестабильности состояния. Степень дыхательной недостаточности (ДН) была сопоставима с тяжестью состояния пациентов по шкале NEWS. В I группе ДН 0–I была выявлена у 49 (42,6 %) больных, ДН II – у 34 (29,5 %) и ДН III – у 32 (27,8 %) пациентов. Во II группе степень дыхательной недостаточности соответствовала: ДН 0–I – у 7 (29,2 %) больных, ДН II – 7 (29,2 %) и ДН III была отмечена у 10 пациентов (41,7 %). Следует отметить, что в основном наблюдалась дыхательная недостаточность III–IV степени, которая, в свою очередь, коррелировала с объемом поражения легочной паренхимы, выявленным при спиральной компьютерной томографии (СКТ) органов грудной клетки (табл.3).
Таблица 3
Степень поражения легочной паренхимы по данным СКТ органов грудной клетки пациентов COVID-19 с геморрагическими осложнениями
|
Степень поражения легких |
I группа (ЖКК), n = 115 |
II группа (СК), n = 24 |
|
КТ 0-1 |
30 (26 %) |
6 (25 %) |
|
КТ 2 |
24 (20 %) |
2 (8,3 %) |
|
КТ 3 |
20 (17,3 %) |
7 (29,2 %) |
|
КТ 4 |
41 (35,6 %) |
9 (37,5 %) |
В зависимости от способа обеспечения функции внешнего дыхания больные распределились следующим образом: в I группе ИВЛ проводилась 43 пациентам, неинвазивная ИВЛ – 17, в экстракорпоральной мембранной оксигенации нуждались 7 больных. Во II группе дыхательная функция в основном обеспечивалась высокопоточной кислородной поддержкой (рис. 1).
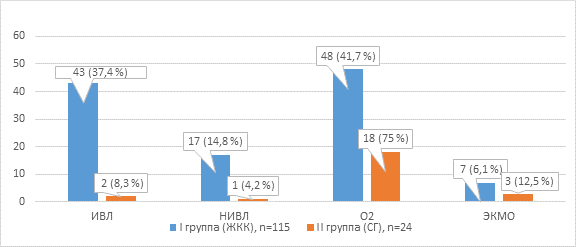
Рис. 1. Способ обеспечения функции внешнего дыхания у пациентов с COVID-19 и геморрагическими осложнениями
В клиническом анализе крови у пациентов I группы в подавляющем числе случаев была выявлена тромбоцитопения – у 66 (57,4 %) больных, а у 6 (5,2 %) больных наблюдался тромбоцитоз. Во II группе также у большинства пациентов установлено наличие тромбоцитопении – 13 (54,2 %), тромбоцитоз встречался у 2 (8,3 %). Наряду с этим в коагулограмме преобладающего большинства больных в обеих группах была отмечена нормокоагуляция: в I группе – у 98, что составило (83 %), во II группе у 18 пациентов (75 %). По интенсивности гипокоагуляции в I группе пациенты распределились следующим образом: МНО (1,6–2,0) низкий уровень – у 5 (4 %), МНО (2,0–3,0) средний уровень – у 7 (6 %), МНО (более 3,0) высокий уровень – 5 (4 %) больных. Во II группе МНО (1,6–2,0) – у 2 (8,3 %), МНО (2,0–3,0) – у 2 (8,3 %), МНО (более 3,0) выявлено у 2 пациентов (8,3 %). По уровню АЧТВ в большинстве случаев наблюдалось увеличение: в I группе у 60 (52,2 %), во второй группе у 10 (41,7 %). Вариант нормы в I группе – у 47 (40,9 %), во II группе – у 10 (41,7 %). Снижение АЧТВ в I группе – у 8 (6,9 %), во II группе – у 4 (16,7 %) больных. По уровню фибриногена отмечалась разнонаправленная динамика, свидетельствующая о воспалительных процессах, статистически значимой гипофибриногенемии не выявлено. Повышение уровня фибриногена в I группе выявлено у 46 (40 %) пациентов, во II группе – у 4 (16,7 %), в норме в I группе – у 42 (36,5 %), во II группе – у 7 (29,2 %). Фибриноген был снижен: в I группе – у 13 (11,3 %), во II группе – у 2 (8,3 %). Наряду с лабораторными признаками, свидетельствующими о склонности к геморрагическим событиям, выявлены лабораторные маркеры, характерные для тромбообразования. Эту особенность отметили многие авторы научных публикаций, посвященных новой коронавирусной инфекции. В преобладающем большинстве случаев установлено повышение уровня D-димера у пациентов с геморрагическими осложнениями COVID-19: в I группе – у 86 (74,8 %), во II группе – у 16 (66,7 %). По септическим протоколам проходили лечение в I группе 43 (37,4 %) пациента. Во II группе сепсис был выявлен у 9 (37,5 %) больных.
Источником кровотечения в I группе в преобладающем проценте случаев были острые или хронические язвы желудка и/или двенадцатиперстной кишки (рис. 2).

Рис. 2. Источник ЖКК у пациентов COVID-19 (I группа)
По интенсивности кровотечения у пациентов I группы в основном наблюдалось неактивное кровотечение (рис. 3).
Рис. 3. Распределение больных в зависимости от интенсивности ЖКК из язвенных дефектов верхних отделов ЖКТ при COVID-19
Степень тяжести кровопотери определялась согласно классификации А.И. Горбашко (1974 г.). У пациентов I группы в основном проценте случаев наблюдалась кровопотеря средней степени тяжести – у 51 (44,3 %), легкая кровопотеря была отмечена – у 36 (31,3 %), тяжелая кровопотеря была выявлена у 28 (24,4 %) больных.
У пациентов II группы спонтанные гематомы мягких тканей в основном локализовались в пределах передней брюшной стенки – у 11 (45,8 %), нижние конечности – у 4 (16,7 %), забрюшинное пространство – у 3 (12,5 %), верхние конечности – у 3 (12,5 %), грудная стенка – у 2 (8,3 %), в области шеи – у 1 (4,2 %) больного. По объему спонтанные гематомы мягких тканей распределились следующим образом: от 200 до 500 мл – у 12 (50 %), от 500 до 1500 мл – у 4 (16,7 %), более 1500 мл – 8 (33,3 %) пациентов. Спонтанные кровотечения в мягкие ткани являются грозным осложнением COVID-19, нередко с неблагоприятным исходом по совокупности факторов. Следует отметить, что спонтанные кровотечения в мягкие ткани, приводящие к образованию объемных гематом, до пандемии новой коронавирусной инфекции встречались крайне редко.
Эндоскопический гемостаз у пациентов I группы был достигнут в 81 % случаев, у 19 % возник рецидив кровотечения. Повторный эндоскопический гемостаз был успешным у всех пациентов. Во II группе в половине случаев гемостаз обеспечен при помощи консервативных мероприятий – 12 (50 %) больных. Открытые операции проведены у 9 (37,5 %), эндоваскулярные способы остановки кровотечения – у 3 (12,5 %) больных.
Летальность в I группе составила 66,9 %, во II группе – 70,8 %. Причиной летальных исходов была нарастающая полиорганная недостаточность, респираторный дистресс-синдром, септический шок. Летальных исходов, связанных с острой кровопотерей, не было.
Для определения факторов риска развития хирургических геморрагических осложнений был проведен корреляционный анализ между основными клинико-лабораторными и инструментальными показателями пациентов в I и II группах и развитием ЖКК и СГ. В матрицу параметров, которые могли влиять на риск геморрагических осложнений, было включено 27 факторов в случайном порядке. Анализ проводился путем построения прогностической модели методом логистической регрессии, прямым способом включения факторов с расчетом критерия Вальда при помощи программы IBM SPSS 21.0.
В структуре всех геморрагических осложнений НКВИ желудочно-кишечные кровотечения занимают первое место. Отмечается увеличение частоты развития кровотечений из эрозивно-язвенных дефектов слизистых ЖКТ во время пандемии COVID-19. Профилактика тромбозов у больных с НКВИ повышает риск развития кровотечений. По данным СПб ГБУЗ «Клиническая инфекционная больница им. С.П. Боткина» ЖКК из верхних отделов желудочно-кишечного тракта при COVID-19 возникло у 115 пациентов, что составило 0,24 %. Пациенты поступили в первую неделю от начала заболевания НКВИ, превалировали больные старшей возрастной группы с множественной сопутствующей патологией, включающей сочетание двух и более заболеваний. По гендерной принадлежности пациенты примерно были сопоставимы. При поступлении в стационар, в соответствии с клиническими рекомендациями по лечению COVID-19, проводилась оценка состояния пациента по шкале NEWS. У подавляющего большинства пациентов при оценке общего состояния сумма баллов была более 4, что свидетельствовало о тенденции к дестабилизации состояния и требовало коррекции как дыхательной функции, так и всех звеньев гемостаза. В свою очередь, эти данные коррелировали со степенью ДН, объемом поражения легочной паренхимы (КТ3 и КТ4) и способами обеспечения функции внешнего дыхания, большая часть пациентов нуждалась в протезировании функции дыхания (ИВЛ, НИВЛ или ЭКМО). Согласно клиническим рекомендациям по лечению НКВИ всем больным проводилась антикоагулянтная терапия. При лабораторном исследовании выявлены отклонения, свидетельствовавшие, с одной стороны, о риске геморрагических событий, с другой стороны, зафиксированы характерные маркеры тромбообразования (уровень D-димера, АЧТВ и ПТИ). Дисбаланс в потреблении и производстве тромбоцитов, установленный в нашем исследовании, оказался сопоставим с данными других работ [8, 14]. Предпочтительными способами остановки кровотечения явились эндоскопические комбинированные методики [18]. По данным исследования, комбинированные способы гемостаза подтвердили свою эффективность у больных COVID-19. Эндоскопический гемостаз был достигнут в 81 % случаев, у 19 % больных возник рецидив кровотечения. Повторный эндоскопический гемостаз был эффективным у всех, ни один пациент не требовал оперативного лечения.
Спонтанные геморрагии в мягкие ткани, в основном связанные с травмами, хирургическими вмешательствами, нарушением свертывания крови, гематологическими заболеваниями, до появления SARS-CoV-2были достаточно редким явлением [19]. Многие авторы отмечают увеличение частоты развития СГ при COVID-19, указывают на триггерный механизм в их развитии и связывают с гепарин-индуцированной коагулопатией, критическими состояниями (сепсис, цитокиновый шторм). В качестве дополнительного звена патологического процесса рассматривается непосредственное цитопатическое воздействие SARS-CoV-2 на эндотелий с развитием его повреждения.
У пациентов со спонтанными геморрагиями в мягкие ткани при клинико-лабораторном исследовании были выявлены те же закономерности, что и у больных с ЖКК. В этой группе женщины в значительной степени превалировали над мужчинами. Помимо известных механизмов развития ЖКК из эрозивно-язвенных дефектов верхних отделов ЖКТ и спонтанных кровотечений в мягкие ткани, нельзя исключить общность патогенеза этих осложнений при COVID-19.
На лабораторном этапе работы получены результаты иммуногистохимического и иммуноцитохимического исследований блоков тканей из устья источников геморрагий с окрашиванием моноклональными антителами с CD31, СD34 к рецепторам эндотелиоцитов. В тканях из устья геморрагий выявлен множественный десквамированный эндотелий, представленный в виде эндотелиальных тромбов в просвете сосудов и за пределами сосудистой стенки. Местами у сосудистой стенки отсутствовал эндотелиальный слой, что могло привести к деструкции сосудистой стенки и развитию геморрагий при COVID-19 (рис. 4).

Рис. 4. Слущенный эндотелий в просвете сосудов. Увеличение числа периваскулярных (вероятно, гладкомышечных) клеток. Иммуногистохимическая реакция с CD34. Исходное увеличение 200. На иммуногистограммах окрашенный в коричневый цвет эндотелий указан стрелками
Это может свидетельствовать об апоптозе эндотелия вследствие непосредственного цитопатического воздействия SARS-CoV-2. В ткани легкого выявлялся выраженный фиброз (рис. 5).

Рис. 5. Выраженный фиброз легкого. Окраска по Маллори. Исходное увеличение 100
При иммуноцитохимическом и иммуногистохимическом исследовании с окрашиванием моноклональными антителами к CD31 рецепторам эндотелиоцитов выявлен общий механизм развития геморрагий при SARS-CoV-2, приводящий к отслойке эндотелия, разрушению эндотелиального слоя, повреждению сосудистой стенки и развитию кровотечения (рис. 6).
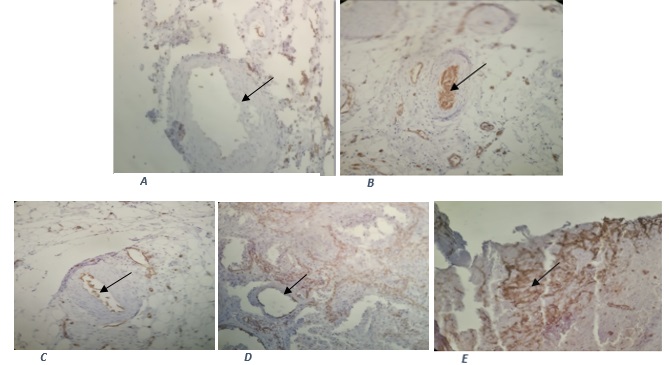
Рис. 6. Иммуногистохимическое исследование с окрашиванием моноклональными антителами к CD 31 рецепторам экспрессируемым на поверхности эндотелиоцитов
На иммуногистограммах окрашенный в коричневый цвет эндотелий, указан стрелками
Примечание: А – стенка сосуда, полностью лишенная монослоя эндотелия; В – в просвете сосуда эндотелиальный тромб; С – множественный десквамированный эндотелий в просвете сосуда; D – внутренняя выстилка сосуда, частично лишенная эндотелия; E – множественные десквамированные эндотелиальные клетки за пределами сосудистой стенки находятся в межклеточном пространстве.
Выводы
1. Факторами, повышающими риск развития геморрагий, являются из лабораторных показателей – МНО и ПТИ, из сопутствующих заболеваний – ХОБЛ, а также развитие газового синдрома, сепсиса (р ˂ 0,05).
2. Комбинированные методы гемостаза эффективны в случаях остановки желудочно-кишечных кровотечений при COVID-19, что позволяет избежать открытых хирургических вмешательств.
3. Развитие спонтанных кровотечений в мягкие ткани у больных COVID-19 является грозным осложнением, зачастую с неблагоприятным прогнозом и требует персонализированной тактики лечения.
4. Миниинвазивные способы остановки кровотечения из питающего сосуда являются наиболее предпочтительными у пациентов с COVID-19.
5. Увеличение частоты развития желудочно-кишечных кровотечений и спонтанных геморрагий в мягкие ткани различных анатомических локализаций у больных COVID-19 непосредственно связано с прямым цитопатическим действием вируса SARS-CoV-2 на эндотелиоциты (деструкция сосудистой стенки вследствие деградации эндотелиального слоя), что определяет формирование единого патогенетического механизма развития геморрагий при COVID-19.
Библиографическая ссылка
Медведев К.В., Гусев Д.А., Цинзерлинг В.А., Протченков М.А., Карпова Р.А., Русанов Д.С., Семенова Н.Ю., Евстропов В.С., Антипова М.В. ФАКТОРЫ РИСКА РАЗВИТИЯ ХИРУРГИЧЕСКИХ ГЕМОРРАГИЧЕСКИХ ОСЛОЖНЕНИЙ У БОЛЬНЫХ НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ (COVID-19) // Современные проблемы науки и образования. 2024. № 2. ;URL: https://science-education.ru/ru/article/view?id=33381 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33381



