При становлении медицинской науки у ее истоков многие исследователи участвовали в проведении экспериментальных работ. С ростом широко проводимых клинических исследований, с установлением общепринятых этических норм, в настоящий момент эксперимент применяется все реже в работах. Однако в ряде исследований, в том числе клинических в кардиологии, проведение экспериментальной части является необходимым для подтверждения и визуализации полученных закономерностей [1-3].
По данным литературы, российские и зарубежные ученые выполняли моделирование системы кровообращения, в том числе при наличии атеросклеротических бляшек. Однако большинство из них представляют собой математические и компьютерные модели. Так, в работе Hotek J.C. проведен анализ гемодинамических параметров пульсовых волн в компьютерной модели, и авторы пришли к выводу о ценности аналитических гемодинамических методов для более глубокого понимания сердечно-сосудистой функции в доклинических моделях [4]. В анализе Alastruey J. также подчеркивается значение экспериментального моделирования пульсовых волн для фундаментальных кардиологических работ широкого профиля [5]. При этом часть исследований по моделированию гемодинамики затрагивает решение таких проблем, как легочная гипертензия [6; 7], рестеноз после проведенной чрескожной коронарной ангиопластики [8], атеросклероз различных локализаций [9], анемии [10], аневризмы аорты и других артерий [11-13]. В российских работах моделировали поток крови, в том числе с изучением влияния атером на артериальный кровоток с помощью математических методов. Так, в исследовании Доль В.В. проведено биомеханическое моделирование кровеносных сосудов с учетом мышечной активности стенок [14]. А в работе Симакова С.С. выполнено математическое многомасштабное моделирование кровотока в сердечно–сосудистой системе [15]. Казанцев А.Н. и соавторы создали компьютерную модель атером бифуркации общей сонной артерии для дальнейшего определения хирургической тактики лечения [16]. Однако ранее в исследованиях не проводилось изучения влияния нарушений сердечного ритма (экстрасистолии (ЭС), фибрилляции предсердий (ФП)) на гемодинамику области бифуркации магистральной артерии при физическом моделировании.
Цель исследования: провести моделирование кровотока в области бифуркации магистральной артерии при правильном ритме и нарушениях сердечного ритма.
Материал и методы исследования. В работе использовано разработанное авторами оригинальное «Устройство для моделирования кровотока в области бифуркации магистральной артерии» (патент на полезную модель RU 216921 U1 от 09.03.2023 г.) [17].
В основе устройства параллелепипед из полимерного бесцветного стекла, вдоль длинной оси которого вырезана и отполирована изнутри цилиндрическая полость с внутренним диаметром 2 см, протяженностью 20 см. Цилиндрическая полость в дистальной области имеет разветвление под углом 60°, которое представляет собой две равнозначные цилиндрические полости, имеющие каждая внутренний диаметр 0,8 см и длину 12 см. С входного и выходного концов герметично к бруску с помощью винтовой резьбы с резиновыми прокладками прикреплены силиконовые трубки соответствующего отверстиям диаметра. Создается замкнутый контур с водяным насосом, обладающим различными режимами работы (ламинарный поток жидкости, переменный с имитацией правильного сердечного ритма и нарушений ритма – экстрасистолии или фибрилляции предсердий). Регулятор расхода жидкости позволяет количественно оценить перемещение жидкости в контуре. У входного конца большой цилиндрической полости расположен двухходовой штуцер, который позволяет при проведении эксперимента внутрь полости устройства вводить индикаторы и проводить изменение давления с помощью пьезокристаллического датчика давления. Замкнутый контур системы заполняется водным раствором глицерина с вязкостью, соответствующей цельной крови. При этом необходимый демпфирующий эластический эффект создается за счет силиконовых трубок, компенсирующий жесткость основной части устройства. Прозрачность применяемых материалов и сред позволяет сделать проводимые эксперименты максимально наглядными. Для имитации атеромы внутрь полостей герметично вводится пластиковая диафрагма со стенозом внутреннего отверстия 50%. Общий вид устройства представлен на рисунке 1.

Рис. 1. Устройство для моделирования кровотока в области бифуркации магистральной артерии» в работе: А - общий вид; Б - основная часть устройства
Условные обозначения: 1 – основной брусок в форме параллелепипеда из полимерного прозрачного стекла; 2 - продольная цилиндрическая полость, диаметром 20 мм, длиной 20 см (внутрь введен проводник с нитью); 3 - две равнозначные цилиндрические полости диаметром 8 мм, длиной 12 см каждая, расходящиеся под углом 60°; 4 – входной штуцер; 5 – приводящая силиконовая трубка; 6 – отводящие силиконовые трубки; 7 – пластиковые диафрагмы, имитирующие стенотические сужения атеросклеротического генеза; 8 – капроновая нить, введенная в области бифуркации.
Эксперимент заключался в следующем. Область бифуркации основной части устройства при проведении эксперимента находилась горизонтально. Контур был заполнен раствором глицерина таким образом, чтобы не оставалось воздушных полостей. Водяному насосу был задан режим работы с переменным потоком, имитирующий регулярный сердечный ритм с частотой 70 в минуту. С входного конца большой цилиндрической полости через клапан штуцера был установлен индикатор - черная капроновая нить длиной 2 см - таким образом, чтобы ее свободный конец при движении раствора глицерина находился в области разветвления основной полости на две другие равнозначные. Для контрастирования жидкости применяется краситель, который вводился периодически, по мере проведения эксперимента, также в область бифуркации. В один из двух малых цилиндров для имитации атеромы герметично была введена пластиковая диафрагма со стенозом внутреннего отверстия по диаметру 50%. В реальном артериальном сосуде в случае такого стеноза устья внутренней сонной артерии данная атерома считается гемодинамически не значимой. При прохождении пульсовых волн проводилось измерение давления внутри устройства, которое измерялось с помощью пьезокристаллического датчика давления с постоянной времени 1,3, и данные измерений передавались на осциллограф. Было проведено 40 измерений.
Вторая часть эксперимента проводилась аналогичным образом. Отличие заключалось в том, что водяному насосу был задан режим работы с переменным потоком, имитирующий раннюю экстрасистолическую аритмию, а именно тригеминию. При этом использовались также вышеописанные индикаторы (нить и краситель), и было проведено 40 измерений давления для регулярных пульсовых волн, экстрасистолической волны и первой постэкстрасистолической волны. Третья часть эксперимента проводилась аналогично. Водяному насосу был задан режим имитации брадисистолической формы ФП.
Результаты исследования и их обсуждение
Во время проведения второй и третьей части эксперимента, когда характер потока жидкости имитировал пульсовые волны при ЭС и брадисистолической ФП, авторы провели следующее наблюдение: механическое колебание свободного конца капроновой нити было более интенсивным при прохождении первой постэкстрасистолической волны и волны, следующей после длительной паузы между сокращением желудочков при ФП (табл.).
Смещение индикатора – нити – при имитации регулярной пульсовой волны, ЭС и ФП
|
Колебание индикатора – нити - относительно вертикальной плоскости, тип эксперимента |
Число экспериментов |
Q1 |
Медиана |
Q3 |
Среднее |
SD |
|
Колебание нити, регулярная волна, мм |
40 |
3,8 |
5,0 |
6,3 |
4,9 |
1,5 |
|
Колебание нити, 1-я постэкстрасистолическая волна, мм |
40 |
8,8 |
10,0 |
11,0 |
9,8 |
1,8 |
|
Колебание нити, брадисистолическая ФП, мм |
40 |
8,0 |
10,0 |
12,0 |
9,7 |
2,5 |
При этом более значительное механическое воздействие происходило непосредственно на проксимальную часть диафрагмы. При введении красителя внутрь цилиндров устройства визуализировался турбулентный характер потока жидкости при имитации ранней ЭС и брадисистолической ФП (рис. 2).
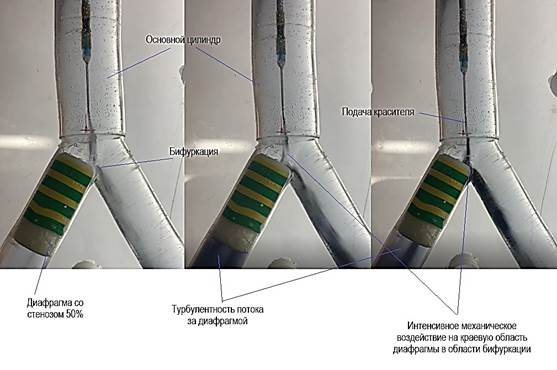
Рис. 2. Турбулентный поток жидкости за диафрагмой, интенсивное механическое воздействие гемодинамических факторов движения жидкости на краевые области диафрагмы
Датчик давления, введенный внутрь устройства сразу вслед за бифуркацией, при многократном повторении (40 раз) зарегистрировал возрастание давления в среднем на 60% - при «ранней» ЭС – с систолой желудочков ЭС до пика трансмитрального кровотока, и на 56% при брадисистолической ФП (рис. 3, 4).
Рис. 3. Соотношение давления (в %) по данным осциллоскопа при имитации правильного ритма и нарушений сердечного ритма (ЭС и ФП) в «Устройстве для моделирования кровотока в области бифуркации магистральной артерии» и установленной диафрагме в полость малого цилиндра со стенозом внутреннего отверстия 50% по диаметру
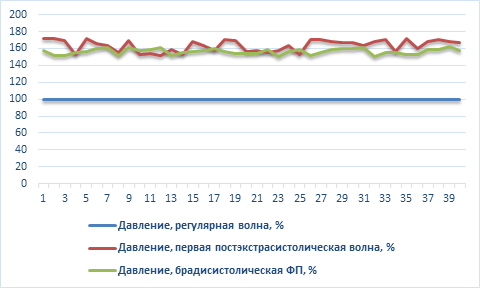
Рис. 4. Сводная диаграмма по данным статистического анализа изменения давления (в %) при экспериментах
Большинство применяемых до сих пор моделей кровообращения носит характер математических или компьютерных. Так, в работе Добросердовой Т.К., по данным разработанной автором математической модели, было показано, что наличие атером 50% и более приводят к развитию изменений в гемодинамике [18]. При этом рассматривался прямолинейно идущий сосуд, без деления его на ветви. Ранее авторами статьи было предложено «Устройство для моделирования внутриартериального кровообращения» (патент №222780) для физического моделирования процессов в артериальном сосуде, который не имеет ответвлений [19]. Были описаны особенности работы устройства, а также отмечены особые гемодинамические свойства волны первого постэкстрасистолического сокращения и волны после длительной паузы между сокращением желудочков при ФП, сопровождающиеся приростом давления и появлением турбулентности даже там, где атерома не достигла гемодинамической значимости по классическим критериям. Более того, авторы смогли показать распределение давления на атероме и объяснить, почему рост ее происходит против и по ходу кровотока, принимая во внимание то, что высокое давление – доказанный фактор развития и прогрессирования атеросклероза [20; 21]. Какие же закономерности происходят в случае, если имеется бифуркация магистральной артерии? Авторы полагают, что ранее выявленные закономерности также применимы и к артериальной бифуркации.
В данном исследовании использовалось «Устройство для моделирования кровотока в области бифуркации магистральной артерии», с помощью которого была произведена демонстрация более выраженного механического воздействия пульсовой волны при прохождении волны первого постэкстрасистолического сокращения или после длительной паузы при имитации ФП. При этом наибольшему механическому воздействию подвергалась краевая область бифуркации, а именно проксимальная краевая зона диафрагмы. В реальном артериальном сосуде самыми уязвимыми участками становятся пограничные области бляшки и интактного сосуда. Так, интактная область артерии сохраняет свои эластомоторные свойства, и при воздействии избыточного давления она способна демпфировать и сглаживать его колебания, расширяясь при прохождении увеличенной пульсовой волны. Область же сосуда с атеромой утрачивает такие свойства, являясь, по сути, инертной трубкой, не способной к растяжению. Когда одна часть артерии способна к растяжению, а другая – нет, создается дополнительное воздействие на пограничную зону за счет разницы эластических свойств. Многократно повторяющееся воздействие увеличенной пульсовой волной (например, при аллоритмиях, брадисистолической ФП) приводит к повышенной травматизации этой области, что способствует поддержанию хронического воспаления и прогрессированию роста бляшки. По мере достижения бляшкой гемодинамической значимости, рост ее начинает еще больше ускоряться, поскольку данные гемодинамические механизмы становятся определяющими и ведущими в патофизиологии на этом этапе. Гемодинамика бляшки поддерживает ее рост. В этом смысле «атерома строит саму себя». Вышеописанным механизмом в том числе может быть объяснена преимущественная локализация атером в области би- и трифуркаций артерий, по большому радиусу дуги аорты – именно тех частей артериальной сосудистой системы, которая подвержена избыточному механическому воздействию увеличенной пульсовой волны. Подтверждением существования данных механизмов также является опубликованная в 2023 г. работа коллектива авторов Zhao T.Y. и др., которые описали биомеханический флаттерный эффект при прохождении пульсовой волны как одну из основных причин возникновения аневризм аорты [22].
Выводы
1. Применение «Устройства для моделирования кровотока в области бифуркации магистральной артерии» целесообразно для изучения гемодинамики при проведении широкого спектра экспериментальных работ в области кардиологии, сердечно-сосудистой хирургии, патологической физиологии и биофизики с целью изучения внутриартериальной гемодинамики при различных ситуациях – в дополнении к клинической части работ.
2. С помощью «Устройства для моделирования кровотока в области бифуркации магистральной артерии» было показано, что при нарушениях сердечного ритма (ЭС и ФП) происходит более выраженное по сравнению с правильным ритмом механическое воздействие на стенку сосуда, особенно в местах бифуркаций, а также в случае наличия уже имеющейся атеросклеротической бляшки – в ее краевых зонах, особенно проксимальных.
Библиографическая ссылка
Германова О.А., Щукин Ю.В. ИЗУЧЕНИЕ ВНУТРИАРТЕРИАЛЬНОЙ ГЕМОДИНАМИКИ С ПРИМЕНЕНИЕМ ОРИГИНАЛЬНОГО «УСТРОЙСТВА ДЛЯ МОДЕЛИРОВАНИЯ КРОВОТОКА В ОБЛАСТИ БИФУРКАЦИИ МАГИСТРАЛЬНОЙ АРТЕРИИ» // Современные проблемы науки и образования. 2024. № 2. ;URL: https://science-education.ru/ru/article/view?id=33321 (дата обращения: 20.02.2026).
DOI: https://doi.org/10.17513/spno.33321



