Высокие дозы алкоголя оказывают влияние на структурное и функциональное состояние большинства систем организма в результате токсического действия этанола и его метаболитов. Продолжительное воздействие алкоголя на организм приводит к метаболическим, тканевым и адаптационным изменениям. Воздействие этанола вызывает дисбаланс в окислительно-восстановительных процессах, изменяет кислотно-щелочное равновесие и водно-солевой обмен, нарушает сосудистый тонус и микроциркуляцию, что в результате вызывает кардиотоксический эффект. Но наиболее выраженные деструктивные изменения при хроническом и остром отравлении алкоголем наблюдаются в клетках печени, так как именно в них идут процессы биотрансформации ксенобиотиков. Этанол и его метаболит ацетальдегид повышают проницаемость фосфолипидов мембран гепатоцитов, нарушают трансмембранный транспорт, функционирование клеточных рецепторов и мембраносвязанных ферментов, что индуцирует некроз гепатоцитов [1].
Основным результатом гомеостатического дисбаланса после алкогольной интоксикации является изменение активности тканевых и плазменных ферментов, причем увеличение активности тканевых ферментов в крови является показателем глубины деструктивных процессов в органах-мишенях токсического действия этанола.
Биохимическими маркерами алкогольной энзимопатии являются главным образом аспартатаминотранфераза (АСТ), аланинаминотрансфераза (АЛТ), гамма-глутамилтрансфераза (ГГТ) и щелочная фосфатаза (ЩФ). Лактатдегидрогеназа (ЛДГ) представляет собой неспецифический маркер цитолиза, отражающий нарушения целостности тканей, в том числе под действием этанола [2].
В настоящее время существует необходимость поиска новых методов детоксикации и минимизирования токсического действия этанола на клетки, ткани и системы органов. Одним из методов детоксикации является физиогемотерапия – она включает в себя физические методы, такие как ультрафиолетовое облучение, лазерное облучение, электромагнитное воздействие. В случае медикаментозной терапии острых отравлений недостатком является то, что лечебное действие соответствующих препаратов развивается лишь на 3–4-е сутки. Наиболее быструю стимуляцию ферментной активности и высокую эффективность обеспечивают физические методы [3].
Последние 20 лет активно изучаются биологические эффекты газоразрядной плазмы. К настоящему моменту источники, генерирующие плазму, применяются в дерматологии, косметологии, стоматологии, хирургии. Существуют сертифицированные приборы [4, 5].
В научных публикациях подтверждается, что газоразрядная плазма не оказывает повреждения тканей, стимулирует микроциркуляцию и обладает иммуномодулирующим эффектом. Установлено, что кратковременные экспозиции газоразрядной плазмы активируют общую антиоксидантную активность крови, что указывает на ее биорегуляторное действие [4, 5].
Поэтому предполагают, что источники, генерирующие плазму, могут использоваться в детоксикации отравлений этанолом, его суррогатами и другими токсическими веществами.
Цель работы – изучение профиля ферментов экспериментальных животных с моделью острой интоксикации этанолом и ее коррекция излучением плазмы искрового разряда.
Материалы и методы исследования
Лабораторные крысы на протяжении исследования находились в стандартных условиях вивария, все манипуляции и выведение животных из эксперимента осуществляли согласно Страсбургской Конвенции по защите позвоночных животных (Франция, 1986) и приказу Министерства здравоохранения РФ №267 от 19 июня 2003 г.
Белые беспородные крысы-самцы (n = 24, m = 275±30 г) были рандомно распределены по группам: первая группа (n = 6) – интактные животные без воздействия «И»; вторая группа (n = 6) – животные, обработанные излучением плазмы «ИП»; третья группа (n = 6) – животные с моделью острой интоксикации этанолом «Э»; четвертая группа (n = 6) – животные с моделью острой интоксикации этанолом, обработанные излучением плазмы «Э + ИП».
Модель острой алкогольной интоксикации создавали внутрибрюшинной однократной инъекцией 33 % водного раствора этанола в дозе ЛД50. Животным групп «И» и «ИП» вместо этанола в аналогичном объеме осуществляли инъекцию физиологического раствора.
В ранней токсикогенной фазе, после наступления наркотического эффекта этанола у животных, проводили обработку брюшной области крыс групп «ИП» и «Э + ИП» импульсным излучением плазмы искрового разряда в течение 600с на расстоянии 2см от поверхности кожи до электродов.
Импульсный генератор излучения плазмы искрового разряда имел технические характеристики: частота следования импульсов 10 Гц; энергия импульса 5,9х10-2Дж; длительность импульса 100мкс; длительность переднего фронта разряда50 нс; напряжение в разрядном промежутке 11кВ. Разрядный промежуток (3мм) – это область между электродами диаметром 2мм и длиной 15мм, которые выполнены из нержавеющей стали. Спектральный диапазон излучения плазмы искрового разряда от 200 до 800нм (λmax = 220нм) [6].
Через 24 ч после обработки животным внутрибрюшинно вводили гепарин и получали кровь для исследования. В плазме крови измеряли активность тканевых ферментов: аланин- (АЛТ) и аспартатаминотрансферазы (АСТ), гамма-глутамилтрансферазы (ГГТ), щелочной фосфатазы (ЩФ) и лактатдегидрогеназы (ЛДГ). Для исследований были использованы тест-наборы производства АО «ДИАКОН». Активность ферментов измеряли на спектрофотометре СФ-2000 (Россия, ОКБ Спектр) и на биохимическом анализаторе cs-t240 (Китай, Dirui Industrial Co., Ltd.).
Результаты исследования обработаны статистически. После проверки вариационных рядов на нормальность распределения использовали параметрическую описательную статистику. Данные представлены в виде средних значений и ошибки среднего значения. Различия между группами считали статистически значимыми при вероятности (р) меньше 0,05. Статистический анализ проведен в программе Statistiсa 10.0.
Результаты исследования и их обсуждение
Анализ активности ферментов в плазме крови интактных животных группы «ИП» после обработки излучением в течение 600с не выявил различий с группой интактных животных «И». Известно, что в норме активность тканевых ферментов низкая и ее повышение в крови выше пороговых значений свидетельствует о патологическом изменении проницаемости мембран клеток [2]. Таким образом, не выявлено системного повреждающего воздействия излучения газоразрядной плазмы на ткани животных, что подтверждается отсутствием увеличения уровня АСТ, АЛТ, ЛДГ, ГГТ в плазме крови (рис. 1–3).
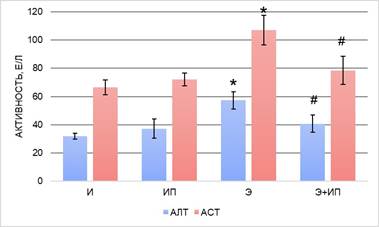
Рис. 1. Активность аланинаминотрансферазы и аспартатаминотрасферазы в плазме крови экспериментальных животных; * – различия по сравнению с группой «И» статистически значимы, р ≤ 0,05, # – различия по сравнению с группой «Э» статистически значимы, р ≤ 0,05
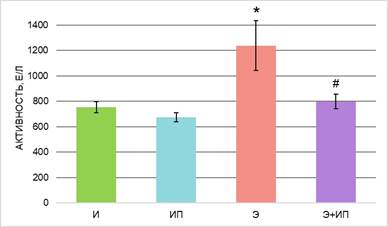
Рис. 2. Активность лактатдегидрогеназы в плазме крови экспериментальных животных; * – различия по сравнению с группой «И» статистически значимы, р ≤ 0,05, # – различия по сравнению с группой «Э» статистически значимы, р ≤ 0,05
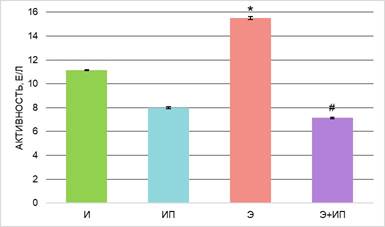
Рис. 3. Активность гамма-глутамилтрансферазы в плазме крови экспериментальных животных; * – различия по сравнению с группой «И» статистически значимы, р ≤ 0,05, # – различия по сравнению с группой «Э» статистически значимы, р ≤ 0,05
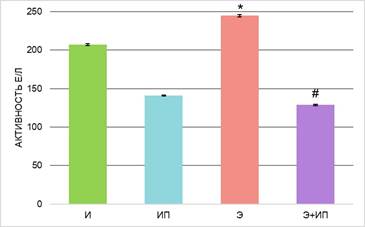
Рис. 4. Активность щелочной фосфатазы в плазме крови экспериментальных животных; * – различия по сравнению с группой «И» статистически значимы, р ≤ 0,05, # – различия по сравнению с группой «Э» статистически значимы, р ≤ 0,05
Выявлено статистически значимое снижение активности щелочной фосфатазы в 1,4 раза в плазме крови животных группы «ИП» после обработки излучением газоразрядной плазмы (рис. 4). По литературным данным, в норме активность щелочной фосфатазы в плазме крови крыс значительно варьирует ̶ 187±59,2 Е/л. Соответственно, выявленные изменения активности щелочной фосфатазы входят в значения референса.
Увеличение активности ферментов цитолиза в крови является надежным маркером развития острой алкогольной интоксикации. Суммарная активность изоформ ЛДГ является неспецифическим маркером, отражающим повреждение клеток и тканей внутренних органов. АСТ считается одним из ранних маркеров повреждения миокарда. АЛТ и ГГТ являются более специфичными маркерами заболеваний печени, ЩФ – маркер поражения гепатобилиарной системы [2].
В проведенном исследовании установлено, что в плазме крови животных с острой алкогольной интоксикацией (группа «Э») статистически значимо увеличилась активность АСТ и АЛТ – в 1,6 и 1,8 раз соответственно, ЛДГ в 1,6 раза, ГГТ в 1,4 раза, ЩФ в 1,2 раза в сравнении с интактными животными (рис. 1–4). Полученные результаты указывают на развитие токсической алкогольной гепатопатии и кардиомиопатии, в основе которых лежат дистрофические и некротические изменения тканей.
Далее была проведена оценка детоксикационного потенциала излучения плазмы искрового разряда в ранней токсикогенной фазе острого отравления этанолом. При исследовании ферментного профиля животных группы «Э+ИП» зарегистрированы значения активности ферментов ниже, чем у животных группы «Э», – АЛТ и АЛТ в 1,4 раза, ЛДГ в 1,6 раз, ГГТ в 2 раза, ЩФ в 1,9 раза. Активность ферментов после обработки животных с острой алкогольной интоксикацией импульсным излучением не имеет статистически значимых различий с группой интактных животных (группа «И») (рис. 1–4). Экспериментальные данные указывают на то, что изученная схема воздействия излучением газоразрядной плазмы, вероятно, снижает токсическое действие этанола и его метаболитов и предотвращает развитие дистрофических и некротических процессов в тканях.
Генерация газоразрядной плазмы и излучения газоразрядной плазмы приводит к формированию первичных и вторичных активных частиц. Первичные активные частицы, образующиеся непосредственно в разрядном промежутке при генерации искрового разряда между электродами, являются короткоживущими и взаимодействуют только с поверхностью объекта. А излучение плазмы разряда обладает способностью проникать на глубину 3 см в жидких средах и инициировать цепные реакции с образованием активных форм кислорода и азота [6].
Активные формы кислорода и азота, такие как HO2•, O• и N2O, образуются в первичных реакциях в водных растворах под действием излучения плазмы искрового разряда. Вторичными продуктами реакций являются NO2–, NO3– [7].
Также было установлено, что активные частицы могут диффундировать через кожу вглубь жидкости, но часть этих частиц погибает на поверхности кожи и в процессе диффузии [8].
В работах по исследованию механизмов биологического действия излучения газоразрядной плазмы было зарегистрировано, что при взаимодействии первичных частиц между собой образуется оксид азота NO• (4,28 × 10-9моль/л, t = 600с) [7]. Скорее всего, монооксид азота и обеспечивает детоксикационный эффект газоразрядной плазмы.
К настоящему моменту известно, что NO участвует в регуляции различных физиологических процессов: оказывает вазодилатирующий эффект, участвует в агрегации тромбоцитов и коагуляции плазмы, стимулирует ангиогенез и пролиферацию клеток, регулирует микроциркуляцию, влияет на проводимость нервных импульсов, обладает иммуномодулирующим, антиоксидантным и прооксидантным действием и др. [9].
При алкогольной интоксикации происходят нарушения в системе обмена глутатиона. Глутатион выполняет функцию антиоксидантной защиты организма [10]. Глутатион является не только кофактором глутатионпероксидазы, но также сам по себе способен неферментативно защищать клетки от свободных радикалов, являясь их ловушкой, благодаря наличию тиоловой группы. NO способствует сохранению запасов восстановленного глутатиона в печени [9]. Вероятно, радикалы азота, генерируемые плазмой, влияют на антиоксидантную систему организма.
Также оксид азота регулирует почечную гемодинамику, гломерулярную фильтрацию [9], оказывает ингибирующее действие на канальцевую реабсорбцию натрия, что приводит к усилению выведения воды и растворенных веществ с мочой. Вероятно, NO, генерируемый плазмой, ускоряет процесс элиминации этанола и его метаболитов из организма.
Заключение
По полученным экспериментальным данным можно заключить, что излучение плазмы искрового разряда не оказывает повреждающего действия на ткани организма интактных животных.
Применение излучения плазмы искрового разряда в ранней токсикогенной фазе приводит к снижению токсической нагрузки этанола и его метаболитов на организм экспериментальных животных.
Можно предположить, что излучение газоразрядной плазмы активирует собственные детоксикационные системы организма, вероятно, за счет влияния на антиоксидантную систему животных и ускорение процесса элиминации этанола и его метаболитов из организма. Излучение газоразрядной плазмы может быть рекомендовано для дальнейшего исследования биологических эффектов и механизмов действия как в системах in vitro, так и на уровне организма в целом.
Библиографическая ссылка
Трофимова С.В., Куприянова А.А., Шумилова А.М., Пискарёв И.М., Иванова И.П. ФЕРМЕНТНЫЙ ПРОФИЛЬ ЖИВОТНЫХ С ОСТРОЙ АЛКОГОЛЬНОЙ ИНТОКСИКАЦИЕЙ ПОСЛЕ КОРРЕКЦИИ ИЗЛУЧЕНИЕМ ГАЗОРАЗРЯДНОЙ ПЛАЗМЫ // Современные проблемы науки и образования. 2024. № 1. ;URL: https://science-education.ru/ru/article/view?id=33294 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.33294



