Ишемическая болезнь сердца (ИБС) по-прежнему занимает лидирующее место среди заболеваний сердца и сосудов, нередко приводя к летальным исходам. Известно, что в патогенезе ИБС важную роль играет атеросклероз коронарных артерий (КА) [1].
Морфологической основой развития атеросклероза является атеросклеротическая бляшка (АБ), которая может быть стабильной и нестабильной. Характер морфологических изменений в АБ зависит от многих патологических процессов, включающих липидную инфильтрацию стенок артерий, реактивные изменения со стороны моноцитов и макрофагов, лимфоцитов, гладких миоцитов, мелких кровеносных сосудов, в том числе питающих артериальную стенку (vasavasorum) [2].
Несомненно, в генезе развития нестабильной АБ большую роль играет внутренняя оболочка КА – интима и клетки эндотелия. С одной стороны, они принимают участие в процессах липоидоза, липосклероза, преимущественно за счет продуктов распада жирных кислот, холестерина, липопротеидов низкой плотности [2]. С другой стороны, эндотелиоциты КА выполняют роль клеточно-межклеточного барьера между интимой и кровью и содержат наряду с другими веществами важные для гемостаза гликопротеины – фактор Виллебранда (ФВ), CD31. Данные морфофункциональные изменения, возникающие при атеросклерозе КА с образованием тромбоцитарных, а впоследствии и тромбоцитарно-фибриновых тромбов, могут приводить к острой окклюзии артерий с развитием острой ишемии и инфаркта миокарда.
В настоящее время при острой ИБС активно выполняются операции стентирования КА, которые могут обеспечить полноценный артериальный кровоток. Предложены различные разновидности стентов, различающиеся по дизайну, свойствам, поколениям .Относительно качества стентов есть сведения, что их использование вкупе с лекарственным покрытием может служить профилактикой рестеноза. Кроме того, в настоящее время одобрены для использования различные биологически рассасывающиеся системы [3,4].
Известно, что после выполнения чрескожных вмешательств (ЧКВ) при острой ИБС могут возникать ранниеили поздние осложнения, среди которых наибольшее значение имеют тромбозы, рестенозы сосудов, неоатеросклероз. До настоящего времени ведутся дискуссии о сроках развития данных осложнений и их морфологических особенностях. Несомненно, что морфологические изменения в структуреАБ КА могутспособствовать развитию осложнений. При наличии нестабильной АБ в КА в ранние сроки после стентированиямогут возникнуть такие грозные осложнения, как тромбоз стента, расслоение интимы, однако данные вопросы в настоящее время мало изучены [5–7].
По мнению отдельных авторов, в местах стентирования КА последовательно возникают изменения, связанные с повреждением эндотелия, формированием тромба в местах повреждения интимы и развитием воспалительной реакции с последующей пролиферацией и миграцией гладкомышечных клеток (ГМК), формированием внеклеточного матрикса [8].
При имплантации стента в КА возникают повреждение клеток эндотелия артерий, растяжение средней оболочки, адвентиции, что сопровождается лизисом отдельных гладкомышечных клеток. Подобные морфологические процессы были описаны в отдельных экспериментальных работах на животных [6].
Кроме того, важную роль в гемостазе играет активация ФВ, содержащегося в разрушенных клетках эндотелия и тромбоцитах. Рецепторное взаимодействие ФВ и тромбоцитов осуществляется с помощью гликопротеинов, при этом повреждение клеток интимы способствует активации и адгезии тромбоцитов. После активации тромбоцитов тромбином или другими агонистами рецепторный гликопротеиновый комплекс становится способным связывать фибриноген, фибронектин, ФВ, что инициирует тромбообразование [9].
CD31 (PECAM-1) представляет собой гликопротеин из семейства иммуноглобулинов, который относится к молекулам межклеточной адгезии и экспрессируется эндотелиальными клетками сосудов. Данная молекула играет роль механосенсора, стабилизируя при этом структуру эндотелиальных клеток, принимает участие в трансмиграции лейкоцитов, моноцитов, ангиогенезе, активации интегринов [9, 10]. В доступной литературе не встретилось иммуногистохимических исследований на секционном материале, посвященных изучению маркеров эндотелиальной дисфункции в ранние сроки после стентирования.
В связи с этим целью исследования послужила иммуногистохимическая оценка ФВ, CD31в интиме КА в ранние сроки после стентирования.
Материал и методы исследования. Проведено морфологическое и иммуногистохимическое исследованиестентированных участков КА, полученных во время выполнения аутопсий у 22 пациентов после стентирования в ранние сроки (до 3 суток). Среди умерших было 8 мужчин и 14 женщин, средний возраст которых составил 68±6 лет. Из историй болезни умерших было известно, что больные поступали в кардиологическое отделение клиники Ростовского государственного медицинского университета с признаками нестабильной стенокардии (13 случаев), острого инфаркта миокарда (9 случаев). Причинами смерти больных в раннем послеоперационном периоде были: острая сердечная недостаточность (45%), отек легких (25%), нарушение ритма сердца (30%).
Исследование проведено в соответствии с Хельсинкской декларацией Всемирной медицинской ассоциации «Этические принципы проведения медицинских исследований с участием человека в качестве субъекта», Федеральным законом от 21.11.2011 №323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (пункт 4 статьи 67).
При вскрытии КА обращали внимание на топографию поражения, диаметр артерии, степень выраженности стеноза (в %), размеры АБ, наличие или отсутствие вторичных изменений АБ (тромбоз, кальциноз). Выделение, макроскопическое описание стентов КА выполнялись по запатентованной авторами методике [11]. Для гистологического, иммуногистохимического исследований вырезали участок КА в зоне стента.После фиксации в забуференном 10%-ном растворе нейтрального формалина (pH 7,4), обезвоживания в абсолютированном изопропиловом спирте,инфильтрации смесью парафина и орто-ксилола с использованием микроволнового гистопроцессора закрытого типа Logos (Milestone, Италия), заливки в парафин выполняли гистологические срезы на ротационном микротоме Leica RM2125 RTS (Leica Biosystems, Германия). Микропрепараты окрашивали гематоксилином-эозином.
Срезы толщиной 4 мкм помещали на предметные стекла с адгезивным покрытием (полилизин). Далее проводили их депарафинизацию и регидратацию по стандартной методике. Затем осуществляли подавление активности эндогенной пероксидазы с помощью 0,3%-ного раствора пероксида водорода. Инкубировали при комнатной температуре 10 минут. Промывали в буфере.На следующем этапе блокировали неспецифическое связывание с помощью раствора Proteinblock (фосфатный буфер pH 7,6 содержащий 0,5% БСА и 0,5% казеин) инкубировали при комнатной температуре 10 минут, промывали в буфере в течение получаса. Инкубировали срезы с первичными антителами при комнатной температуре в течение часа, трижды промывали фосфатно-солевым буфером в течение трех минут, инкубировали с вторичными антиполивалентными биотинилированными кроличьими и мышиными антителами (Cell Marque, США) в течение 10 минут (табл. 1). Микроскопию и микрофотографирование осуществляли на микроскопе Leica DM 1000 (Leica Mycrosystems, Германия) со встроенной фотокамерой. Оценку иммуногистохимических реакций проводили с помощью полуколичественного метода (+слабая экспрессия, ++ умереннаяэкспрессия, +++ выраженная экспрессия).
Таблица 1
Используемые антитела
|
Название антитела |
Производитель (фирма) |
Клон |
Происхождение антитела |
Разведение |
|
CD31 |
CellMarque |
клон JC70 |
Mousemoclonal antibody |
rtu |
|
Фактор Виллебранда |
Cell Marque |
factor VIII-R Ag |
rabbit polyclonal antibody |
rtu |
Результаты исследования и их обсуждение
При гистологическом исследовании в зоне локализации стентов КА были выявлены следующие изменения. Интима КА была неравномерно утолщена за счет накопления в ней липидов, пенистых макрофагов, умеренной лимфоцитарной инфильтрации. На поверхности интимы имелись мелкие агрегаты эритроцитов (рис.1). Данные изменения в КА указывали на наличие нестабильной АБ КА.
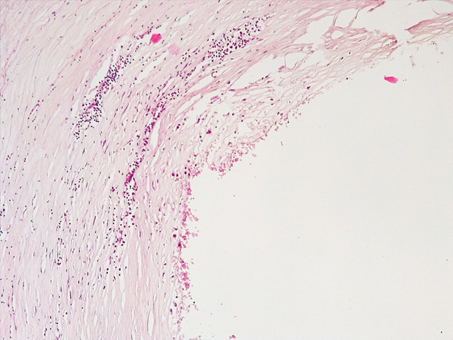
Рис.1. Нестабильная АБ коронарной артерии сердца в зоне стента: скопление липидов, пенистых макрофагов в интиме, умеренная лимфоцитарная инфильтрация стенок, агрегаты эритроцитов.Окраска гематоксилином-эозином. Увеличение х200
При иммуногистохимическом исследовании зоны стентов КА имелись особенности экспрессии белка фактора Виллебранда (ФВ). На поверхности интимы КА отмечалась линейно-сетчатая экспрессия ФВ, яркая, умеренная и резковыраженная (++/+++) (рис.2). На всем протяжении в других стенках КА признаков экспрессии ФВ выявлено не было.
Ярковыраженная линейная экпрессия ФВ в интиме КА в зоне стента указывала на экспрессию тромбоцитов в отдельных участках с формированием пристеночного тромбоцитарного тромба, в то же время в остальных клетках экспрессия не наблюдалась (рис.3).
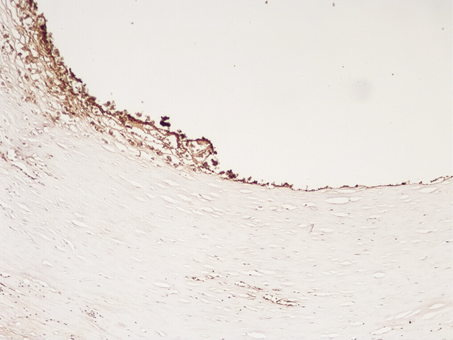
Рис. 2. Экспрессия ФВ в эндотелиальных клетках интимы КА в зоне стента. Иммуногистохимическая реакция. Увеличение х200
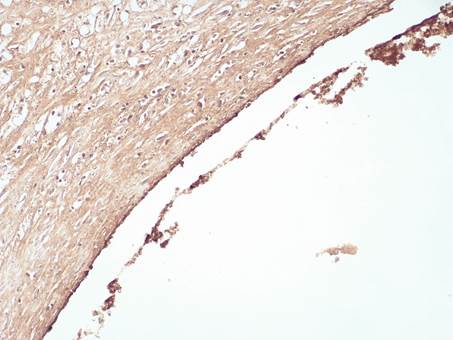
Рис. 3. Яркая линейная экспрессия ФВ в клетках эндотелия интимы, тромбоцитах КА с образованием пристеночного тромба в зоне стента. Иммуногистохимическая реакция. Увеличение х200
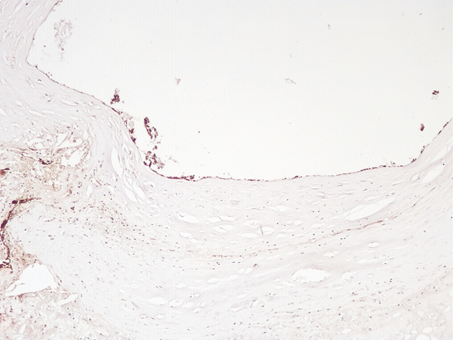
Рис. 4. Слабая экспрессия CD31 в клетках эндотелия интимы в зоне стента. Иммуногистохимическая реакция. Увеличение х200
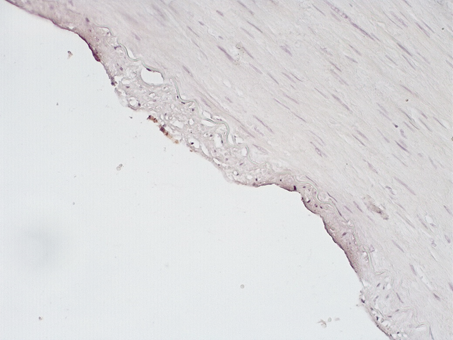
Рис. 5. Слабая экспрессия CD31в единичных клетках эндотелия в зоне стента. Иммуногистохимическая реакция. Увеличение х200
Экспрессия белка CD31 в интиме КА в местах стентов была слабовыраженной и очаговой. При этом встречались немногочисленные эндотелиальные клетки, сохранявшие экспрессию белка, в остальных клетках реакция была негативной (рис.4,5).
Проведенное морфологическое исследование интимы КА в ранние сроки (в течение 3 суток) после выполнения стентирующих операций выявило ряд особенностей. Было показано, что рутинное гистологическое исследование с окраской гематоксилином-эозином КА в области стентов не позволяет достоверно оценить степень повреждения клеток эндотелия, тромбоцитов, а значит, высказать суждение о наличии тромбоцитарного тромба.
Тонкие структурные изменения системы гемостаза, в частности сосудисто-тромбоцитарного звена, позволяет выявить иммуногистохимическое исследование. Было показано, что в первые 3 суток после стентирующих операций в интиме КА в области стентов отмечалась яркая, резковыраженная экспрессия ФВ, которая имела линейный и линейно-сетчатый вид. Экспрессия белка CD31 в эндотелиальных клетках была слабовыраженной, местами совсем отсутствовала.
Учитывая диссоциацию в экспрессии эндотелиального маркера CD31 и ФВ на поверхности интимы, можно думать о том, что после стентирования эндотелиальные клетки на большем протяжении повреждены и десквамированы, а яркая экспрессия ФВ говорит о массивной адгезии тромбоцитов в зоне имплантации стентов.
Принимая во внимание, что ФВ экспрессируется клетками эндотелия и тромбоцитами, в то время как CD31 экспрессируется клетками эндотелия, можно полагать, что в ранние сроки после стентирующих операций КА при ИБС наблюдается дисрегуляция эндотелиально-тромбоцитарного звена гемостаза, обусловленная, по-видимому, повреждением клеток эндотелия. Экспрессия ФВ и связанная с ней активация тромбоцитарного звена гемостаза в первые дни после стентирования могут указывать на возможную секреторную активность тромбоцитов, которые в дальнейшем принимают участие в образовании и развитии тромбоцитарного тромба.
Можно полагать, что изучение экспрессии ФВ и CD31 в ранние сроки после стентирующих операций КА при острой ИБС позволит уточнить риски тромбообразования у данных пациентов.
Заключение
Представленное иммуногистохимическое исследование интимы КА в ранние сроки после стентирующих операций позволяет по-новому взглянуть на морфогенез послеоперационных осложнений. Экспрессия белка фактора Виллебранда (ФВ) винтиме КА, тромбоцитах, а также в местах формирования тромбоцитарных тромбов может служить предиктором нарушений гемостазав раннем периоде после операций стентирования. Однако денудация интимы, гипоэкспрессия белка CD31, являющегося интегральной адгезивной молекулой, могут указывать на нарушение процессов первичного сосудисто-тромбоцитарного гемостаза, что может иметь важное значение в прогнозировании ранних нарушений кровообращения.
Библиографическая ссылка
Тодоров С.С., Дерибас В.Ю., Казьмин А.С., Тодоров С.С. ИММУНОГИСТОХИМИЧЕСКАЯ ОЦЕНКА ФАКТОРА ВИЛЛЕБРАНДА И СD31 В ИНТИМЕ КОРОНАРНЫХ АРТЕРИЙ В РАННИЕ СРОКИ ПОСЛЕ СТЕНТИРОВАНИЯ // Современные проблемы науки и образования. 2024. № 1. ;URL: https://science-education.ru/ru/article/view?id=33277 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.33277



