Легочная гипертензия (ЛГ) – это заболевание, которое характеризуется прогрессирующим повышением легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии (ДЛА), что, в свою очередь, приводит к нарушению функции правого желудочка, сердечной недостаточности и преждевременной смерти пациентов [1–3].
Согласно классификации, принятой на VIВсемирном симпозиуме по ЛГ (WSPH 6), выделяют 5 клинических групп легочной гипертензии (табл. 1) [2].
Таблица 1
Классификация легочной гипертензии [1, 2]
|
Группа WSPH |
Описание |
|
Группа 1 |
Легочная артериальная гипертензия |
|
Группа 2 |
ЛГ, связанная с патологией левых камер сердца |
|
Группа 3 |
ЛГ, связанная с патологией легких и/или гипоксией |
|
Группа 4 |
ЛГ из-за обструкции легочной артерии |
|
Группа 5 |
ЛГ с неясными и/или многофакторными механизмами заболевания |
Они объединены по принципу общности патофизиологических механизмов, гемодинамических характеристик и подходов к лечению. Среди выделенных групп относительно редкой и быстро прогрессирующей формой с крайне ограниченным числом терапевтических опций является легочная артериальная гипертензия (группа 1) [2, 4].
Легочная артериальная гипертензия (ЛАГ) характеризуется структурными изменениями артерий и артериол малого круга кровообращения, а также серьезными гемодинамическими нарушениями, такими как повышение среднего давления в легочной артерии ≥25 мм рт. ст. и увеличение легочного сосудистого сопротивления ≥3 ед. Вуда [1, 5]. На ранних этапах заболевание сопровождается рядом неспецифических симптомов, таких как одышка во время физической нагрузки, утомляемость, отеки, боль в груди и синкопальные состояния, что значительно удлиняет время постановки диагноза и назначения специфической терапии. Прогрессирование ЛАГ приводит к снижению качества жизни, частым госпитализациям и, в конечном итоге, летальному исходу вследствие прогрессирования правожелудочковой сердечной недостаточности [6–8].
Группа легочной артериальной гипертензии, в свою очередь, включает в себя 7 подгрупп: идиопатическая ЛАГ (ИЛАГ) (с положительным и отрицательным тестом на вазореактивность [3]); наследственная ЛАГ; ЛАГ, индуцированная приемом лекарственных препаратов и токсинов; ассоциированные формы ЛАГ; ЛАГ с явными чертами веноокклюзионной болезни / гемангиоматоза легочных капилляров; персистирующая ЛГ новорожденных [9].
ЛАГ является орфанным заболеванием. В экономически развитых странах заболеваемость и распространенность ЛАГ составляют 6 и 48–55 случаев на миллион взрослого населения соответственно [3]. ИЛАГ, наследственная ЛАГ и анорексиген-индуцированная ЛАГ составляют 52,6% всех случаев [10, 11]. Средний возраст установления диагноза ИЛАГ в Российской Федерации – 45,2±14,9 года [12]. В регистре Национального института здоровья США (National Institutes of Health, NIH) средний возраст пациентов с ИЛАГ на момент постановки диагноза составил 35±15 лет при соотношении женщин и мужчин 1,7:1 [13]. В настоящее время считается, что в молодом возрасте встречается преимущественно наследственная ЛАГ, которая поражает женщин в 2 раза чаще, чем мужчин. Согласно данным регистра Национального Института Здравоохранения (NIH), расчетная выживаемость пациентов с ИЛАГ до появления ЛАГ-специфических препаратов составляла 48% к третьему году. С появлением современных лекарственных препаратов было достигнуто существенное увеличение данного показателя (74,5, 64,5 и 58,9% к третьему, пятому и седьмому году соответственно) [14].
В настоящее время в клиническую практику внедрены лекарственные препараты, доказавшие свою эффективность и безопасность в лечении пациентов с ЛАГ. Они оказывают воздействие на различные патогенетические механизмы развития заболевания. К ЛАГ-специфическим препаратам относятся аналоги простациклина, антагонисты рецепторов эндотелина, ингибиторы фосфодиэстеразы типа 5, стимулятор растворимой гуанилатциклазы и селективный агонист простациклиновых (IP) рецепторов [1, 3, 7]. Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрено 12 препаратов для терапии ЛАГ, 8 из которых зарегистрировано на территории РФ.
Современная стратегия терапии ЛАГ заключается в достижении и поддержании профиля низкого риска у пациентов [9]. Согласно принятому алгоритму лечения, для пациентов с «классической ЛАГ» (молодые пациенты без коморбидной сердечно-легочной патологии) с низким или промежуточным риском летальности рекомендуется стартовая двойная или тройная терапия, тогда как начальная монотерапия показана только возрастным пациентам с тяжелыми сопутствующими заболеваниями. Одним из ключевых аспектов достижения терапевтической цели являются регулярная оценка профиля риска и своевременная эскалация лекарственной терапии [9].
В данной статье описан клинический случай пациентки с ИЛАГ, на примере которого прослеживается длительный путь эволюции лекарственной терапии ЛАГ от симптоматического лечения до различных схем комбинированной таргетной терапии в реальной клинической практике, сопровождающийся регулярной оценкой эффективности и безопасности проводимого лечения.
Клинический случай
Пациентка И., 1982 года рождения, наблюдается в течение 24 лет с диагнозом «Идиопатическая легочная артериальная гипертензия, недостаточность трикуспидального клапана 2–3-й степени, ХСН 2А, ФК III». Из анамнеза заболевания известно, что с младенческого возраста пациентка страдала частыми респираторными заболеваниями и бронхитами. В возрасте 10 лет стала отмечать появление одышки и головокружения при физических нагрузках. В возрасте 16 лет пациентка впервые была консультирована кардиологом по месту жительства в связи с усилением одышки, появлением эпизодов потери сознания на фоне интенсивной физической нагрузки. По данным трансторакальной эхокардиографии (ЭхоКГ) был заподозрен врожденный порок сердца (дефект межпредсердной перегородки). С целью уточнения диагноза пациентка была направлена в кардиохирургическое отделение. По данным проведенного обследования диагноз врожденного порока сердца был исключен, однако при чрезвенозной катетеризации правых отделов сердца выявлено повышение давления в легочной артерии до 103/38 (44) мм рт. ст. Таким образом, в возрасте 16 лет пациентке впервые был установлен диагноз первичной легочной гипертензии. С целью улучшения клинического состояния была рекомендована следующая терапия: нифедипин 10 мг 3 раза в сутки, эуфиллин 0,15г 3 раза в сутки, гидрохлортиазид + триамтерен 12,5 мг + 25 мг 1 раз в сутки. На фоне проводимого лечения сохранялась одышка при физической нагрузке, которая постепенно прогрессировала вплоть до одышки при самообслуживании.
Спустя 6 лет после постановки диагноза (в 2005 г.) пациентка была направлена в ФГУ НИИПК им. ак. Е.Н. Мешалкина (г. Новосибирск), где было проведено комплексное клинико-функциональное обследование. При поступлении пациентка предъявляла жалобы на одышку при минимальной физической нагрузке, подъеме по лестнице на 2-й этаж, головокружение, выраженную общую слабость. Кроме того, периодически на фоне физической нагрузки возникали предсинкопальные состояния и обмороки длительностью несколько секунд. При объективном осмотре телосложение астеничное (рост 167 см, вес 47 кг), развитие мускулатуры слабое, что обусловлено малоподвижным образом жизни вследствие выраженности симптомов ЛГ. Кожные покровы с бледным оттенком, цианоз губ, носогубного треугольника, пальцев рук. При аускультации сердца тоны ритмичные, определяются акцент II тона над легочной артерией, что свидетельствует о повышении давления в системе малого круга кровообращения, а также выраженный пансистолический шум трикуспидальной недостаточности с эпицентром в точке Боткина. В легких дыхание везикулярное с жестким оттенком. Периферических отеков не выявлено. ЧСС 50 в минуту, АД – 100/55 мм рт. ст. Результат теста 6-минутной ходьбы (Т6МХ) составил 160 м (насыщение капиллярной крови кислородом после теста снизилось до 93%, исходно – 97%). По данным лабораторных методов исследования значимых отклонений от нормы не выявлено. По данным электрокардиограммы (ЭКГ) – синусовая брадикардия, признаки неполной блокады правой ножки пучка Гиса (НБПНПГ). На обзорной рентгенограмме легких – усиление сосудистого рисунка, расширение тени легочной артерии, кардиоторакальный индекс 55%. По результатам ЭхоКГ отмечались признаки прогрессирования правожелудочковой недостаточности в связи с увеличением постнагрузки ПЖ. Регистрировались расширение правых отделов сердца (правое предсердие (ПП) – 4,2 х 4,6 см), трикуспидальная регургитация 2-й степени, расширение легочной артерии, систолическое давление в легочной артерии (СДЛА) – 65 мм рт. ст. Фракция выброса левого желудочка сердца (ФВлж) сохранялась в пределах нормальных значений (76%). По данным чрезвенозной катетеризации правых отделов сердца сохранялось повышение давления в легочной артерии до 77/49 (61) мм рт. cт., ЛСС до 10,8 ед. Вуда. Давление заклинивания легочной артерии (ДЗЛА) составило 5 мм рт. ст., сердечный индекс (СИ) – 2,6 л/мин/м2. Тест на вазореактивность с NO отрицательный. Специалистами НИИПК рекомендована терапия силденафилом по 25 мг 3 раза в сутки. В качестве сопутствующей терапии назначены дилтиазем 120 мг в сутки, теофиллин 200 мг 3 раза в сутки, периндоприл 4 мг в сутки. На фоне данной терапии клиническое состояние пациентки ухудшалось, о чем свидетельствовали постепенное прогрессирование одышки, эпизоды потери сознания на фоне физической нагрузки.
В 2009 г. в возрасте 27 лет пациентка была госпитализирована в НЦ ССХ им. А.Н. Бакулева (г. Москва). При поступлении состояние пациентки тяжелое. Сохранялись жалобы на выраженную одышку, цианоз губ и носогубного треугольника при минимальной физической нагрузке, головокружение, ощущение перебоев в работе сердца, синкопальные эпизоды до нескольких раз в неделю. На ЭКГ ритм синусовый с ЧСС 80 в минуту, признаки гипертрофии правых отделов сердца, НБПНПГ. По результатам ЭхоКГ наблюдались дилатация правых камер сердца (ПП – 4,9 х 6,5 см, размер ПЖ – 4,9 см), расширение левой легочной артерии (ЛЛА) до 2,4 см, правой легочной артерии (ПЛА) до 2,7 см, выраженная недостаточность трикуспидального клапана (диаметр фиброзного кольца – 2,9 см), повышение СДЛА до 85 мм рт. ст., снижение ФВлж до 48%. По результатам чрезвенозной катетеризации правых отделов сердца в динамике отмечалось повышение давления в легочной артерии до 110 /44 (71) мм рт. ст., ЛСС до 11,8 ед. Вуда, ДЗЛА сохранялось на уровне 5 мм рт. ст., СИ – 2,4 л/мин/м2.
С учетом прогрессирования сердечной недостаточности, неэффективности медикаментозной терапии с целью декомпрессии правого желудочка и стабилизации гемодинамики выполнена операция: атриосептостомия со стентированием межпредсердной перегородки. В послеоперационном периоде отмечались кратковременное улучшение самочувствия пациентки, некоторое субъективное уменьшение выраженности одышки.
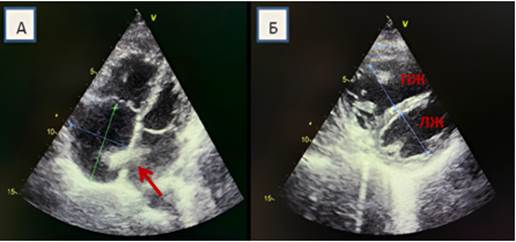 |
Насыщение капиллярной крови кислородом снизилось до 92%. По данным ЭКГ ритм синусовый с ЧСС 68 в минуту, признаки перегрузки правых отделов сердца. При контрольной ЭхоКГ – размеры левых отделов сердца в пределах нормы, ФВ ЛЖ – 60%, СДЛА 70 мм рт. ст., трикуспидальная регургитация 1–2-й степени, жидкости в полости перикарда не выявлено, в позиции межпредсердной перегородки лоцируется стент, с наличием право-левого сброса (рис. 1).
Рис. 1. Результаты ЭхоКГ пациентки И. А – Четырехкамерная позиция. Дилатация правых камер сердца (синей и зеленой стрелками указаны размеры ПП). Стент в позиции межпредсердной перегородки (указан красной стрелкой); Б – Модифицированная позиция. Соотношение правого и левого желудочков. Дилатация правого желудочка. Компрессия левого желудочка сердца
После оперативного лечения с учетом высокого риска тромбообразования в месте имплантированного стента к терапии был добавлен варфарин 5 мг 1 раз в сутки (целевой уровень МНО 2,0–2,4), рекомендовано продолжение приема силденафила 25 мг 3–4 раза в сутки, дилтиазема 120 мг 1 раз в сутки. Кроме того, пациентке был назначен бозентан по 62,5 мг 2 раза в сутки с последующим увеличением дозы до 125 мг х 2 раза в сутки через 1 месяц. Во время приема бозентана пациентка отмечала появление побочных эффектов в виде головных болей, тошноты, рвоты. Толерантность к физической нагрузке на фоне лечения не увеличилась, в связи с чем пациентка от приема препарата отказалась.
В 2011 г. в возрасте 29 лет пациентка в плановом порядке госпитализирована во ФГУ НИИПК им. ак. Е.Н. Мешалкина (г. Новосибирск) для проведения контрольного обследования. При поступлении состояние тяжелое. Сохраняются жалобы на выраженную одышку при незначительных физических нагрузках, головокружение, синкопальные состояния (до нескольких раз в месяц), отмечается появление отеков на нижних конечностях максимально до уровня средней трети голеней. Объективно кожные покровы несколько цианотичны. АД 105/65 мм рт. ст., ЧСС 88 в минуту. По данным ЭКГ, рентгенографии органов грудной клетки – без отрицательной динамики в сравнении с результатами предыдущих исследований. По ЭхоКГ – увеличение правых отделов сердца (ПП – 5,0 х 5,2 см, КДРпж – 3,3 см, ФИПпж – 35%, толщина миокарда правого желудочка 0,8 см), трикуспидальная регургитация 2–3-й степени (площадь цветного потока регургитации 35–40% от площади ПП), СДЛА – 88 мм рт. ст. ЛП – 3,5 х 3,9 см, КДРлж – 3,3 см, КСРлж – 2,1 см, ФВлж – 70%, признаки небольшого количества жидкости в полости перикарда. Рекомендовано продолжить прием силденафила 25 мг 4 раза в сутки, дилтиазема 120 мг в сутки, варфарина 6,25 мг в сутки, спиронолактона 25 мг 2 раза в сутки.
На фоне проводимой медикаментозной терапии состояние пациентки оставалось тяжелым, сохранялись симптомы сердечной недостаточности, синкопальные эпизоды на фоне физической нагрузки, отеки на нижних конечностях. С целью проведения комплексного обследования и определения дальнейшей тактики лечения пациентка была госпитализирована в Медицинский центр «Хадасса» (Иерусалим). По данным ЭхоКГ отмечалась дилатация правых отделов сердца и легочной артерии, СДЛА 78 мм рт. ст. Результат Т6МХ – 120 м (насыщение капиллярной крови кислородом после теста снизилось до 82%, исходно – 95%). По данным чрезвенозной катетеризации правых отделов сердца давление в ЛА было повышено до 94/50 (65) мм рт. ст., ДЗЛА – 6 мм рт. ст., СИ – 1,8 л/мин/м2, ЛСС – 13,1 ед. Вуда. С целью стабилизации состояния и купирования выраженной ЛГ проведено курсовое лечение эпопростенолом внутривенно до 30 мкг в час. На фоне лечения эпопростенолом отмечалось клинико-функциональное улучшение. Учитывая тот факт, что внутривенные и подкожные формы простаноидов не зарегистрированы в Российской Федерации, было рекомендовано перейти на ингаляции илопроста по 2,5 мкг до 5 ингаляций в день. На фоне терапии отмечались усиление одышки, появление хрипов в легких. Произведена попытка снижения количества ингаляций до 3 в день, однако это не привело к улучшению состояния, в связи с чем препарат был отменен. В качестве альтернативных вариантов лечения ЛГ было рекомендовано увеличить дозу силденафила до максимальной (240 мг в сутки), возобновить прием бозентана или амбризентана в качестве дополнительного лечения.
При приеме бозентана в дозе 62,5 мг 2 раза в сутки нежелательных явлений не возникало. Артериальное давление сохранялось на уровне 90–100/60 мм рт. ст., повышения уровня печеночных трансаминаз по данным лабораторных методов исследования не отмечалось. Кроме того, пациентка продолжала прием силденафила 25 мг 3 раза в сутки, варфарина 3,75 мг 1 раз в сутки (МНО – 2,0), спиронолактона 25 мг 1 раз в сутки. Несмотря на проводимое лечение, состояние пациентки оставалось тяжелым, в связи с чем было предложено рассмотреть вопрос о возможной трансплантации легких. От данного вида лечения пациентка категорически отказалась. В последующие 2 года проводилось динамическое наблюдение по месту жительства.
В 2014 г. в возрасте 32 лет пациентка вновь была консультирована в ФГУ НИИПК им. ак. Е.Н. Мешалкина (г. Новосибирск). Учитывая тот факт, что состояние пациентки, несмотря на проводимое лечение, оставалось тяжелым, специалистами центра была рекомендована эскалация ЛАГ-специфической терапии. Произведена повторная попытка инициации лечения илопростом, однако на фоне терапии вновь отмечалось значительное усиление одышки, в связи с чем препарат был отменен. Кроме того, проведена замена бозентана на амбризентан в дозировке 10 мг в сутки, продолжена терапия силденафилом 25 мг 3 раза в сутки. В качестве сопутствующей терапии назначен торасемид 2,5 мг 1 раз в сутки, продолжен прием спиронолактона 25 мг в сутки, варфарина 4,375 мг 1 раз в сутки (МНО – 2,2). На фоне данной схемы лечения ЛГ состояние пациентки несколько улучшилось, увеличилась толерантность к физической нагрузке (Т6МХ – 170 м), уменьшились отеки (возникали преимущественно в вечернее время, достигали уровня нижней трети голеней).
В течение следующего года (в зимние месяцы) пациентка отметила ухудшение самочувствия – появление приступообразного кашля с отхождением мокроты со сгустками алой крови, давящих болей за грудиной длительностью до 5–7 минут. По данным контрольной ЭхоКГ СДЛА сохранялось на уровне 80 мм рт. ст., отмечались расширение правых отделов сердца и ствола легочной артерии, наличие небольшого количества жидкости в полости перикарда.
Учитывая тяжесть состояния, была проведена оптимизация терапии в виде замены силденафила на риоцигуат [15] в комбинации с амбризентаном 10 мг 1 раз в сутки. Через 24 часа после прекращения приема силденафила была начата титрация риоцигуата, начиная с дозы 1 мг 3 раза в сутки под контролем артериального давления. Переносимость в ходе дальнейшей титрации оставалась удовлетворительной, побочных явлений не отмечалось. В результате была достигнута целевая доза – 2,5 мг 3 раза в сутки. На фоне двойной ЛАГ-специфической терапии состояние пациентки субъективно улучшилось. Кроме того, была проведена коррекция антикоагулянтной терапии в виде перевода пациентки с приема варфарина на прием прямых оральных антикоагулянтов (ривароксабан 15 мг 1 раз в сутки).
В 2018 г. в возрасте 36 лет пациентка поступила на контрольное обследование в НМИЦ им.ак. Е.Н. Мешалкина (г. Новосибирск). На момент госпитализации пациентка отмечала сохранение одышки при умеренных физических нагрузках, головокружения, общей слабости. После начала терапии риоцигуатом синкопальные эпизоды возникали не чаще 1 раза в год. По результатам лабораторных методов исследования значимых отклонений не выявлено. BNP – 59,4 нг/л. По данным ЭКГ – синусовая брадикардия с ЧСС 47 в минуту, НБПНПГ. По данным рентгенографии органов грудной клетки определяются признаки высокой легочной гипертензии: легочный сосудистый рисунок усилен, расширен ствол ЛА. По данным ЭхоКГ: ЛП – 3,8 х 5,15 см, ФВлж – 70%, ПП – 4,2 х 5,4 см, площадь ПП – 20,9 см2, ФИП – 31%, движение межжелудочковой перегородки парадоксальное, трикуспидальная регургитация 2-й степени, СДЛА – 67 мм рт. ст., TAPSE – 16 мм, диаметр ствола ЛА – 4,0 см, в проекции МПП определяется стент. При чрезвенозной катетеризации правых отделов сердца давление в ЛА сохранялось на уровне 98/54 (62) мм рт. ст., отмечалось уменьшение ЛСС до 11,0 ед. Вуда, некоторое снижение в динамике СИ (2,0 л/мин/м2). ДЗЛА составило 11мм рт. ст. По итогам комплексного обследования проведена стратификация риска в соответствии с действующими клиническими рекомендациями. Учитывая полученные данные обследования, пациентка была отнесена в группу промежуточного риска, в связи с чем было принято решение о необходимости оптимизации терапии. Рекомендовано заменить амбризентан на мацитентан 10 мг 1 раз в день и продолжить прием риоцигуата 2,5 мг 3 раза в сутки. После коррекции терапии в течение нескольких месяцев состояние пациентки было относительно удовлетворительным. Сохранялась одышка при умеренной физической нагрузке. При динамическом наблюдении результаты Т6МХ оставались в пределах 170–180 м.
В 2020 г. в возрасте 38 лет пациентка вновь прошла комплексное обследование, по результатам которого была проведена оценка стратификации риска. На фоне двойной ЛАГ-специфической терапии пациентка по-прежнему оставалась в группе промежуточного риска, в связи с чем было принято решение о переводе пациентки на тройную ЛАГ-специфическую терапию с добавлением селективного агониста IP-рецепторов простациклина – селексипага. Проводилась титрация дозы препарата, начиная с 200 мкг 2 раза в сутки с еженедельным повышением на 200 мкг (рис. 2).
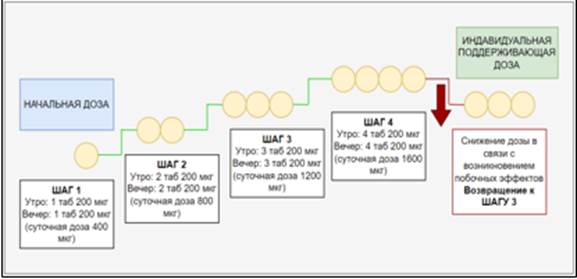
Рис. 2. Схема титрации препарата Селексипаг у пациентки И.
При приеме селексипага у пациентки развился ринит, наблюдались типичные побочные эффекты, характерные для препаратов пути простациклина, такие как тошнота, рвота и диарея.
В ходе титрации была достигнута доза 800 мкг 2раза в сутки. Ввиду сохранения побочных эффектов и неэффективности симптоматической терапии, направленной на их купирование, индивидуальная поддерживающая доза была уменьшена до 600 мкг 2 раза в сутки. На фоне снижения дозы селексипага побочные явления исчезли, доза 600 мкг х 2 раза в сутки была определена в качестве индивидуальной поддерживающей дозы. Помимо селексипага, пациентка продолжила прием мацитентана по 10 мг 1 раз в сутки, риоцигуата по 2,5 мг 3 раза в сутки, ривароксабана 15 мг в сутки, спиронолактона 25 мг 1 раз в сутки. Субъективно на фоне терапии самочувствие улучшилось, выраженность одышки уменьшилась. При динамическом наблюдении по данным ЭхоКГ отмечались снижение СДЛА до 62 мм рт. ст., уменьшение площади ПП до 18,2 см2. ФИП составило 45%, ТAPSE – 21 мм. Признаков жидкости в полости перикарда выявлено не было. Дистанция Т6МХ составила 190 м, одышка по шкале Борга – 4 балла, насыщение капиллярной крови кислородом после нагрузки – 95% (исходно 96%).
Через полгода пациентка отметила усиление одышки, появление приступообразного сухого кашля, выраженной общей слабости, появление болей вмышцах, исчезновение обоняния, повышение температуры тела в пределах субфебрильных значений. По данным лабораторных методов исследования отмечались признаки анемии легкой степени тяжести (гемоглобин 105 г/л), признаков воспалительных изменений выявлено не было. Вамбулаторных условиях пациентке была проведена мультиспиральная компьютерная томография (МСКТ) органов грудной клетки. По результатам исследования диагностирована двусторонняя интерстициальная инфильтрация легких потипу «матового стекла» (предположительно COVID-19, легкая степень поражения легочной ткани, КТ-1). Был произведен забор материала износо- иротоглотки дляопределения РНК вируса SARS-CoV-2 методом полимеразной цепной реакции (ПЦР). Результат оказался положительным. Учитывая нетяжелое течение COVID-19, пациентка проходила лечение в амбулаторных условиях, получала противовирусную терапию (умифеновир 200 мг 4 раза в сутки), симптоматическую терапию (жаропонижающие средства, ацетилцистеин 600 мг в сутки), поливитамины. ЛАГ-специфическая терапия не отменялась. После курса консервативного лечения получен отрицательный результат ПЦР на SARS. Однако в дальнейшем пациентка отмечала сохранение одышки, возобновление предсинкопальных эпизодов на фоне физической нагрузки. По данным лабораторных методов исследования отмечалось снижение показателей красной крови (гемоглобин 98 г/л, эритроциты 4,19х1012/л), сывороточного железа и ферритина (3,7 мкм/л и 4,9нг/мл соответственно). К терапии были добавлены препараты железа.
В течение следующего 2021 г. пациентка отмечала усиление одышки, появление кашля, свистящих хрипов. По данным МСКТ ОГК выявлены признаки компрессии среднедолевого правого бронха расширенной ЛА. По результатам консультации пульмонолога установлен диагноз «Обструктивный бронхит». На фоне бронхолитической терапии одышка уменьшилась, симптомы бронхообструкции купированы.
В настоящее время возраст пациентки составляет 40 лет. На протяжении 24 лет пациентка наблюдается с диагнозом «Идиопатическая легочная артериальная гипертензия». На фоне приема тройной ЛАГ-специфической терапии клиническое состояние остается стабильным, средней степени тяжести, сохраняется одышка при умеренных физических нагрузках (ФК III), синкопальные эпизоды не возникают. Проводится регулярное динамическое наблюдение с целью оценки профиля риска и эффективности проводимого лечения. По результатам последнего обследования от 2023 г. отмечалось увеличение дистанции Т6МХ до 215 м (одышка по шкале Борга 5 баллов, насыщение капиллярной крови кислородом 95%). Концентрация N-терминального фрагмента предшественника мозгового натрийуретического пептида в сыворотке крови (NT-proBNP) – 375 нг/л. По данным ЭхоКГ отрицательной динамики в сравнении с исследованием от 2021 г. выявлено не было. Уровень СДЛА составил 61 мм рт. ст., TAPSE – 21 мм, площадь ПП – 18,8 см2, признаков перикардита не обнаружено.
Учитывая стабильное клиническое состояние, увеличение толерантности к физической нагрузке на фоне проводимого лечения, наличие положительной динамики по данным ЭхоКГ, пациентке рекомендовано продолжить ЛАГ-специфическую терапию в прежнем объеме (мацитентан 10 мг 1 раз в сутки, риоцигуат 2,5мг 3 раза в сутки, селексипаг 600 мкг 2 раза в сутки). В качестве сопутствующей терапии продолжить прием ривароксабана 15 мг 1 раз в сутки, спиронолактона 25 мг 1 раз в сутки, а также беродуала 2 дозы 2 раза в день и пульмикорта 1000 мкг 2 раза в день с целью коррекции бронхообструктивного синдрома. Ниже представлены обобщенные данные динамического наблюдения за пациенткой (табл. 2).
Таблица 2
Данные обследования пациентки И. за весь период наблюдения
|
Год |
1999 |
2005 |
2009 |
2014 |
2020 |
|
2023 |
||||
|
Возраст |
17 лет |
23 года |
27 лет |
32 года |
38 лет |
|
40 лет |
||||
|
Терапия |
Нифедипин 10 мг 3 р/с |
Силденафил 25 мг 3 р/с, дилтиазем |
Атриосепто-стомия, продолжение предшествую-щей терапии |
Риоцигуат 2,5 мг 3 р/с, амбризентан 10 мг 1 р/с, илопрост 5 мкг 6 р/с |
Селексипаг 600 мг 3 р/с, мацитентан 10 мг 1 р/с, риоцигуат 2,5 мг 3 р/с |
COVID-19 |
Селексипаг 600 мкг 2 р/с, мацитентан 10 мг 1 р/с, риоцигуат 2,5 мг 3 р/с + беродуал, пульмикорт |
||||
|
Схема лечения |
Симптоматическая терапия |
Монотерапия |
Комбинированная |
терапия |
|||||||
|
Синкопе |
– |
+ |
+ |
+ |
– |
– |
|||||
|
ФК |
III |
IV |
IV |
III |
III |
III |
|||||
|
Т6МХ |
185 |
160 |
123 |
170 |
190 |
215 |
|||||
|
ЭхоКГ: |
|
|
|||||||||
|
СДЛА |
40 мм рт. ст. |
65 мм рт. ст. |
85 мм рт. ст. (70 мм рт. ст. после АСС) |
80 мм рт. ст. |
62 мм рт. ст. |
61 мм рт. ст. |
|||||
|
Перикардит |
– |
– |
– |
+ |
– |
– |
|||||
|
S ПП |
– |
16,32 см2 |
28,6 см2 |
25,4 см2 |
18,2 см2 |
18,8 см2 |
|||||
|
Данные КПОС |
103/38 (44) мм рт. ст. |
77/49 (61) мм рт. ст. |
110 /44 (71) мм рт. ст. |
– |
– |
– |
|||||
Лечение ЛАГ представляет собой одну из самых сложных проблем современной кардиологии. С появлением высокоэффективных лекарственных препаратов стало возможным использование различных схем лечения с учетом индивидуальных особенностей каждого пациента и тяжести его заболевания. В данном клиническом примере авторы продемонстрировали случай пациентки с длительным анамнезом ИЛАГ. В течение всего периода наблюдения ее индивидуальная терапевтическая схема преодолела эволюционный путь – от блокаторов кальциевых каналов и монотерапии силденафилом до самой современной тройной комбинированной ЛАГ-специфической терапии селексипагом, мацитентаном и риоцигуатом. Также не менее важным аспектом, который демонстрирует данный клинический случай, является своевременная эскалация и модификация тактики лечения после каждой оценки функционального состояния, благодаря чему и стало возможным сохранение статуса промежуточного риска в течение 24 лет неуклонно прогрессирующего заболевания.
Заключение
Таким образом, данный клинический пример демонстрирует возможность улучшения выживаемости и качества жизни пациентов с ЛАГ благодаря регулярной оценке профиля риска и использованию современных, направленных на модификацию отдаленных прогнозов ЛАГ-специфических препаратов.
Библиографическая ссылка
Иванов С.Н., Едемский А.Г., Агаркова М.А., Содномова Л.Б., Гармаева О.В., Бальжинов Д.Б. СОВРЕМЕННАЯ СТРАТЕГИЯ ВЕДЕНИЯ ПАЦИЕНТА С ИДИОПАТИЧЕСКОЙ ЛЕГОЧНОЙ АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ НА ПРИМЕРЕ КЛИНИЧЕСКОГО СЛУЧАЯ // Современные проблемы науки и образования. 2024. № 1. ;URL: https://science-education.ru/ru/article/view?id=33252 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.33252



