Спинальная мышечная атрофия (СМА) – генетическое аутосомно-рецессивное заболевание, характеризующееся прогрессирующей гибелью спинальных мотонейронов, что приводит к слабости и атрофии скелетных мышц. СМА является одной из наиболее частых врожденных причин смертности и инвалидности в детском возрасте [1]. Оцениваемая частота встречаемости составляет примерно 1 случай на 6–11 тысяч новорожденных [2]. Заболевание связано с дефицитом белка выживания моторных нейронов (SMN) в случае гомозиготной делеции гена SMN1, что приводит к потере альфа-мотонейронов. Существуют несколько типов СМА у детей (1–3), которые различаются в зависимости от возраста, начала заболевания и достигнутого объема двигательных функций.
Диагноз обычно устанавливается на основании анамнеза и клинического обследования, с последующим генетическим подтверждением. У лиц со СМА вследствие снижения силы осевой мускулатуры на 90–100% происходит развитие выраженного вторичного сколиоза, что приводит к дыхательной недостаточности, затруднению нахождения в положении сидя и нарушению качества жизни. Развитие подобных сложных деформаций позвоночника в большинстве случаев требует хирургической коррекции [3].
Постоянный выраженный постоперационный неврологический дефицит является одним из наиболее опасных осложнений подобных вмешательств. Таким образом, операции должны проводиться с максимально возможным сохранением имеющихся функций, даже при наличии выраженного исходного снижения. Известно, что коррекция нейромышечного сколиоза сопровождается более высоким процентом неврологических осложнений по сравнению с идиопатическим сколиозом [4]. Одним из основных методов, позволяющих в режиме реального времени контролировать функцию спинного мозга, является интраоперационный нейрофизиологический мониторинг (ИОНМ) моторных (МВП) и соматосенсорных вызванных потенциалов (ССВП). ИОНМ дает возможность контролировать как переднелатеральные, так и задние отделы спинного мозга и является золотым стандартом в хирургии идиопатического сколиоза [5]. В одном из исследований было показано, что чувствительность и специфичность ИОМ на предмет развития неврологического дефицита при коррекции идиопатического сколиоза составляют 82,6% и 94,4% соответственно [6].
В мировой литературе имеются единичные работы, свидетельствующие о возможности проведения ИОНМ и его надежности у пациентов с нейромышечным сколиозом [7, 8, 9] и, в частности, СМА [10, 11], при этом данные во многом остаются противоречивыми и требуют дальнейших исследований.
Цель исследования: провести исследование возможности и оптимизировать параметры интраоперационного нейрофизиологического мониторинга моторных и соматосенсорных вызванных потенциалов у пациентов со СМА при коррекции нейромышечной деформации.
Материал и методы исследования. Совместно с Центром патологии позвоночника А.Н. Бакланова (г. Москва) проведено исследование интраоперационного нейрофизиологического мониторинга (ИОНМ) моторных вызванных потенциалов (МВП) и соматосенсорных вызванных потенциалов (ССВП) в ходе коррекции сколиотической деформации у 12 пациентов, страдающих спинальной мышечной атрофией (СМА), из которых 10 были подтверждены генетически. ИОНМ проводился для мониторинга функционального состояния спинного мозга в процессе коррекции сколиотической деформации.
Контрольная группа включала 10 пациентов, которым проводился ИОНМ при коррекции идиопатического сколиоза (ИПС), без наличия неврологического дефицита и сопутствующей патологии.
Пациентам обеих групп выполнялась дорсальная коррекция с протяженной стабилизацией позвоночника под тотальной внутривенной анестезией, с использованием пропофола, фентанила и миорелаксантов короткого действия на этапе доступа. В контрольной группе в отдельных случаях применялась комбинированная анестезия с добавлением до 0,5 минимальной альвеолярной концентрации (МАК) севофлюрана. Всем пациентам проводили подробное клинико-неврологическое обследование, сила мышечных групп нижних конечностей оценивалась по стандартной 5-балльной шкале MRC.
Все операции проводились с применением мультимодального ИОНМ с использованием системы «Нейро-ИОМ» от «Нейрософт» (Россия) на протяжении всей хирургической процедуры.
МВП вызывались транскраниальной трейновой электрической стимуляцией с использованием штопорообразных электродов в проекции С1-С2 «международная система 10–20». Стимуляция проводилась полушарно со сменой полярности, трейн состоял из 5–6 стимулов длительностью 200 мкс, с межстимульным интервалом 3 мс. Интенсивность стимуляции подбиралась в пределах 150–500 В, с применением фасилитации в виде двойного трейна в ряде случаев (межтрейновый интервал 12 мс).
Регистрация МВП осуществлялась при помощи игольчатых подкожных электродов, оценивались параметры максимальной амплитуды и минимальной латентности ответов. Проводилась регистрация сигналов от мышц верхних и нижних конечностей, а также туловища: mm. abductor digiti minimi, rectus abdominis на двух уровнях, sphincter ani, quadriceps femoris, tibialis anterior, abductor hallucis. В качестве сигнальных критериев оценивались локальное исчезновение ответов или снижение амплитуды более 80%.
Дополнительно проведен поиск оптимальных параметров стимуляции у 6 пациентов со СМА и 10 пациентов контроля. Регистрация МВП производилась в ответ на стимуляцию одиночными и двойными трейнами, состоящими из 6 стимулов, длительностью 0,1 мс каждый, с межстимульным интервалом 3 мс, последовательно с различной длительностью межтрейнового интервала (МТИ): 12, 20, 50, 80, 100 мс. Оценивались суммарная амплитуда мышечных ответов, а также максимальная амплитуда ответов с m. tibialis anterior.
ССВП нижних конечностей регистрировались на корковом уровне по стандартной методике ИОНМ. Проводилась поочередная электрическая стимуляция n. tibialis c двух сторон, которая выполнялась при помощи стимулов длительностью 200 мкс, частотой 3,72 Гц, интенсивностью 15–60 мА. Производилось усреднение 250 стимулов для получения одного ССВП ответа. Оценивались стандартные показатели латентности и амплитуды пиков P38 и N46, регистрирующие электроды устанавливались в проекции Сz’-Fz (система «10-20»). Снижение амплитуды более 50% и увеличение латентности более 10% использовались в качестве сигнальных критериев.
Периодически проводился контроль уровня нейромышечной блокады с использованием TOF-стимуляции по стандартной методике.
Статистическая обработка результатов исследования осуществлялась с использованием пакетов Microsoft Office Excel и IBM SPSS Statistics 22 для прикладных программ, включая описательную и параметрическую статистику. Полученные данные представлены средним значением и стандартным отклонением. Проверка нормальности распределения выполнялась с использованием критерия Колмогорова–Смирнова. Статистическая значимость различий между средними значениями оценивалась с использованием критерия Стьюдента для независимых выборок в случае нормального распределения и критерия Манна–Уитни в случае ненормального. Уровень значимости выбран на уровне p<0,05.
Результаты исследования и их обсуждение
Все пациенты со СМА предъявляли жалобы на выраженную слабость мышц в верхних и в большей мере в нижних конечностях (вплоть доотсутствия движений), повышенную утомляемость, невозможность ходить ировно сидеть в кресле-каталке, боли в спине, грубую деформацию позвоночника и суставов, одышку, резкое затруднение самообслуживания. В исследовании участвовали 12 пациентов с СМА, из них женщин – 10 (83,3%), средний возраст составил 20,6±9,4 года; средний рост 145,6±13,6 см. В группе контроля 10 пациентов, из них женщин – 8, средний возраст составил 21,2±8,11 года; средний рост 164,6±9,0 см.
Все пациенты группы имели периферический, преимущественно проксимальный тетрапарез. Средние показатели оценки силы мышц по шкале MRC для группы в проксимальных идистальных мышцах верхних конечностей составили 3,2 и 3,8 балла соответственно, нижних конечностей — 1,7 и 2,8 балла. Контроль тазовых функций сохранен у всех пациентов группы СМА.
Сухожильные рефлексы нижних конечностей (ахиллов, коленный) отсутствовали у всех пациентов, в 3 (25%) случаях были сохранены биципитальные рефлексы. Чувствительные нарушения в группе также отсутствовали.
Несмотря на резко выраженный двигательный дефицит (вплоть до минимальных движений в нижних конечностях) и ожидаемое отсутствие надежных МВП, воспроизводимые моторные и сенсорные вызванные потенциалы были получены у всех пациентов.
Ответы были получены у всех пациентов с большинства исследуемых мышц, в том числе дистальной группы нижних конечностей. Вбольшинстве случаев (91,7%) у пациентов со СМА также отмечались стабильные ответы снаружного сфинктера ануса и мышц брюшного пресса, что соответствует иклинической сохранности мышечной силы у данных пациентов.
При проведении данных операций не было зафиксировано изменений параметров, связанных с хирургическим вмешательством, достигающих уровня сигнальных критериев и требующих вмешательства в ход операции суведомлением операционной бригады.
В результате исследования было выявлено, что для нижних конечностей наблюдаются статистически значимое (p<0,05) симметричное снижение амплитуды ответов и увеличение латентности (табл. 1) по сравнению с контрольной группой (m. abductor hallucis).
Таблица 1
Сравнительная характеристика МВП, полученных сm.abductor hallucis и ССВП на момент окончания операции
|
Показатель |
СМА (n = 6) |
ИПС (n = 8) |
|
Амплитуда справа, мкВ |
197,8 ± 198,2* |
1101 ± 1089,1 |
|
Амплитуда слева, мкВ |
193,9 ± 133,2* |
1043,7 ± 1528,9 |
|
Латентность слева, мс |
51,3 ± 9,5* |
40,2 ± 3,3 |
|
Латентность справа, мс |
49,5 ± 9,6* |
40,0 ± 3,1 |
* p <0,05
Средние параметры МВП-ответов для мышц верхних конечностей (m.abductor pollicis): 2091±1897,8 мкВ и 1073±1292,3 мкВ – статистически значимо не различались между исследуемыми группами. Однако отмечалась отчетливая тенденция к превышению амплитуды ответов с верхних конечностей в группе СМА, вероятно, за счет применения большей интенсивности транскраниальной стимуляции с целью получения вызванных ответов снижних конечностей.
Параметры ССВП, как и ожидалось, в группе СМА и группе контроля не имели статистически значимых различий (табл. 2).
Таблица 2
Сравнительная характеристика коркового пика P38 ССВП, при стимуляции n. tibialis
|
Показатель |
СМА (n=6) |
ИПС (n=8) |
|
Амплитуда справа, мкВ |
2,51±1,6 |
2,21±0,97 |
|
Амплитуда слева, мкВ |
1,9±1,3 |
1,95±0,87 |
|
Латентность слева, мс |
40,5±4 |
40,7±4,5 |
|
Латентность справа, мс |
40,9±4,4 |
41±3,4 |
* p<0,05
Одним из методов, позволяющих повысить стабильность ивоспроизводимость МВП, в том числе при наличии предоперационного неврологического дефицита, является использование стимуляции двойным трейном [12]. На данный момент продолжается поиск оптимальных параметров стимуляции двойным трейном, позволяющих получить оптимальные МВП-ответы с минимальным сокращением мышц пациента.
МВП-ответы были получены от большинства исследуемых мышц у всех пациентов.
В группе коррекции нейромышечного сколиоза при СМА, как и в группе ИПС, при одинаковой интенсивности стимуляции использование двойного трейна вызывало статистически значимо большую амплитуду МВП c TA в сравнении с одиночным трейном (p<0,05).
При сравнительном анализе амплитуды МВП-ответов в зависимости от длительности МТИ выявлены общие закономерности. В обеих группах – как в группе с нейромышечным сколиозом, так и в группе без неврологического дефицита – максимальная амплитуда МВП c TA отмечалась при использовании только МТИ 12 и 20 мс, при этом в группе СМА – преимущественно 12 мс (рис.).
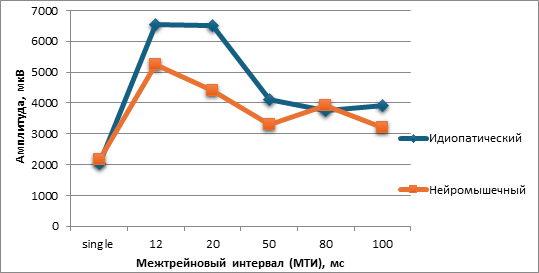
Рис. Сравнение суммарной амплитуды МВП при стимуляции одиночным и двойным трейном с различным МТИ вгруппах СМА и группе контроля
В случае ИПС максимальная амплитуда МВП ТА отмечалась при МТИ 20мс в 5 из 8 случаев (62,5%), в группе СМА — при МТИ 12 мс в 4 из 6 случаев (66,7%).
В случае наличия СМА отмечалась более выраженная вариабельность параметров МВП с ТА. Например, в одном из случаев отмечалось минимальное снижение амплитуды ответа при стимуляции одиночным трейном в сравнении со стимуляцией двойным трейном с МТИ 12 и 20 мс. Во многих случаях для различных мышечных групп максимальная амплитуда МВП (оптимальные параметры) была достигнута при использовании двойного трейна с различными МТИ.
Минимальная амплитуда МВП с ТА в обеих группах наиболее часто отмечалась в случае МТИ 50 (50%), 80 (21%) и 100 (21%) мс. В 4 случаях амплитуда МВП с ТА при стимуляции двойным трейном сМТИ 50мс была ниже, чем при стимуляции одиночным трейном, что, вероятно, связано с возникновением периода ингибирования после одиночного ответа.
Во всех случаях хирургической коррекции сколиоза при СМА возможно надежно контролировать МВП и ССВП для профилактики интраоперационных осложнений. Несмотря на резко выраженный моторный дефицит (вплоть до минимальных движений в ногах) при ожидаемом отсутствии МВП, они регистрируются при транскраниальной электрической стимуляции у всех пациентов с большинства регистрируемых мышц.
Исследование выявило значительное и многократное снижение амплитуды МВП в сравнении с группой контроля для нижних конечностей, что коррелирует с клинической картиной. Ответы с кисти, тем не менее, не имели статистически значимых различий. Также отмечено статистически значимое замедление проведения МВП, что может указывать на гибель части мотонейронов с наиболее быстрой проводимостью двигательных волокон.
Полученные данные позволяют предполагать, что даже при потере большей части мотонейронов передних рогов спинного мозга эта потеря происходит мозаично и часть волокон для проведения остается сохранной. Это отличается от случаев травмы или ишемии спинного мозга, где чаще происходит полное прекращение проведения МВП.
В связи с тем, что в литературе было показано значительное превышение частоты развития серьезных интраоперационных осложнений у пациентов с НМС и СМА, в частности [5, 11, 13], несмотря на то, что в данных группах пациентов не было сигнальных критериев во время операции. Полученные данные рекомендуются к использовании при проведении ИОНМ при коррекции НМС у данных пациентов для профилактики развития параплегии и анестезии нижней половины тела, также у данных пациентов является крайне необходимым интраоперационный контроль МВП тазовых органов, функция которых в подавляющем большинстве случаев сохранна. Кроме того, во всех вышеупомянутых исследованиях нейромышечных сколиозов МВП выполнялись с использованием более распространенной методики одиночного трейна. В нашем исследовании получено статистически значимое увеличение суммарной амплитуды МВП при использовании фасилитации стимуляции двойным по сравнению с одиночным трейном, также показано, что оптимальными параметрами МТИ являются 12 и 20 мс (12 мс были предпочтительнее в группе СМА), но в связи с малой выборкой требуются дополнительные исследования. Данные оптимизированные параметры интраоперационного мониторинга транскраниальной электрической стимуляции МВП с мышц нижних конечностей.
Выводы
1. Интраоперационный мониторинг с регистрацией МВП и ССВП при спинальной мышечной атрофии позволяет оценивать состояние кортикоспинального пути, в том числе в динамике, что определяет возможность профилактировать интраоперационные осложнения при хирургическом лечении деформаций.
2. При СМА симметрично снижена амплитуда ответов и увеличена латентность с нижних конечностей в сравнении с показателями при ИПС без неврологических нарушений.
3. Получено статистически значимое увеличение суммарной амплитуды МВП при использовании фасилитации стимуляции двойным по сравнению с одиночным трейном (p<0,05), также показано, что оптимальными параметрами МТИ являются 12 и 20 мс при СМА.
Библиографическая ссылка
Гулаев Е.В., Линьков В.В. МОТОРНЫЕ И СЕНСОРНЫЕ ВЫЗВАННЫЕ ПОТЕНЦИАЛЫ ПРИ КОРРЕКЦИИ СКОЛИОТИЧЕСКОЙ ДЕФОРМАЦИИ ПАЦИЕНТОВ СО СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИЕЙ // Современные проблемы науки и образования. 2024. № 1. ;URL: https://science-education.ru/ru/article/view?id=33235 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.33235



