Бактериальный кератит – воспалительное заболевание роговицы, возникающее при воздействии патогенной микрофлоры, которое проявляется светобоязнью, слезотечением, блефароспазмом, болью, ощущением инородного тела и снижением зрения. К объективным проявлениям заболевания относят нарушение прозрачности, зеркальности роговой оболочки, перикорнеальную инъекцию, васкуляризацию, расстройство чувствительности.
Важнейшим клиническим симптомом бактериального кератита является инфильтрат, т.е. участок активного воспаления стромы роговицы, состоящий из скопления лейкоцитов и клеточного детрита. Края инфильтрата, как правило, имеют нечеткие границы за счет перифокального отека роговой оболочки.
К предрасполагающим факторам возникновения заболевания относят длительное ношение контактных линз, травмы и инородные тела роговицы, заболевания поверхности роговицы (нейротрофический кератит, кератит на фоне лагофтальма и др.), местную иммуносупреcсивную терапию, постоперационные состояния, связанные с роговичной раной или шовными осложнениями (в том числе роговичный трансплантат), наличие фокальной инфекции.
Основными бактериальными этиологическими факторами инфекций глаз являются как грамположительная (коагулазонегативные стафилококки (24–46%) и др.), грамотрицательная (Enterobacteriaceae spp. (15%) и др.), так и полимикробная флора [1].
Бактериальный кератит практически всегда приводит к снижению зрительных функций, в связи с чем его лечение должно быть своевременным и интенсивным.
Существуют различные методы лечения бактериального кератита, включая консервативное и хирургическое лечение. При лечении бактериального кератита основой является воздействие на этиологический фактор – антибактериальное лечение. В настоящее время к антибактериальным препаратам предъявляется ряд требований, таких как быстрое достижение результата, высокая активность препарата при низкой концентрации, широкий спектр антибактериальных свойств, минимальные побочные явления и низкая токсичность [2].
Зачастую нерациональное использование антибактериальных средств приводит к возникновению лекарственной устойчивости возбудителя и неэффективности лечебных мероприятий [2]. Указанное определяет высокую актуальность разработки патогенетически обоснованных, эффективных и безопасных технологий лечения, способных купировать воспалительный процесс, стимулировать регенерацию тканей и улучшать зрительные функции в короткие сроки.
К таким методам клеточной терапии можно отнести использование аутологичной, богатой тромбоцитами плазмы (PRP), получение которой является минимально инвазивным методом.
В результате разрушения тромбоцитов PRP содержит α-гранулы, после активации которых высвобождаются цитокины и факторы роста [3; 4]. Известно, что высвобождаемые из тромбоцитарных α-гранул биологически активные молекулы способны стимулировать пролиферативную, секреторную, миграционную деятельность клеток, их дифференцировку и взаимодействие друг с другом [5]. Эти цитокины способны воздействовать на клеточные мембранные рецепторы I и II типа, приводя к ускорению пролиферации, роста и восстановления клеток, скорейшей дифференцировке клеток-предшественников без негативного действия на хромосомный клеточный аппарат и др. [6]. Показано, что при изготовлении PRP происходит удаление всех клеточных компонентов из плазмы, благодаря этому появляется возможность долговременного хранения полученного индивидуального трансплантата [7].
В связи с этим в последние десятилетия многие исследователи используют PRP как значимый генератор репарации в различных отраслях медицины для активизации регенераторных процессов, заживления ран и язвенных дефектов, повышения возможностей в приживлении различных видов трансплантатов и др. За счёт природных свойств плазмы, обогащённой тромбоцитами, введение её в организм человека является одной из высокоперспективных технологий при восстановлении тканей.
В последние годы из обогащенной тромбоцитами аутоплазмы готовят аутологичный тромбоцитарный лизат (АТЛ). Технология получения лизата тромбоцитарной аутоплазмы позволяет произвести высвобождение «факторов роста» в кратчайшие сроки, добиться максимальной их концентрации при минимальном объеме от 0,5 мл. Увеличение концентрации биологически активных молекул в минимальном объеме позволяет изготовить достаточное количество доз лизата на весь курс лечения, сохранять АТЛ в течение длительного времени при температуре – 20 °С, а также проводить субконъюнктивальные, параэкваториальные инъекции и также инстилляции.
Цель исследования: показать эффективность и безопасность применения аутологичного тромбоцитарного лизата при лечении пациентов с бактериальным кератитом.
Материалы и методы исследования. Представлены 3 клинических случая лечения пациентов с бактериальным кератитом, которым проводилось антибактериальное, противовоспалительное лечение (стандартное) с добавлением инъекций и инстилляций АТЛ.
Получение аутологичного тромбоцитного лизата: в шприц объемом 20 мл производят забор 1,5 мл гемоконсерванта, далее, используя тот же шприц, осуществляют забор венозной крови пациента объемом 15 мл, после чего перемешивают кровь и гемоконсервант, делая покачивающие движения в течение 15-20 секунд. Пробирку помещают в центрифугу и центрифугируют в течение 4-5 минут при 3500 оборотах/минуту. В ходе центрифугирования кровь разделяется на две основные фракции - эритроцитарно-лейкоцитарный сгусток и плазму крови, содержащую тромбоциты (тромбоцитарная аутоплазма). Шприцем 10 мл из пробирок забирают супернатант, содержащий аутоплазму, обогащенную тромбоцитами, находящуюся в верхней части пробирки, в одну пробирку объемом 50 мл. Концентрация тромбоцитов в аутоплазме составляет не менее 1000×103 кл/мл. Из обогащенной тромбоцитами аутоплазмы готовят лизат путем лизиса мембраны тромбоцитов. Тромбоциты аутологичной плазмы лизируют путем двукратного замораживания в жидком азоте (-196°С) и быстрого оттаивания на водяной бане (+37°С). Полученный АТЛ фильтруют через фильтр (0,22 нм) и хранят до использования при температуре -20°С.
Результаты исследования и их обсуждение
Клинический случай 1.
Пациент С., 64 года, в сентябре 2022 года получил травму левого глаза, за специализированной помощью не обратился. Через 3 дня стал испытывать усиливающиеся болевые ощущения, снижение остроты зрения, что заставило его обратиться в пункт неотложной офтальмологической помощи. Поставлен диагноз: посттравматический кератоконъюнктивит левого глаза. Проведен курс противовоспалительного консервативного лечения. Выписан на амбулаторное долечивание со слабой положительной динамикой. Через 14 дней повторное ухудшение остроты зрения, усиление болевых ощущений, в связи с чем повторная госпитализация в офтальмологическое отделение, где был поставлен диагноз: посттравматическая язва роговицы левого глаза. Максимально корригированная острота зрения (МКОЗ) OS составила 0,01. Проведен курс противовоспалительного, кератопластического лечения. При выписке МКОЗ = 0,02. Сохраняется глубокий дефект роговицы, доходящий до десцеметовой мембраны.
В течение последующих двух недель положительной динамики не наблюдалось, в связи с чем пациент обратился в Новосибирский филиал ФГАУ НМИЦ «МНТК «Микрохирургия глаза» имени академика С.Н. Федорова» Минздрава России. При осмотре МКОЗ OS = 0,02, биомикроскопия OS: выраженная смешанная инъекция, десцеметит, диффузный отек и инфильтрация роговицы, обширная эрозия в центральной зоне (рис. 1а), окрашивается флюоресцеином (рис. 1б). Назначена антибактериальная терапия в виде инстилляций левофлоксацина 4 р/д, препарата гиалуроновой кислоты 5 р/д, декспантенола 5 р/д, хондроитинсульфата 5 р/д, пиклоксидина 3 р/д. Внутримышечные инъекции цефтриаксона 1 гр. 1 р/д 7 дней, введение АТЛ субконъюнктивально №6 и его инстилляции после инъекции.
После курса консервативного лечения отмечается положительная динамика: повышение прозрачности роговицы, уменьшение инфильтрата (рис. 1в). Через 1,5 месяца после лечения при осмотре МКОЗ OS = 0,08, биомикроскопия OS: легкая смешанная инъекция, умеренный отек роговицы, уменьшение инфильтрата, эпителизация дефекта роговицы полная, повышение прозрачности роговицы (рис. 1г).
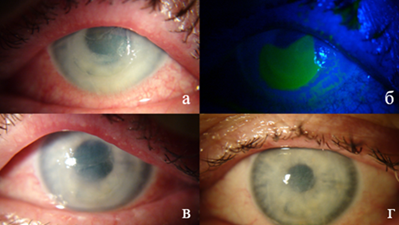
Рис. 1. Клинический случай 1: а - отек, инфильтрат роговицы с обширной эрозией в центральной зоне (до лечения); б - инфильтрат роговицы с обширной эрозией в центральной зоне, окрашенный флюоресцеином (до лечения); в - повышение прозрачности роговицы, уменьшение инфильтрата после проведенного лечения (после лечения с АТЛ); г - уменьшение размеров инфильтрата, эпителизация дефекта (после лечения с АТЛ)
Таким образом, использование АТЛ в комплексном лечении бактериального кератита привело к значительному клинико-функциональному результату и не вызвало развития побочных эффектов.
Клинический случай 2.
Пациент П., 41 год, в декабре 2022 года получал лечение у стоматолога по поводу периодонтита, удаление зуба. Через 3 дня у пациента появились дискомфорт, болевые ощущения, снижение зрения левого глаза, в связи с чем обратился в Новосибирский филиал ФГАУ НМИЦ «МНТК «Микрохирургия глаза» имени академика С.Н. Федорова» Минздрава России. При осмотре МКОЗ OS = 0,4, при биомикроскопии OS белый инфильтрат с четкими границами в параоптической зоне с отеком роговицы в сочетании с конъюнктивальной инъекцией и с дефектом эпителия (рис. 2а), который хорошо виден при пробе с флуоресцеином (рис. 2б). Назначен курс лечения в виде инстилляций левофлоксацина 4 р/д, препарата гиалуроновой кислоты 4 р/д, декспантенола 3 р/д, хондроитинсульфата 4 р/д, пиклоксидина 3 р/д. Левофлоксацин парентерально 500 мг 1 р/д 7 дней. На фоне лечения через 7 дней отмечается слабоположительная динамика. При осмотре МКОЗ OS = 0,5, биомикроскопия OS: сохраняется выраженная инъекция, светобоязнь, болевой синдром, инфильтрат, дефект эпителия, отек роговицы (рис. 2в). По результатам консилиума рекомендовано дополнительное использование АТЛ субконъюнктивально №6 и его инстилляции после инъекции. Через 1,5 месяца после лечения при осмотре МКОЗ = 0,95, биомикроскопия OS: легкое помутнение роговицы (рис. 2г).
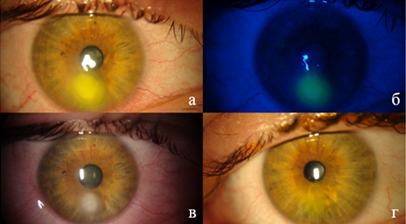
Рис. 2. Клинический случай 2: а - парацентральный дефект эпителия роговицы (до лечения); б - дефект эпителия роговицы, окрашенный флюоресцеином (до лечения); в - сохранение инфильтрата с дефектом эпителия (через 7 дней стандартного лечения); г - состояние роговицы через 1,5 месяца после лечения с АТЛ
Таким образом, присоединение к лечению бактериального кератита АТЛ привело к выраженному клинико-функциональному эффекту без развития побочных эффектов.
Клинический случай 3. Пациентка З., 62 года, в сентябре 2022 года почувствовала ощущение инородного тела в левом глазу, покраснение, слезотечение, светобоязнь. Пациентка для коррекции рефракционной патологии использует мягкие контактные линзы в течение двух месяцев без замены (частота замены у данных линз каждые 2 недели по инструкции), контейнер не меняла около 6 месяцев. Страдает сахарным диабетом II типа около 7 лет. Обратилась за медицинской помощью в поликлинику по месту жительства. После 10 дней лечения улучшения не отметила, обратилась в Новосибирский филиал ФГАУ НМИЦ «МНТК «Микрохирургия глаза» имени академика С.Н. Федорова» Минздрава России. При осмотре МКОЗ OS = 0,15, при биомикроскопии OS отмечается роговичный инфильтрат с захватом оптической зоны, округлой формы, с нечеткими контурами, с окружающим отеком нижней части роговицы, участком деэпителизации (рис. 3а), прокрашивающийся флюоресцеином (рис. 3б). Назначен курс противовоспалительного лечения в виде инстилляций левофлоксацина 4 р/д, препарата гиалуроновой кислоты 3 р/д, декспантенола 3 р/д, хондроитинсульфата 5 р/д, пиклоксидина 3 р/д. Левофлоксацин парентерально 500 мг 1 р/д 7 дней. На фоне лечения через 7 дней отмечается слабоположительная динамика. Несмотря на проводимое лечение сохраняются светобоязнь, боли, отек и инфильтрат роговицы с участком деэпителизации (рис. 3в). Добавлено введение аутологичного тромбоцитарного лизата субконъюнктивально № 6 и его инстилляции после инъекции. Через 1 месяц после лечения при осмотре МКОЗ = 0,65, биомикроскопия OS: облаковидное центральное помутнение роговицы (рис. 3г).
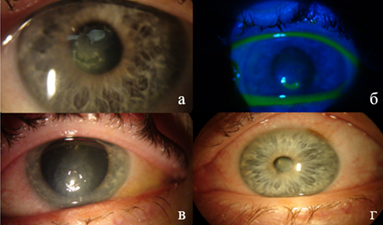
Рис. 3. Клинический случай 3: а - инфильтрат с захватом оптической зоны, округлой формы, с нечеткими контурами, с окружающим отеком нижней части роговицы, участком деэпителизации (до лечения); б - инфильтрат округлой формы с участком деэпителизации, окрашенный флюоресцеином (до лечения); в - инфильтрат роговицы с участком деэпителизации (через 7 дней стандартного лечения); г - облаковидное центральное помутнение роговицы (через 1 месяц после лечения с АТЛ)
Как и в двух выше представленных клинических примерах, только при использовании АТЛ лечение бактериального кератита привело к выраженному клинико-функциональному эффекту.
Несмотря на достижения офтальмологии, лечение бактериального кератита в ряде случаев остается достаточно сложной задачей, а его результаты не всегда удовлетворяют врача. Нами был разработан и запатентован «Способ лечения воспалительных или дистрофических заболеваний глаз» с использованием АТЛ [8]. На наш взгляд, использование АТЛ является одним из успешных способов использования клеточных технологий для активации процессов репарации и регенерации тканей при различной офтальмопатологии. Важнейшим преимуществом использования данной технологии является аутологичность, отсутствие рисков развития аллергических реакций, экономическая доступность метода, а сам АТЛ удобен для инъекционного введения, может быть комбинирован с любыми другими методами лечения. Представленные в статье клинические случаи описывают пациентов, получавших ранее с невысокой эффективностью стандартный курс лечения бактериального кератита в соответствии с клинической картиной и тяжестью поражения. При использовании АТЛ в комплексном лечении бактериального кератита положительный результат был получен во всех случаях и выражался в виде уменьшения либо купирования воспалительного процесса и болевого синдрома, ускорения репарации поврежденных тканей, уменьшения сроков реабилитации, а также не вызывал побочных эффектов. Таким образом, использование АТЛ при лечении воспалительной патологии роговицы бактериального генеза является эффективным и безопасным звеном комплексного ведения пациентов.
Заключение
Использование АТЛ в комплексном лечении пациентов с бактериальными кератитами при неэффективности стандартной терапии является патогенетически обоснованным, способствует купированию признаков воспаления и ускоряет скорость эпителизации. Данная технология стимуляции репарации и регенерации поврежденных тканей представляется высокоперспективной и требует более широкого распространения.
Библиографическая ссылка
Чехова Т.А., Рагозина А.А., Филатова Ю.В., Братко В.И., Черных В.В. ПРИМЕНЕНИЕ АУТОЛОГИЧНОГО ТРОМБОЦИТАРНОГО ЛИЗАТА ПРИ ЛЕЧЕНИИ БАКТЕРИАЛЬНОГО КЕРАТИТА. КЛИНИЧЕСКИЕ СЛУЧАИ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33209 (дата обращения: 28.01.2026).
DOI: https://doi.org/10.17513/spno.33209



