Последствия позвоночно-спинномозговой травмы являются серьезной медицинской и социально-экономической проблемой современного общества [1; 2]. В отдаленные сроки наблюдения у пациентов с позвоночно-спинномозговой травмой регистрируется сформированный комплекс морфофункциональных изменений на уровне повреждения с клиническими проявлениями грубых неврологических и функциональных нарушений [3; 4].
Процесс компенсации нарушенных функций у данной категории пациентов во многом обусловлен особенностями пластических изменений в нервной системе [4; 5]. В литературе понятие «нейропластичность» трактуется как возможность нервных структур к перестройке функциональных свойств под влиянием длительных внешних воздействий, локальных повреждений нервной ткани [5]. Однако по-прежнему нет четкого определения функционального значения нейропластичности после травмы спинного мозга [6].
В настоящее время в литературе отсутствует описание патофизиологических особенностей компенсации функций чувствительной сферы у данной категории пациентов ввиду того, что в большинстве случаев для оценки состояния пациента используются шкалы ISNCSCI и ASIA, в которых недостаточно уделено внимание сенсорной сфере (нет анализа температурно-болевой чувствительности) [7-9]. Кроме того, применение шкал ISNCSCI и ASIA не позволяет выявить субклинические изменения чувствительности и не может точно оценить результаты реабилитации.
Инструментальные исследования температурно-болевой чувствительности у пациентов в хронической фазе позвоночно-спинномозговой травмы с неполным повреждением спинного мозга представлены в редких публикациях, где нет распределения по типам повреждения (В, С, D) и уровню травмы спинного мозга [8-10].
Цель исследования - выявить закономерности компенсации нарушений температурно-болевой чувствительности в отдаленном периоде позвоночно-спинномозговой травмы после частичного повреждения спинного мозга и ее усиление посредством эпидуральной стимуляции.
Материал и методы исследования
В исследовании принимали участие 54 пациента (49 мужчин и 5 женщин) с отдаленными последствиями позвоночно-спинномозговой травмы (3,6±0,6 года, от 1,5 до 12 лет) в возрасте от 18 до 56 лет (31,3±1,5 года). Пациенты имели частичное повреждение спинного мозга - тип В по шкале ASIA. Последствия позвоночно-спинномозговой травмы были зарегистрированы: в шейном отделе позвоночника (С4 - С7 позвонки) у 23 пациентов (42,6%); в грудном отделе (Th3 - Th10 позвонки) в 16 случаях (30,0%); в - грудопоясничном отделе (Th11 - L1 позвонки) у 15 пациентов (27,4%). Критериями включения в группу обследуемых являлись: отдаленный период позвоночно-спинномозговой травмы; уровень повреждения – шейный, грудной, поясничный отдел позвоночника; тип В неврологических нарушений по шкале ASIA. Критериями исключения были: тип неврологических нарушений - A, С, D по шкале ASIA; острый, промежуточный периоды травмы спинного мозга.
Неврологический статус пациентов оценивался с помощью шкал: ISNCSCI (International Standards for Neurological Classification of Spinal Cord Injury); ASIA (American Spinal Injury Association) [7]. Сенсорные нарушения проявлялись в виде снижения тактильной, болевой и проприоцептивной чувствительности ниже уровня повреждения.
Все обследуемые пациенты имели в анамнезе хирургический этап лечения (декомпрессивно-стабилизирующие операции) и неоднократные курсы лечебно-реабилитационных мероприятий.
Анализ температурно-болевой чувствительности производился с применением электрического эстезиометра (термистор фирмы EPCOS Inc., Германия) по общепринятой схеме дерматомов. Определялся порог тепловой и болевой (от горячего) чувствительности (в градусах по Цельсию). Параллельно осуществлялось измерение температуры кожного покрова (Termostar, фирмы Nihon Kohden, Япония).
Пациенты обследовались при поступлении в Центр и после эпидуральной электрической стимуляции. Имплантацию временного эпидурального электрода осуществляли малоинвазивно. Эпидуральную электрическую стимуляцию выполняли с использованием нейромышечного стимулятора «РехаБраво» (MTR+ Vertriebs GmbH, Германия), в режиме Continuous (непрерывный), с частотой следования 5 Гц и продолжительностью импульсов 450 μС. Длительность выполняемой процедуры составляла 10 мин., два раза в сутки в течение 10 дней.
Выполненные исследования были одобрены комитетом по этике ФГБУ «НМИЦ ТО имени академика Г.А. Илизарова» Минздрава РФ (22.10.2019 № 4 (64)) и соответствовали этическим стандартам Хельсинкской декларации с последующими поправками. Лица, принимающие участие в исследовании, подписали информированное согласие на проведение исследований, публикацию соответствующей медицинской информации.
Статистическую оценку полученных данных осуществляли с использованием пакета анализа данных Microsoft Exсel 2010 с надстройкой Attestat. С помощью критерия Шапиро-Уилка и Колмогорова-Смирнова определялась нормальность распределения полученных показателей. В случаях нормального распределения данных был использован параметрический метод – t-критерий Стьюдента. При отсутствии нормального распределения применялся непараметрический принцип статистической обработки, где показатели представлены в виде медианы (Ме), первого (Q1) и третьего (Q3) квартилей и использовались непараметрические методы статистического анализа (критерий Вилкоксона, U-критерий Манна–Уитни). Производили расчет частоты встречаемости (в %) разных видов изменений температурно-болевой чувствительности как отношение количества наблюдений (n) разных вариантов к общему количеству наблюдений (N) по формуле: fi = ni / N*100%, где fi - частота i-го признака, ni – число наблюдений i-го признака, N – общее количество наблюдений в данной группе обследуемых. Взаимосвязь между показателями определяли с помощью теста корреляции Пирсона. Результаты корреляционного анализа представлены коэффициентом корреляции (r) и уровнем значимости (p) с оценкой тесноты связи по шкале Чеддока. Критический уровень значимости при проверке результатов составлял 0,05.
Результаты исследования и их обсуждение
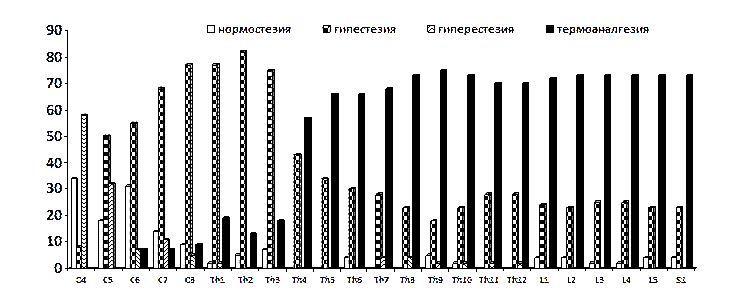
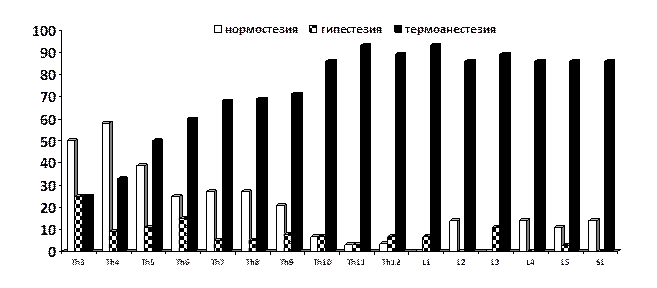
Результаты исследования подтвердили наличие определенных закономерностей в состоянии температурно-болевой чувствительности в отдаленные сроки после частичной травмы спинного мозга. Первая закономерность заключалась в смешанном характере, многообразии, наличии различных величин порогов (нормостезии, гипестезии тепловой и болевой чувствительности, гиперестезия болевой чувствительности, термоанестезии и термоаналгезии) как в дерматомах, соответствующих уровню повреждения, так и в дерматомах, расположенных более дистально. Данный факт прослеживается при исследовании последствий позвоночно-спинномозговой травмы в шейном, грудном и грудопоясничном отделах позвоночника (рис. 1-3).
|
|
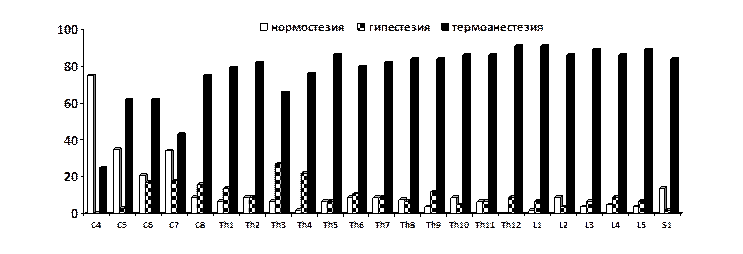
А
|
|
Б
Рис. 1. Частота встречаемости (%) нарушений температурно-болевой чувствительности у пациентов с отдаленными последствиями частичного повреждения шейного отдела спинного мозга (тип В по шкале ASIA). А - тепловая чувствительность, Б - болевая чувствительность
|
|
А
|
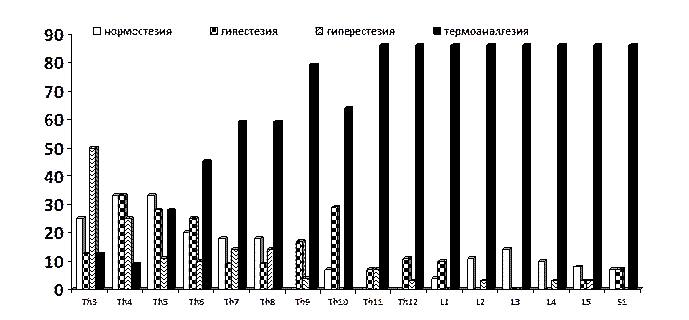
Б
Рис. 2. Виды нарушений температурно-болевой чувствительности (%) у пациентов с отдаленными последствиями неполного повреждения грудного отдела спинного мозга (тип В по шкале ASIA). А - тепловая чувствительность, Б - болевая чувствительность
|
|
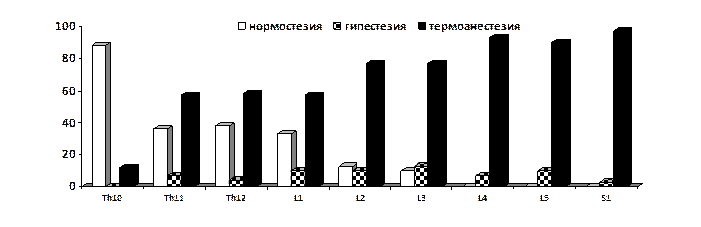
А
|
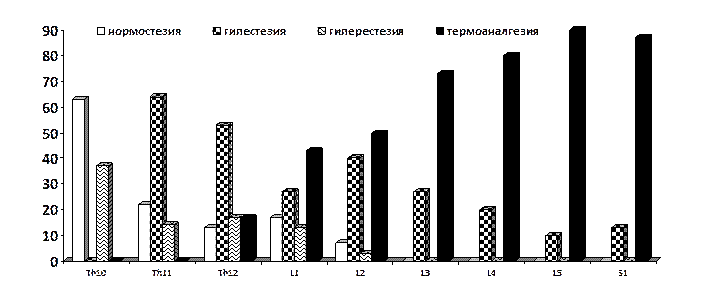
Б
Рис. 3. Нарушения температурно-болевой чувствительности у пациентов с отдаленными последствиями травмы грудопоясничного отдела позвоночника с частичным повреждением спинного мозга (тип В по шкале ASIA). А - тепловая чувствительность, Б - болевая чувствительность
Вторая закономерность заключается в том, что чем более дистально располагается область исследования (дерматом) от уровня повреждения позвоночника и спинного мозга, тем больше доля термоанестезии, сочетающейся с термоаналгезией, гипестезии болевой чувствительности. Эти два факта присутствуют как при травме в шейном, так и в грудном и грудопоясничном отделах (рис. 1-3).
На всех уровнях повреждения (шейный, грудной, грудопоясничный) определялась прямая корреляционная взаимосвязь между количеством дерматомов от уровня повреждения и долей термоанестезии и термоаналгезии (табл. 1). Сила связи имела заметный и высокий характер (по шкале Чеддока). Доля гипестезии болевой чувствительности, также во всех отделах, имела достоверную обратную связь (заметную и высокую) с количеством дерматомов от уровня повреждения. Процент нормостезии тепловой и болевой чувствительности в шейном и грудопоясничном отделе имел обратную корреляцию с количеством дерматомов от уровня повреждения. В грудном отделе эта взаимосвязь отсутствовала. Количество гипестезий тепловой чувствительности коррелировало со степенью удаления от очага повреждения только в шейном отделе (табл. 1) с высокой степенью связи.
Таблица 1
Коэффициент корреляции удаленности (количество дерматомов) области исследования от уровня повреждения и долей различных видов состояния температурно-болевой чувствительности
|
Уровень повреждения позвоночника |
Тепловая чувствительность |
Болевая чувствительность |
||||
|
Нормостезия |
Гипестезия |
Термоанестезия |
Нормостезия |
Гипестезия |
Термоаналгезия
|
|
|
Шейный |
- 0,568 р=0,007 |
- 0,747 р=0,0001 |
0,840 р=0,0002 |
- 0,505 р=0,0194 |
- 0,800 р=0,00002 |
0,852 р=0,000 |
|
Грудной |
- 0,494 р=0,14 |
- 0,451 р=0,11 |
0,640 р=0,025 |
- 0,134 р=0,667 |
- 0,622 р=0,042 |
0,696 р=0,008 |
|
Грудо-поясничный |
- 0,885 р=0,019 |
- 0,639 р=0,17 |
0,925 р=0,0082 |
- 0,815 р=0,046 |
- 0,825 р=0,042 |
0,945 р=0,005 |
Анализ реакций показателей температурно-болевой чувствительности на электрическую эпидуральную стимуляцию определил характерные особенности компенсации. Так, у пациентов с последствиями травмы в шейном отделе позвоночника после первого курса эпидуральной стимуляции (табл. 2) при оценке состояния тепловой чувствительности определялось снижение доли (в %) термоанестезии в дерматомах: С5, С7, С8, Th1-Th4, Th7, L1, L2, L5 (на 10-50%). Статистический анализ показал, что в среднем по всем дерматомам (от С4 до S1 дерматома) доля термоанестезии достоверно уменьшилась (на 11%, р=0,015) (табл. 5). В то же время происходило увеличение доли: нормостезии тепловой чувствительности в дерматомах С5-С8, Th1, Th5, L1; гипестезии – в дерматомах С8 -Th4, Th7-8, L2-L5. В дерматомах С5-С6, Th5 уменьшился процент гипестезии. Однако в среднем по всем дерматомам (от С4 до S1 дерматома) доля нормостезии и гипестезии достоверно не изменяется. Увеличение доли нормостезии формируется в дерматомах: С5 - за счет снижения процента термоанестезии и гипестезии; С6, Th5 – снижения доли гипестезии; С7-Th1,L1 - снижения процента термоанестезии. В то же время термоанестезия трансформируется в гипестезию в дерматомах Th2-Th3, Th7, L2, L5 либо частично в дерматомах С8, Th1.
Таблица 2
Изменения распределения различных видов нарушений температурно-болевой чувствительности у пациентов в отдаленном периоде позвоночно-спинномозговой травмы после частичного повреждения шейного отдела спинного мозга (тип В по шкале ASIA) после первого курса эпидуральной стимуляции
|
Дерматомы |
Тепловая чувствительность |
Болевая чувствительность |
|||||||||||||
|
Нормоcтезия (%) |
Гипеcтезия (%) |
Термо-анестезия (%) |
Нормостезия (%) |
Гипестезия (%) |
Гипере-стезия (%) |
Термо-аналгезия (%) |
|||||||||
|
I |
II |
I |
II |
I |
II |
I |
II |
I |
II |
I |
II |
I |
II |
||
|
С5(n=10) |
25 |
63 |
12 |
0 |
63 |
37 |
25 |
25 |
25 |
25 |
25 |
37 |
25 |
12 |
|
|
С6(n=10) |
20 |
40 |
30
|
10 |
50 |
50 |
20 |
30 |
50 |
30 |
0 |
20 |
30 |
20 |
|
|
С7(n=10) |
10 |
30 |
30 |
30 |
50 |
40 |
10 |
20 |
70 |
60 |
0 |
0 |
20 |
20 |
|
|
С8(n=10) |
10 |
20 |
10
|
30 |
80 |
50 |
0 |
20 |
60 |
60 |
10 |
0 |
30 |
20 |
|
|
Th1(n=10) |
0
|
10
|
10 |
50 |
90 |
40 |
0 |
10 |
50 |
50 |
0 |
0 |
50 |
40 |
|
|
Th2 (n=10) |
10 |
10 |
10 |
30 |
80 |
60 |
0 |
20 |
50 |
40 |
0 |
0 |
50 |
40 |
|
|
Th3 (n=10) |
10 |
10 |
10
|
30 |
80 |
60 |
0 |
20 |
60 |
50 |
0 |
0 |
40 |
30 |
|
|
Th4 (n=10)) |
20 |
10 |
0 |
10 |
80 |
80 |
0 |
10 |
20 |
30 |
0 |
0 |
80 |
60 |
|
|
Th5 (n=10) |
0 |
10 |
10 |
0 |
90 |
90 |
0 |
0 |
20 |
40 |
0 |
0 |
80 |
60 |
|
|
Th6 (n=10) |
10 |
10 |
0 |
0 |
90 |
90 |
0 |
0 |
20 |
40 |
0 |
0 |
80 |
60 |
|
|
Th7 (n=10) |
20 |
10 |
0 |
10 |
80 |
60 |
10 |
10 |
10 |
30 |
0 |
0 |
80 |
60 |
|
|
Th8 (n=10) |
10 |
0 |
10 |
20 |
80 |
80 |
0 |
0 |
20 |
30 |
0 |
0 |
80 |
70 |
|
|
Th9 (n=10) |
10 |
10 |
10 |
0 |
80 |
90 |
0 |
20 |
20 |
10 |
0 |
0 |
80 |
70 |
|
|
Th10 (n=10) |
10 |
10 |
10 |
0 |
80 |
90 |
10 |
20 |
10 |
0 |
0 |
0 |
80 |
80 |
|
|
Th11 (n=10) |
20 |
20 |
0 |
0 |
80 |
80 |
0 |
20 |
20 |
0 |
0 |
0 |
80 |
80 |
|
|
Th12 (n=10) |
20 |
20 |
0 |
0 |
80 |
80 |
0 |
20 |
20 |
0 |
0 |
0 |
80 |
80 |
|
|
L1 (n=10) |
0 |
20 |
0 |
0 |
100 |
80 |
0 |
10 |
20 |
10 |
0 |
0 |
80 |
80 |
|
|
L2 (n=10) |
10 |
0 |
0 |
20 |
90 |
80 |
10 |
0 |
10 |
20 |
0 |
0 |
80 |
80 |
|
|
L3 (n=10) |
20 |
0 |
0 |
20 |
80 |
80 |
0 |
10 |
20 |
10 |
0 |
0 |
80 |
80 |
|
|
L4 (n=10) |
20 |
0 |
0 |
20 |
80 |
80 |
0 |
10 |
20 |
10 |
0 |
0 |
80 |
80 |
|
|
L5 (n=10) |
10 |
10 |
0 |
10 |
90 |
80 |
0 |
10 |
20 |
10 |
0 |
0 |
80 |
80 |
|
|
S1 (n=10) |
10 |
0 |
10 |
10 |
80 |
90 |
10 |
10 |
10 |
10 |
0 |
0 |
80 |
80 |
|
|
Ме [Q1;Q3] |
10 [10;20] |
10 [10;20] p=0,53 |
10 [0;10] |
10 [0;200] p=0,084 |
80 [80;90] |
80 [60;80] p=0,015 |
0 [0;10] |
10* [10;20] p=0,001
|
20 [10;50] |
27,5 [10;40] p=0,40 |
- |
- |
80 [50;80] |
65* [40;80] p=0,002 |
|
|
М±m |
12,5±1,5 |
14,7± 3,1 p=0,48 |
7,82±1,9 |
13,6± 3,0 p=0,079 |
80,0± 2,3 |
71,2± 3,9* p=0,015 |
4,3±1,6 |
13,4± 1,9 * p=0,000 |
28,4±4,0 |
25,7± 4,1 p=0,33 |
- |
- |
65,7±4,8 |
58,3± 5,2* p=0,002 |
|
Примечание: I - до эпидуральной электрической стимуляции; II - после эпидуральной электрической стимуляции. * - достоверность отличия от показателей до эпидуральной стимуляции, р≤0,05.
Оценка реакции состояния болевой чувствительности показала более выраженные изменения. Снижалась доля (в %) термоанелгезии в дерматомах: С5, С6, с С8 по Th9 (на 10-20%). В среднем по всем дерматомам (от С4 до S1 дерматома) доля термоанелгезии достоверно уменьшилась на 19% (р=0,02) (табл. 2). Одновременно с этим процессом регистрировалось увеличение доли нормостезии болевой чувствительности с С6 по Th4; с Th9 по L1; с L3 по L5 (на 10-20%). С учетом всех дерматомов (от С4 до S1 дерматома) в среднем доля нормостезии увеличилась на 211% (р=0,001). Термоаналгезия трансформируется либо в гиперестезию (дерматом С5), нормостезию и гиперестезию (С6), нормостезию (Th1-Th4, Th4; Th9), гипестезию (Th5-Th8). С Th10 до S1 доля термоаналгезии не изменяется. Однако в дерматомах Th10-L1 и L3–L5 увеличивается доля нормостезии (на 10-20%), по всей видимости, за счет снижения процента гипестезии.
После 2-3 курса этот процесс восстановления температурно-болевой чувствительности усиливается (табл. 3): увеличивается количество случаев появления тепловой чувствительности на 46,0% (р=0,0016); болевой чувствительности - 75,5% (р=0,00003) относительно показателей после первого курса.
Таблица 3
Процент восстановления температурно-болевой чувствительности после электрической эпидуральной стимуляции у пациентов с отдаленными последствиями неполного повреждения шейного отдела спинного мозга
|
Дерматомы |
Тепловая чувствительность |
Болевая чувствительность |
||
|
1 стимуляция |
2-3 стимуляция |
1 стимуляция |
2-3 стимуляция |
|
|
С5(n=10) |
40 |
50 |
50 |
50 |
|
С6(n=10) |
0 |
20 |
33 |
33 |
|
С7(n=10) |
33 |
40 |
0 |
30 |
|
С8(n=10) |
50 |
40 |
33 |
35 |
|
Th1(n=10) |
55 |
55 |
20 |
20 |
|
Th2 (n=10) |
37 |
33 |
20 |
30 |
|
Th3 (n=10) |
33 |
33 |
25 |
25 |
|
Th4 (n=10)) |
0 |
12 |
25 |
30 |
|
Th5 (n=10) |
0 |
0 |
25 |
30 |
|
Th6 (n=10) |
11 |
11 |
25 |
25 |
|
Th7 (n=10) |
0 |
12 |
25 |
30 |
|
Th8 (n=10) |
0 |
11 |
25 |
34 |
|
Th9 (n=10) |
0 |
9 |
25 |
30 |
|
Th10 (n=10) |
0 |
12 |
0 |
35 |
|
Th11 (n=10) |
0 |
11 |
0 |
30 |
|
Th12 (n=10) |
0 |
10 |
0 |
15 |
|
L1 (n=10) |
20 |
11 |
0 |
15 |
|
L2 (n=10) |
11 |
11 |
0 |
18 |
|
L3 (n=10) |
0 |
10 |
0 |
15 |
|
L4 (n=10) |
0 |
12 |
0 |
20 |
|
L5 (n=10) |
11 |
11 |
0 |
15 |
|
S1 (n=10) |
0 |
12 |
0 |
18 |
|
Ме [Q1;Q3] |
0 [0;33] |
12 [11;33]* p=0,0013 |
20 [0;25] |
30 [18;30]* p=0,00015 |
|
М±m |
13,7±3,9 |
20,0±3,2* p=0,0016 |
15,1±3,3 |
26,5±1,9* p=0,00003 |
Примечание: * - достоверность отличия от показателей после первого курса эпидуральной электрической стимуляции, р≤0,05.
Таким образом, у пациентов с отдаленными последствиями позвоночно-спинномозговой травмы с неполным повреждением шейного отдела спинного мозга процесс компенсации после эпидуральной стимуляции происходит посредством снижения доли термоанестизии и термоаналгезии, увеличения количества случаев нормостезии болевой чувствительности в цепочке дерматомов с С6 по L5. С увеличением курсов стимуляции растет количество случаев восстановления тепловой и болевой чувствительности.
У пациентов с последствиями позвоночно-спинномозговой травмы грудного отдела позвоночника (n=6) после первого курса стимуляции отсутствовала направленная динамика показателей. Ухудшение чувствительности сочеталось с отсутствием изменений, положительной динамикой (30%) или гиперестезией. На последующих этапах реабилитационного процесса данная тенденция сохранялась. Это может быть обусловлено низким восстановительным потенциалом данного отдела спинного мозга, а также малочисленностью и неоднородностью выборки.
В случаях наличия последствий травмы грудопоясничного отдела позвоночника было определено, что после эпидуральной электростимуляции показатели тепловой чувствительности не имели выраженных значительных изменений (табл. 4).
Таблица 4
Распределение различных видов нарушений температурно-болевой чувствительности у пациентов с отдаленными последствиями позвоночно-спинномозговой травмы грудопоясничного отдела позвоночника до и после 3-го курса эпидуральной электрической стимуляции
|
Дерматомы |
Тепловая чувствительность |
Болевая чувствительность |
||||||||||||
|
Нормоcтезия (%) |
Гипе-стезия (%) |
Термо-анестезия (%) |
Нормоcтезия (%) |
Гипестезия (%) |
Гипере-стезия (%) |
Термо-аналгезия (%) |
||||||||
|
I |
II |
I |
II |
I |
II |
I |
II |
I |
II |
I |
II |
I |
II |
|
|
Th12 (n=8) |
0 |
0 |
17 |
75 |
75 |
25 |
0 |
50 |
50 |
50 |
0 |
0 |
50 |
0 |
|
L1 (n=8) |
25 |
38 |
25 |
0 |
50 |
62 |
0 |
0 |
50 |
38 |
25 |
50 |
25 |
12 |
|
L2 (n=8) |
25 |
38 |
13 |
0 |
62 |
62 |
13 |
0 |
50 |
50 |
12 |
25 |
25 |
25 |
|
L3 (n=8) |
0 |
0 |
25 |
25 |
75 |
75 |
0 |
0 |
25 |
62 |
0 |
0 |
75 |
38 |
|
L4 (n=8) |
0 |
0 |
13 |
13 |
87 |
87 |
0 |
0 |
13 |
25 |
0 |
0 |
87 |
75 |
|
L5 (n=8) |
0 |
0 |
38 |
0 |
62 |
100 |
0 |
0 |
13 |
25 |
0 |
0 |
87 |
75 |
|
S1 (n=8) |
0 |
0 |
13 |
0 |
87 |
100 |
0 |
0 |
25 |
25 |
0 |
0 |
75 |
75 |
|
Me [Q1;Q3] |
0 [0;25] |
0 [0;38] p=0,18 |
17 [13;38] |
0 [0;75] p=0,50 |
75 [50;87] |
75 [25;100] p=0,715 |
- |
- |
25 [13;50] |
38 [25;62] p=0,27 |
- |
- |
75 [25;87] |
38* [0;75] p=0,03
|
Примечание: I - до эпидуральной электрической стимуляции; II - после эпидуральной электрической стимуляции. * - достоверность отличия от показателей до эпидуральной стимуляции, р≤0,05.
Зарегистрировано увеличение количества случаев нормальных порогов только в дерматоме L1 и L2 (на 13%), по-всей видимости, за счет снижения процента гипестезии. Регистрировалось снижение доли термоанестезии (на 50%) в дерматоме Th12 (за счет увеличения доли гипестезии). В дерматомах L5 - S1 растет процент термоанестезии за счет уменьшения гипестезии. Анализ болевой чувствительности у больных данной категории показал, что в дерматомах Th12, L1, L3 – L5 снижается доля случаев термоаналгезии (на 12-50%). В среднем в цепочке дерматомов Th12 - S1 наблюдалось достоверное снижение доли случаев термоаналгезии (на 49%, р=0,03). Количество случаев термоаналгезии уменьшалось в дерматоме: Th12 – за счет увеличения нормостезии; L1 - увеличения доли гиперестезии. Оценка степени восстановления тепловой и болевой чувствительности в тех дерматомах, где она первоначально отсутствовала (табл. 5), показала, что дистальнее дерматома L3 этот процесс значительно уменьшался. А в области дерматома S1 - он отсутствовал.
Таблица 5
Процент восстановления температурно-болевой чувствительности в тех дерматомах, где она первоначально отсутствовала, у пациентов с отдаленными последствиями позвоночно-спинномозговой травмы в грудопоясничном отделе позвоночника после 3-го курса эпидуральной электрической стимуляции
|
Дерматомы |
Тепловая чувствительность |
Болевая чувствительность |
|
Th12 |
66 |
100 |
|
L1 |
25 |
66 |
|
L2 |
20 |
33 |
|
L3 |
33 |
50 |
|
L4 |
15 |
17 |
|
L5 |
- |
15 |
|
S1 |
- |
- |
Нарушение чувствительности является тяжелейшим последствием позвоночно-спинномозговой травмы, которое может проявляться в виде гипестезии, гиперестезии, потери чувствительности, аллодинии или боли [9]. Анализ состояния чувствительности, исследование функции восходящих сенсорных путей имеет большое значение при оценке степени травматического повреждения и восстановления после позвоночно-спинномозговой травмы [11].
Процесс компенсации нарушенных функций у данной категории пациентов во многом обусловлен нейропластическими изменениями в сохраненных нейронных цепях спинного мозга и в вышележащих отделах центральной нервной системы [6; 11; 12]. В хронической фазе позвоночно-спинномозговой травмы нейропластичность осуществляется посредством изменения синаптической эффективности, регенерации и прорастанием аксонов [6].
Анатомические и электрофизиологические исследования показали значительную пластичность сенсорных путей, что свидетельствует о наличии потенциала для компенсации нарушенных функций [11]. В настоящее время в литературе отсутствует описание патофизиологических особенностей компенсации функций чувствительной сферы, в том числе и температурно-болевой чувствительности, у пациентов с последствиями позвоночно-спинномозговой травмы.
Оценка состояния температурно-болевой чувствительности у пациентов в хронической фазе позвоночно-спинномозговой травмы с неполным повреждением спинного мозга представлена в единичных сообщениях, где нет распределения по типам и уровню травмы спинного мозга [8-10].
В нашей работе было определено, что в отдаленные сроки после частичной травмы спинного мозга наблюдается смешанный и многообразный характер состояния температурно-болевой чувствительности. Регистрируется наличие различных величин порогов: нормостезии, гипестезии тепловой и болевой чувствительности, гиперестезия болевой чувствительности, термоанестезии и термоаналгезии как в дерматомах, соответствующих уровню повреждения, так и в дерматомах, расположенных более дистально. Данная закономерность прослеживается при исследовании последствий позвоночно-спинномозговой травмы в шейном, грудном и грудопоясничном отделе позвоночника.
Таким образом, компенсаторная посттравматическая нейропластичность сенсорной системы температурно-болевой чувствительности имеет адаптивный и дезадаптивный характер у пациентов с отдаленными последствиями позвоночно-спинномозговой травмы с частичным повреждением спинного мозга. Кроме того, на всех уровнях повреждения (шейный, грудной, грудопоясничный) определялась прямая корреляционная взаимосвязь между количеством дерматомов от уровня повреждения и долей термоанестезии и термоаналгезии. Доля гипестезии болевой чувствительности, также во всех отделах, имела достоверную обратную связь с количеством дерматомов от уровня повреждения. Процент нормостезии тепловой и болевой чувствительности в шейном и грудопоясничном отделе имел обратную корреляцию с количеством дерматомов от уровня повреждения. В грудном отделе эта взаимосвязь отсутствовала.
Полученные нами данные соотносятся с результатами, представленными в литературе. Ряд авторов при исследовании тепловой чувствительности у данной категории пациентов также отмечал отсутствие или нарушение тепловой чувствительности (повышенные пороги) дистальнее уровня травмы [8; 10].
В отдаленном периоде после позвоночно-спинномозговой травмы нарушение функции спинальных нейронов ниже уровня повреждения может быть вызвано целым рядом негативных факторов, которые способствуют доминированию тормозного импульса в спинномозговых нейронных цепях, угнетению и потере потенциалов действия [6].
При электрической эпидуральной стимуляции имплантированные электроды формируют электрическое поле в дорсальном эпидуральном пространстве, воздействуя на окружающие ткани. Спинномозговая жидкость представляет собой высокопроводящую среду, позволяющую электрическому току распространяться на расстоянии [13]. Одним из возбудимых элементов при эпидуральной стимуляции могут быть чувствительные афферентные волокна задних корешков, которые транссинаптически передают информацию на чувствительные нейроны (2–нейрон) ядер заднего рога. Затем, по-всей видимости, происходит транссинаптическая интеграция с внутренними межнейронными сетями и остаточными супраспинальными входами, изменение возбудимости в спинальных и супраспинальных сетях и улучшение функционирования латерального спиноталамического тракта, взаимодействие с системой супраспинальных связей, высшими отделами центральной нервной системы [14; 15].
Анализ полученных нами данных показал, что у пациентов с отдаленными последствиями позвоночно-спинномозговой травмы с неполным повреждением шейного отдела спинного мозга процесс компенсации после эпидуральной стимуляции происходит посредством снижения доли термоанестизии и термоаналгезии, увеличения количества случаев нормостезии болевой чувствительности в цепочке дерматомов с С6 по L5. С увеличением курсов стимуляции растет количество случаев восстановления тепловой и болевой чувствительности.
У пациентов с последствиями позвоночно-спинномозговой травмы грудного отдела позвоночника отсутствовала направленная динамика показателей. Это может быть обусловлено низким восстановительным потенциалом данного отдела спинного мозга, а также малочисленностью и неоднородностью выборки.
В случаях наличия последствий травмы грудопоясничного отдела позвоночника было определено, что после эпидуральной электростимуляции показатели тепловой чувствительности не имели значительных изменений. Однако наблюдалось достоверное снижение доли случаев термоаналгезии в цепочке дерматомов Th12 - S1. Процесс восстановления тепловой и болевой чувствительности дистальнее дерматома L3 значительно уменьшался.
После эпидуральной электростимуляции компенсация термоаналгезии осуществлялась путем формирования нормостезии либо гипестезии, в меньшей степени гиперестезией. Увеличение случаев нормостезии болевой чувствительности происходило как за счет снижения термоаналгезии, так и уменьшения гипестезии.
Заключение
Таким образом, у пациентов с отдаленными последствиями позвоночно-спинномозговой травмы с частичным повреждением спинного мозга процесс компенсации нарушений температурно-болевой чувствительности имел смешанный (адаптивный и дезадаптивный) характер и зависел от топографической локализации дерматомов. Основным направлением компенсации нарушений температурно-болевой чувствительности при эпидуральной стимуляции является переход термоаналгезии в нормостезию и гипестезию. Увеличение случаев нормостезии болевой чувствительности происходило как за счет снижения термоаналгезии, так и уменьшения гипестезии.
Библиографическая ссылка
Щурова Е.Н., Качесова А.А., Ерохин А.Н., Прудникова О.Г. ПАТОФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ КОМПЕНСАЦИИ НАРУШЕНИЙ ТЕМПЕРАТУРНО-БОЛЕВОЙ ЧУВСТВИТЕЛЬНОСТИ В ОТДАЛЕННЫЙ ПЕРИОД ПОСЛЕ ТРАВМЫ СПИННОГО МОЗГА И ЕЕ УСИЛЕНИЕ ПОСРЕДСТВОМ ЭПИДУРАЛЬНОЙ СТИМУЛЯЦИИ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33208 (дата обращения: 29.01.2026).
DOI: https://doi.org/10.17513/spno.33208



