Палисадная миофибробластома – это очень редкая опухоль, происходящая из гладкомышечных клеток и миофибробластов, впервые описанная в 1989 году одновременно S.W.Weiss и соавт., а также S. Suster и J. Rosai. Она возникает в лимфатических узлах преимущественно паховой локализации, чаще всего опухоль выявляют у пациентов старше 45 лет, с преобладанием мужчин 2:1. Этиология и патогенез данной опухоли до настоящего момента остаются не совсем ясными [1, 2, 3]. Высказываются версии о вирусном происхождении образования, а также связи миофибробластомы с избыточной экспрессией циклина D1. Опухоль характеризуется доброкачественным течением с редкими рецидивами и не обладает выраженным метастатическим потенциалом.
Морфологически опухоль представляет собой доброкачественную мезенхимальную внутриузловую пролиферацию веретенообразных клеток, объединяющихся в разнонаправленные пучки, содержащие отложения пигмента гемосидерина и амиантоидные волокна, напоминающие амиантус – разновидность асбеста, но на самом деле являющиеся коллагеновыми [4]. Иногда в ней могут выявлять очаговые лимфоидные и/или нейтрофильные инфильтраты [1]. Хотя опухоль и является доброкачественной, ее часто ошибочно принимают за метастатическое поражение или лимфопролиферативное заболевание, особенно при ее локализации в атипичных местах.
В связи с наличием веретенообразной морфологии данную опухоль необходимо дифференцировать с рядом морфологически сходных опухолей: дендритно-клеточной саркомой, интранодальной шванномой, метастазами меланомы, метапластической саркомой (в том числе саркомой Капоши), веретеноклеточной липосаркомой [5, 6]. Учитывая возраст пациентов, необходимо исключить характерные инволютивные изменения, встречающиеся в лимфатических узлах у лиц пожилого и старческого возраста, в виде уменьшения функционирующей паренхимы со снижением количества делящихся лимфоцитов за счет ее замещения жировой и фиброзной тканью, что может вызвать определенные диагностические затруднения [7, 8]. Клинически миофибробластома чаще всего представляет собой медленно растущее плотное или плотноэластическое безболезненное образование [1, 2]. Процесс является односторонним, солидным [3].
Иммуногистохимически веретенообразные клетки имеют положительную реакцию с антителами к рецепторам эстрогенов, андрогенов, прогестерона, CD34, bcl-2, гладкомышечному актину, специфическому мышечному актину и виментину, экспрессия со многими другими антителами обычно не наблюдается. Также опухолевые клетки обладают низким пролиферативным индексом по экспрессии маркера пролиферации Ki-67 [1, 2, 9, 10]. Аналогичной гистологической картиной в виде разнонаправленных пучков веретеновидных клеток с низкой пролиферативной активностью по экспрессии Ki-67 и выраженной позитивной реакцией с мышечно-специфическим актином обладают типичная лейомиома и некоторые ее разновидности [11-13]. Дополнительно можно исследовать экспрессию маркеров β‐catenin и cyclin D1, которая является положительной и ассоциируется с мутацией в гене CTNNB1 [4]. При этом строма в палисадной миофибробластоме может быть как слабо, так и хорошо выраженной. Также она может быть гиалинизированной, фиброзированной, коллагенизированной, с диффузно-очаговыми кровоизлияниями, отечной, в состоянии гидропической дегенерации и т.д. [4, 14]. Последние, в свою очередь, в последующем приведут к гистологической картине скоплений гемосидерина. Также данную опухоль следует учитывать, когда в мазках из лимфатических узлов обнаруживаются веретенообразные клетки различной структуры, включая одиночные клетки, короткие пучки, большие сплоченные скопления с центральными амиантоидными волокнами и фоновыми гранулами гемосидерина [15].
Цель исследования: описать редкий случай палисадной миофибробластомы подмышечного лимфатического узла и выявить характерные особенности гистологического строения и иммуногистохимического профиля.
Материалы и методы исследования
Произведена вырезка кусочков из удаленного лимфатического узла, далее осуществлена их проводка по гистологическому протоколу с использованием изопропилового спирта, ксилола и аппарата Leica TP 1020 с последующей заливкой в парафин на станции MPS/P2 (Leica, Германия). Микротомирование производили с помощью Leica EG 1150 H, а для обзорной окраски гистологических срезов использовали Leica Autostainer XL и гематоксилин и эозин.
Для проведения иммуногистохимического исследования были использованы антитела к гладкомышечному актину (SMA, clone A4, Cell Marque), CD117 (clone YP145, Cell Marque), DOG1 (clone SP31, Cell Marque), ER (клон SP1), HHV8 (clone 13B10, Cell Marque), CD23 (clone MRQ-57, Cell Marque), S-100 (clone 4C4.9, Thermo), Ki67 (клон 30-9), при этом окрашивание с применением маркеров рецепторов эстрогенов и маркера пролиферации Ki-67 проводили на иммуностейнере Ventana BenchMark (Roche Diagnostics, Германия, США) по закрытому протоколу. Фотопротоколирование и изготовление фотографий и скан-копий микропрепаратов были осуществлены при помощи медико-биологического микроскопа Nikon Eclipse Ni и программного обеспечения к нему Nis-Elements BR 4.60.00 и сканирующего микроскопа для лабораторных исследований Nanozoomer SQ C13140/21 (Hamamatsu, Япония), а также программы для просмотра сканированных изображений NDP.view2 (U12388-01, версия 2.9.29).
Результаты исследования и их обсуждение
У пациентки 77 лет, проходившей обследование перед госпитализацией для хирургического вмешательства на толстой кишке по поводу аденокарциномы низкой степени злокачественности (low grade, G II), при ультразвуковой диагностике периферических лимфатических узлов было обнаружено безболезненное плотное подвижное образование в подмышечной области справа размерами 3,11х2,31 см. Это образование было удалено одновременно с проведенной гемиколэктомией и направлено на гистологическое исследование с диагнозом: «Подозрение на метастаз рака толстой кишки». Макроскопически препарат представлял собой рассеченный хирургом округлый серо-белый узел размером 3х2,5х2,8 см в тонкой полупрозрачной белесоватой капсуле. При разрезе ткань была плотная, слоистого строения, с мелкоточечными кровоизлияниями, капсула при попытке взять пинцетом легко снималась (отслаивалась).
При гистологическом исследовании удаленное образование представлено лимфатическим узлом, капсула которого незначительно и неравномерно утолщена за счет фиброза. Под ней располагалась узкая прослойка недифференцированной на слои сдавленной паренхимы, состоящей из лимфоцитов, что обусловлено ее медленным экспансивным ростом. Лимфоидные фолликулы не визуализировались, что местами создавало картину выраженной перитуморальной лимфоидной инфильтрации, на самом деле таковой не являющейся. Большую часть паренхимы лимфатического узла замещали разнонаправленные, пересекающиеся пучки однотипных бледных веретеновидных клеток со скудной эозинофильной цитоплазмой, вытянутыми ядрами, с очаговым ядерным частоколом, без признаков митотической активности и атипии. Участки миксоматоза, отложения гемосидерина и амиантоидные очаги, имевшие вид бесструктурных, внеклеточных интенсивно эозинофильных масс округлой, овальной и звездчатой формы, располагавшиеся между пучками веретеновидных клеток (рис. 1А, 1Б) и окруженные тучными макрофагами, были неравномерно разбросаны по полям зрения. В поляризованном свете амиантоидные очаги обладали зеленовато-желтым свечением, что подтвердило их природу (рис. 1В).
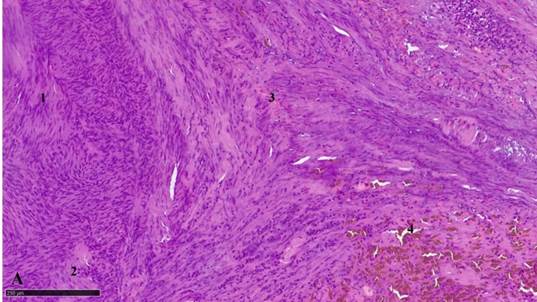
Рис. 1А. Миофибробластома лимфатического узла: 1 – разнонаправленные веретеновидные структуры миофибробластомы, 2 – мелкий амиантоидный очаг, 3 – граница опухоли, 4 – отложения гемосидерина в опухоли. Окраска гематоксилином и эозином.
Масштабный отрезок – 250 мкм
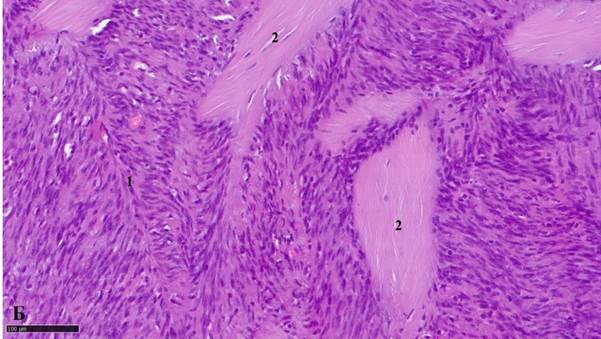
Рис. 1Б. Миофибробластома лимфатического узла: 1 – веретеноклеточные элементы миофибробластомы, образующие палисадоподобные структуры, 2 – множественные крупные амиантоидные очаги с единичными клеточными ядрами. Окраска гематоксилином и эозином. Масштабный отрезок – 100 мкм
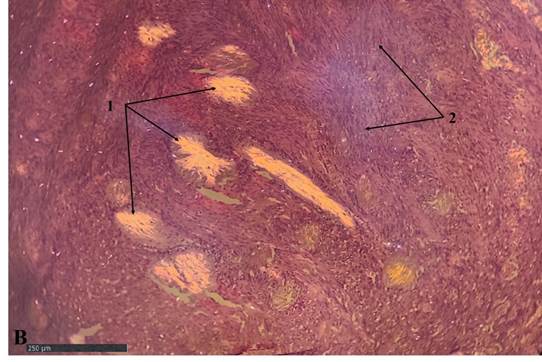
Рис. 1В. Миофибробластома лимфатического узла, исследование препарата в поляризационном свете: 1 – множественные амиантоидные очаги разного размера и формы, 2 – веретеноклеточные структуры миофибробластомы. Окраска гематоксилином и эозином. Масштабный отрезок – 250 мкм
Сам опухолевой узел не имел собственной капсулы, отграничивающей его от паренхимы лимфоузла. Данная гистологическая картина, если ее рассматривать без связи с лимфоузлом, весьма близка по строению к лейомиоме тела матки. Последняя характеризуется строением из пучков гладкомышечных клеток, идущих в различных направлениях, окруженных разного количества и состава стромой, включая склероз, гиалиноз, отек, кровоизлияния и т.д. Иммуногистохимически данные опухоли будут экспрессировать специфический маркер миогенной дифференцировки опухолей мягких тканей десмин и гладкомышечный актин [14].
При иммуногистохимическом исследовании клетки опухоли демонстрировали выраженную цитоплазматическую экспрессию гладкомышечного актина (actin smooth muscle, Dako, clone 1A4), выраженную ядерную (нуклеоплазменную) реакцию с Ki-67 приблизительно с 3% клеток, в единичных клетках выявлена нуклеолярная реакция; реакции к антителам CD117, DOG1, HHV8, CD23 были отрицательные (рис. 2А, 2Б). Для дифференциальной диагностики со шванномой была выполнена реакция с антителами к белку S-100 и получен отрицательный результат [14]. Экспрессия рецепторов эстрогенов (клон SP1) также не была выявлена.
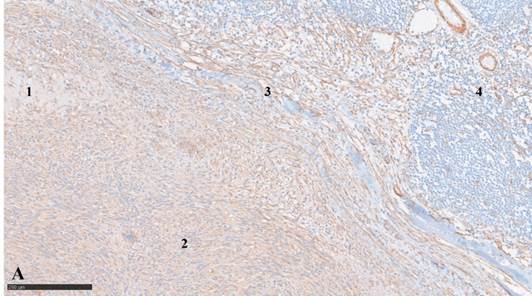
Рис. 2А. Иммуногистохимическая реакция с антителами к гладкомышечному актину:
1 – амиантоидный очаг, 2 – положительное цитоплазматическое окрашивание элементов миофибробластомы, 3 – граница опухоли, 4 – перитуморальная ткань лимфатического узла со SMA-позитивными элементами в сосудах и негативными лимфоцитами. Масштабный отрезок – 250 мкм
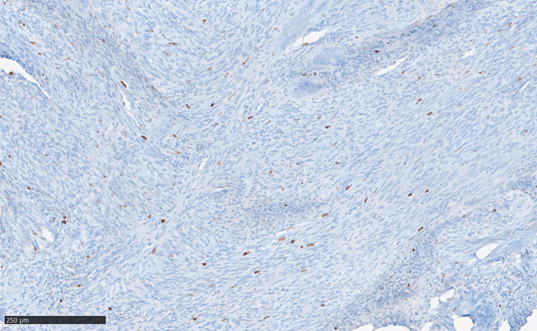
Рис. 2Б. Иммуногистохимическая реакция для определения пролиферативной активности опухоли с антителами к Ki-67 (клон 30-9): выраженная ядерная нуклеоплазменная (в единичных клетках нуклеолярная) реакция не более 3% клеток и отсутствие реакции в остальных клеточных элементах. Масштабный отрезок – 250 мкм
Выводы
Представленное наблюдение палисадной миофибробластомы лимфатического узла отличалось необычной локализацией в подмышечной области и сочетанием с аденокарциномой толстой кишки. Палисадная миофибробластома проявлялась типичными для данной опухоли гистологическими и иммуногистохимическими признаками, такими как веретеноклеточное строение, наличие амиантоидных очагов, отложения гемосидерина, выраженная положительная экспрессия гладкомышечного актина и низкая пролиферативная активность. Таким образом, при изучении увеличенных лимфатических узлов необходимо принимать во внимание возможность обнаружения описанной нами опухоли в биопсийном и/или операционном материале.
Библиографическая ссылка
Хабибуллин Р.Р., Мухина Т.С., Петричко С.А., Горцева П.А., Бирюков Г.В., Тверская А.В. КЛИНИЧЕСКИЙ СЛУЧАЙ ПАЛИСАДНОЙ МИОФИБРОБЛАСТОМЫ В ПОДМЫШЕЧНОМ ЛИМФАТИЧЕСКОМ УЗЛЕ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33206 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33206



