Проблемы, возникающие при изучении наследственных болезней центральной нервной системы, являются весьма сложными. Большинство из них характеризуются преимущественным поражением экстрапирамидной, мозжечковой или пирамидной систем [1]. Актуальным направлением остается изучение факторов, способствующих гибели нейронов центральной нервной системы вследствие создающихся внутриорганных патологических условий, среди которых одним из главенствующих факторов является воспаление. Нейровоспаление можно определить как процесс, при котором собственная иммунная система мозга активируется в результате ишемии, травмы, инфекции, воздействия токсинов, нейродегенеративного процесса, стресса или старения. Установлена роль факторов, провоцирующих воспаление и способствующих развитию нейродегенеративных заболеваний нервной системы [2]. Отмечена роль эксайтоксичности и повышенной активации глутаматных NMDA-рецепторов при болезни Гентингтона [3]. Выявлен дисбаланс центральных нейротрансмиттеров при торсионной дистонии [4]. Установлено, что нейродегенеративный процесс в ЦНС приводит к активации иммунологически релевантных генов, которые объединяют иммунную и нервную системы [5]. В нервной ткани даже невыраженные провоспалительные сигналы стимулируют синтез воспалительных медиаторов и высвобождение хемокинов [6]. В то же время болезнь Гентингтона можно рассматривать как модель для изучения нейродегенеративных заболеваний [7]. Выявленные структурно-функциональные изменения головного мозга на ранней стадии болезни Паркинсона помогают оценить степень поражения нервной ткани [8]. Уточнение роли нейровоспаления и участия в его развитии таких патогенетических факторов, как синтез нейротрофинов и цитокинов, может быть использовано в терапевтических целях и, возможно, позволит снизить темпы прогрессирования данных заболеваний.
Цель исследования: провести комплексное клинико-лабораторное и инструментальное обследование пациентов с наследственными экстрапирамидными заболеваниями для уточнения роли нейровоспаления в нейродегенеративном процессе.
Материалы и методы исследования: были обследованы 39 больных с наследственными экстрапирамидными заболеваниями (НЭЗ): болезнь Гентингтона (n=12), болезнь Паркинсона (n=10), эссенциальный тремор (n=9), торсионная дистония (n=8). Средний возраст больных 49,6 года. Мужчины составляли 74%, женщины – 26%. Были проведены клинико-неврологическое, молекулярно-генетическое, нейроофтальмологическое обследование и лабораторное исследование. Двигательная активность оценивалась по индексу мобильности Ривермидта (RMI). У всех пациентов диагноз был подтвержден молекулярно-генетическим исследованием. При болезни Гентингтона проводилось исследование методом полимеразной цепной реакции (ПЦР), секвенирования в гене IT15 (HTT) и фрагментного анализа 1 экзона гена HTT. Выявлялось количество ЦАГ-повторов (в норме не больше 36). Торсионная дистония определялась методом прямого секвенирования гена GCH1, гена THAP1, гена SPR. Молекулярно-генетическое исследование эссенциального тремора проводилось ПЦР-исследованием на хромосоме 3q13. При болезни Паркинсона исследовались гены: PARK8 (LRRK2), PARK2, PARK7 (DJ1) ПЦР-исследованием. Методом оптической когерентной томографии (ОКТ) было проведено детальное исследование зрительного нерва и сетчатки глазных яблок у 30 пациентов. Нейровизуализация сетчатки и заднего отрезка глаза проводилась с использованием низкокогерентных лучей инфракрасного света (длина волны 830 нм). Оценивались следующие показатели: толщина слоя ганглиозных клеток сетчатки (ТСГКС); толщина нервных волокон сетчатки (ТНВ); толщина сетчатки в макулярной зоне (ТСМЗ). Контрольную группу составляли 30 здоровых добровольцев. У всех пациентов исследуемых групп (n=69) были определены уровни белков воспаления (фактор некроза опухоли-α (ФНО-α), интерлейкин-1 (ИЛ-1), интерлейкин-6 (ИЛ-6)) и глиального нейротрофического фактора (ГНТФ) иммуноферментным методом в образцах сыворотки крови. Производили забор венозной крови натощак в утренние часы в объеме 10 мл. Использовали наборы фирмы RayBiotech, Inc в соответствии с инструкциями производителя.
Пороговые величины определения: ФНО-α – 8,1 пг/мл; ИЛ-1 ‒ 4,9 пг/мл; ИЛ-6 ‒ 7 пг/мл; ГНТФ – 5 пг/мл. Статистическая обработка производилась с использованием пакета STATISTICA 9.0 (USA).
Результаты исследования и их обсуждение
Клинико-неврологическая картина была представлена гиперкинетическим-гипотоническим (74%) и гипокинетическим-гипертоническим (26%) синдромами.
Клинико-неврологическая характеристика пациентов: у 12 пациентов с болезнью Гентингтона средний возраст составлял 33,7±4,93 года, длительность заболевания – 4,6±1,55 года, у 6 больных (50%) хореический гиперкинез был умеренно выраженный, 6 пациентов (50%) имели выраженную степень двигательных нарушений, у 2 пациентов была отмечена ригидная форма. Моторная активность по индексу Ривермидта составляла Индекс Ривермидт 10±4. Среди пациентов с болезнью Паркинсона (n=10) были выделены следующие формы: акинетико-ригидно-дрожательная форма (84,7%), акинетико-ригидная форма заболевания (12,3%), дрожательная форма (3,0%). Возраст пациентов с болезнью Паркинсона составлял 71±7 лет с дебютом заболевания в 61,1±8,57 года. Длительность болезни от момента установления диагноза составляла 11,4±4,35 года. У 3 пациентов были выявлены осложнения в виде флюктуаций и дискинезии. Общая оценка симптомов болезни Паркинсона – 55,5±7,4 балла. Моторная активность по индексу Ривермидта составляла 10±3. Среди пациентов с эссенциальным тремором возраст пациентов составлял 40,6±7,64 года, возраст дебюта заболевания был 28,6±10,3 года, длительность болезни 5,6±3,77 года. У 6 пациентов отмечалась локальная форма, у 2 – генерализованная форма гиперкинеза. Степень выраженности двигательных нарушений была в виде легких у 60% пациентов и умеренных у 40% пациентов. Моторная активность по индексу Ривермидта составляла 12±2. Средний возраст пациентов с торсионной дистонией составлял 26,5±4,5 года, локальная форма наблюдалась у 5 человек, генерализованная форма – в 3 случаях. При локальной форме отмечались дистоническая поза, гиперкинезы в руках и мышцах шеи. В руках отмечались непроизвольные движения, имеющие атетоидный характер. В проксимальных отделах рук гиперкинезы проявлялись сильнее, чем в дистальных. При генерализованной форме отмечались гиперкинезы мышц туловища, гиперкинезы мышц рук и ног, шеи, спазмы лицевой мускулатуры, нарушения речи, нарушение походки, постуральный тремор. Моторная активность по индексу Ривермидта составляла 9±1. Молекулярно-генетическим методом был подтвержден наследственный характер заболеваний у обследованных больных.
Данные иммуноферментного анализа свидетельствуют о том, что концентрация глиального нейротрофического фактора в сыворотке крови у больных наследственными экстрапирамидными заболеваниями была статистически значимо (р<0,001) выше (423,2±73,2), чем в контрольной группе (220,4±15). ФНО-α в сыворотке крови пациентов (74,30 [46,42; 94,88] нг/мл) статистически значимо (р<0,001) выше, чем в контрольной группе (11,20 [10,17; 20,55] нг/мл). Концентрации белков, участвующих в процессе нейровоспаления (ИЛ-1, ИЛ-6), у пациентов основной группы имеют достоверные различия в сравнении с контрольной группой (р<0,001) (рис. 1).
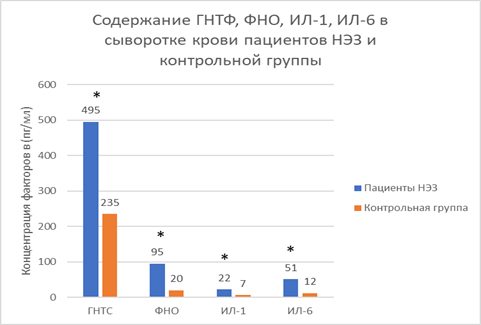
Рис. 1. Концентрации ГНТФ, ФНО-α, ИЛ-1 и ИЛ-6 в сыворотке крови у пациентов с наследственными экстрапирамидными заболеваниями и в контрольной группе, * – статистическая значимость различий значений с контрольной группой (р<0,001), ANOVA
Отмечено, что показатели, полученные с помощью оптической когерентной томографии (общая толщина слоя ганглионарных клеток, толщина слоя нервных волокон сетчатки и толщина слоя макулярной зоны), у пациентов с наследственными экстрапирамидными заболеваниями не имеют достоверных различий в сравнении с группой контроля (табл. 1).
Таблица 1
Параметры оптической когерентной томографии у больных наследственными экстрапирамидными заболеваниями
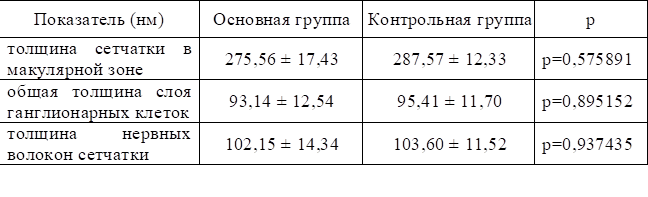
При проведении сравнительного анализа полученных данных выявлено, что у пациентов с НЭЗ старше 60 лет в сравнении с показателями контрольной группы отмечено достоверное снижение общей толщины слоя ганглионарных клеток, толщины нервных волокон сетчатки и толщины сетчатки в макулярной зоне (p<0,01) (рис. 2).
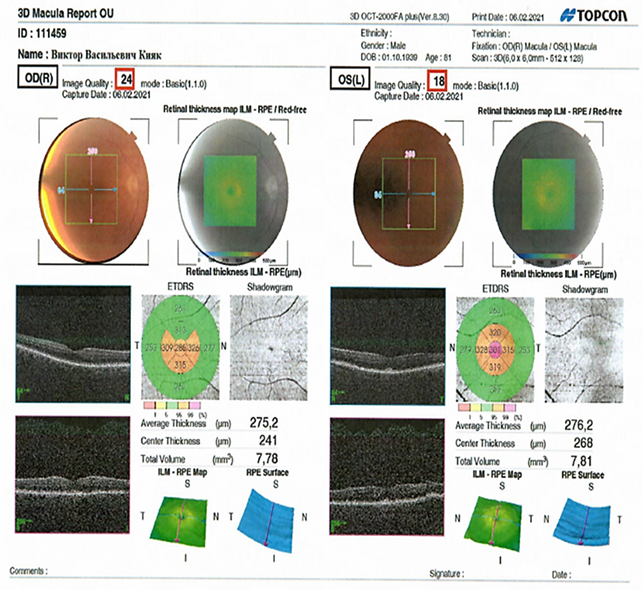
Рис. 2. Результаты оптической когерентной томографии пациента К. (78 лет). Диагноз: болезнь Паркинсона, дрожательно-ригидная форма, III стадия по Хен и Яр
Выявлена сильная корреляционная связь между уровнем концентрации ГНТФ и уровнем цитокинов (ИЛ-1, ИЛ-6) и ФНО-α; чем выше концентрация нейротрофина ГНФТ, тем выше уровень цитокинов (r=0,33, p≤0,001).
Были получены и проанализированы результаты клинического, лабораторного и нейроофтальмологического исследований пациентов с наследственными экстрапирамидными заболеваниями. Выявленные лабораторным и нейроофтальмологическим исследованием у пациентов с болезнью Паркинсона признаки нейровоспаления дополняют современные представления о роли нейровоспаления при нейродегенеративных заболеваниях [9]. Так, у пациентов с болезнью Паркинсона в спинномозговой жидкости были обнаружены воспалительные факторы (ФНО-α, ИЛ-6, ИЛ-10), которые, по мнению ученых, указывали на быстрое прогрессирование болезни Паркинсона [10–12]. У пациентов с болезнью Гентингтона было выявлено, что уровень ряда провоспалительных цитокинов, в частности ИЛ-6 и ИЛ-8, повышен в крови уже на преклинической стадии болезни [5]. В то же время у пациентов с эссенциальным тремором и торсионной дистонией эти данные выявлены впервые. Таким образом, обнаружено, что у пациентов с НЭЗ независимо от патогенеза запускаются механизмы, активизирующие процесс нейровоспаления в структурах головного мозга, которое проявляется повышенным синтезом ГНТФ, в то же время усиливается выработка ФНО-α, ИЛ-1, ИЛ-6, которые относятся к провоспалительным цитокинам клеточного антигенспецифического и регуляторам гуморального антигенспецифического иммунного ответа. Необходимо отметить, что выявленные изменения со стороны концентрации нейротрофина ГНТФ при таких заболеваниях, как болезнь Гентингтона, эссенциальный тремор, торсионная дистония и БП, можно рассматривать как защитный механизм со стороны организма [13]. Однако он не может быть реализован в полной мере из-за отсутствия жизнеспособных рецепторов-мишеней, т.е. сохранных нейронов головного мозга, которые утрачиваются по мере прогрессирования нейродегенерационного процесса. Такие феномены с гиперсинтезом нейротрофинов наблюдаются и при наследственных нервно-мышечных заболеваниях [14]. Изучение офтальмологических маркеров при болезни Паркинсона и болезни Гентингтона на фоне нейродегенеративного процесса является актуальным научным направлением [15, 16]. Оптическая когерентная томография у больных наследственными экстрапирамидными заболеваниями выявила изменения в сетчатке глазного яблока, которые коррелируют с высокой концентрацией ГНТФ и ФНО-α и длительностью заболевания. Однако наиболее выраженные изменения наблюдались у пациентов с болезнью Паркинсона в возрасте старше 60 лет. Это может быть связано с тем фактом, что сетчатка глазного яблока имеет достаточно автономную нейротрофическую регуляцию и у пациентов молодого возраста существуют компенсаторные механизмы, препятствующие гибели нейронов сетчатки, в то время как у пожилых пациентов эти физиологические механизмы с возрастом угасают, и патологические изменения в структурах головного мозга начинают воздействовать и на нейроны сетчатки. Ученые отмечают взаимосвязь между изменениями на сетчатке, а именно снижением ее толщины, и изменением толщины определенных участков коры головного мозга у пациентов с БП [17]. Так, отмечена корреляционная взаимосвязь изменения толщины височного сектора нижнего квадранта сетчатки с толщиной верхней теменной извилины, а также ряда других показателей (толщины верхней полусферы перифовеа, верхнего квадранта перифовеа с толщиной верхней затылочной извилины, ряда участков перифовеа со средней и верхней лобными извилинами, зоной обонятельной борозды) у пациентов с болезнью Паркинсона с когнитивными нарушениями и зрительными расстройствами (иллюзиями, галлюцинациями) [18].
Заключение
Проведенное комплексное клинико-лабораторное и нейроофтальмологическое обследование пациентов с наследственными экстрапирамидными заболеваниями, представленными болезнью Гентингтона, эссенциальным тремором, торсионной дистонией и болезнью Паркинсона, выявило наличие нейровоспаления, которое характеризовалось высокими концентрациями глиального нейротрофического фактора, фактора некроза опухоли-α и цитокинов (интерлейкин-1, интерлейкин-6). Метод когерентной оптической томографии выявил выраженные изменения со стороны толщины сетчатки, толщины слоя нервных волокон сетчатки и слоя ганглионарных клеток в сторону снижения показателей среди пациентов старше 60 лет, которые имели диагноз «болезнь Паркинсона». Результаты лабораторного и нейроофтальмологического исследования уточняют патологические каскады, участвующие в нейродегенеративном процессе, открывают новые потенциальные мишени для лечения данных заболеваний и могут быть использованы для динамического наблюдения пациентов с наследственными экстрапирамидными заболеваниями.
Библиографическая ссылка
Соколова М.Г., Шавуров В.А., Сотникова Д.А., Сотников Н.С. НЕЙРОВОСПАЛЕНИЕ ПРИ НАСЛЕДСТВЕННЫХ ЭКСТРАПИРАМИДНЫХ ЗАБОЛЕВАНИЯХ, РЕЗУЛЬТАТЫ КЛИНИКО-ЛАБОРАТОРНОГО И НЕЙРООФТАЛЬМОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33195 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33195



