Тиреоидные гормоны оказывают широкий спектр физиологических эффектов практически на все ткани и метаболические пути. Основными гормонами, вырабатываемыми щитовидной железой, являются тироксин (или тетрайодтиронин) и трийодтиронин. В клетках тиреоидные гормоны оказывают геномное действие, опосредуемое главным образом ядерными тиреоидными рецепторами, изменяющими экспрессию генов. Трийодтиронин является предпочтительным лигандом тиреоидных рецепторов, тогда как тироксин, концентрация которого в сыворотке крови в 100 раз выше, чем другого гормона щитовидной железы, подвергается экстратиреоидному превращению в трийодтиронин. Это превращение катализируется 5'-дейодиназами 1 и 2 – ферментами, активирующими тиреоидные гормоны. Регуляция дейодиназ позволяет клеточно-целенаправленно регулировать гомеостаз щитовидной железы, влияя на метаболические пути как в здоровом организме, так и при патологии [1].
Растущее число исследований выявило стимулирующий эффект тиреоидных гормонов на рост злокачественных опухолей [2, 3, 4]. В некоторых обсервационных исследованиях были получены аналогичные результаты. Например, в проспективном когортном исследовании более 10 000 участников, проведенном Sr. Khan et al. (2016), было показано, что более высокие уровни свободного тироксина были связаны с более высоким общим риском развития солидного рака (скорректированный ОР 1,42) [5]. Ассоциация была несколько ослаблена за счет пациентов, принимавших препараты, влияющие на щитовидную железу. Такое влияние обусловлено тем, что тиреоидные гормоны, специфически воздействуя на мембранные и ядерные рецепторы, приводят к активации различных канцерогенных сигнальных путей, тем самым стимулируя рост клеток, ангиогенез и ингибируя апоптоз. Например, трийодтиронин через тиреоидные рецепторы может активировать проканцерогенный сигнальный путь фосфатидилинозитол-3 киназы (PI3K), усиливая транскрипцию целевых генов и экспрессию гипоксииндуцируемого фактора, индуцируемого гипоксией, – 1-альфа (HIF-1α) [6]. Среда, адаптированная к гипоксии с активацией ангиогенеза, имеет решающее значение для роста опухолевых клеток, инвазии и метастазирования.
Различные экспериментальные модели на грызунах интенсивно используются для исследования как гипотиреоза [7], так и гипертиреоза [8, 9]. Аутоиммунный гипертиреоз моделируют путем инъекции аденовируса или плазмиды, связанных с рецептором тиреотропного гормона. Неаутоиммунные формы гипертиреоза в основном вызываются добавками искусственного тироксина, который вводится с питьевой водой в виде растворенного левотироксина или путем внутрибрюшинных инъекций [10]. Показано, что у мышей линии C57BL/6NTac, которым внутрибрюшинно вводили левотироксин в дозе 1 мкг/г массы тела в течение шести недель, наблюдался гипертиреоз [11]. Примечательно, что внутрибрюшинные инъекции левотироксина не следует делать с интервалом более 48 часов. В противном случае может возникнуть транзиторный гипотиреоз, который может быть связан с ингибированием гипофизарно-тиреоидной оси [11]. Тем не менее, гипертиреоз, вызванный экзогенным тироксином, является временным, а не постоянным, и его нельзя отделить от непрерывного приема гормонов щитовидной железы. Протоколы индукции гипертиреоза у мышей сильно различаются и в основном включают краткосрочное введение тиреоидных гормонов.
Важным аспектом моделирования опухолевого процесса и тиреоидной дисфункции является использование животных обоего пола, так как известны половые особенности тиреоидного гомеостаза и насыщенности ткани опухоли тиреоидными гормонами в динамике экспериментального опухолевого процесса [12]. Кроме этого, Эндокринное общество подчеркивает важность такой переменной, как пол животного, и необходимость учитывать его в фундаментальной науке и в клинических исследованиях [13].
Цели исследования: создание экспериментальной модели роста карциномы легких Льюиса (LLC) на фоне гипертиреоза и оценка влияния этой патологии на развитие злокачественной опухоли у мышей обоего пола.
Материал и методы исследования. Экспериментальную модель развития злокачественной опухоли в условиях гипертиреоза создавали, используя самок (n=20) и самцов (n=20) мышей линии C57BL/6, полученных из ФГБУН «Научный центр биомедицинских технологий ФМБА» (филиал «Андреевка», Московская область). Для моделирования состояния гипертиреоза животным внутрибрюшинно вводили лиотиронин натрия (Тиромель, Турция), в дозе 20 мкг на 100 г массы мыши в 0,5 мл физиологического раствора ежедневно 1 раз в сутки в течение всего эксперимента. В сыворотке крови животных определяли содержание тиреотропного гормона (ТТГ) и общих форм тиреоидных гормонов: трийодтиронина и тироксина – радиоиммунным методом с помощью стандартных наборов (Immunotech, Чехия). При получении стойкого гипертиреоза в течение 3 дней от начала введения (увеличение уровня трийодтиронина в сыворотке 5,0±2,2 нмоль/л против 1,74±0,17 нмоль/л в интактной группе) животным по стандартной методике перевивали LLC в дозе 2 млн клеток в 0,5 мл физиологического раствора (основная группа, n=24). Для этого, соблюдая все условия асептики, фиксировали мышь спиной кверху, предварительно сбрив шерсть и обработав кожу 5%-ным спиртовым раствором йода, и вводили опухолевую взвесь подкожно в обработанную кожную складку. При извлечении иглы место введения плотно прижимали ватным тампоном, смоченным в 70%-ном спирте с небольшим добавлением йода, на 1 минуту, чтобы исключить вытекание вводимой взвеси. Все манипуляции с животными производили в стерильном боксе. Инструменты, посуду, руки дезинфицировали общепринятым способом. Контролем служили мыши обоего пола с подкожной перевивкой LLC (n=16) в той же дозе и объеме, что и у животных из основной группы, но без введения экзогенного трийодтиронина. Животных декапитировали в предтерминальном состоянии. Работу осуществляли в соответствии с директивой 2010/63/ЕИ и приказом Минздрава России от 19 июня 2003 г. № 267 «Об утверждении правил лабораторной практики». Дизайн экспериментального исследования был одобрен комиссией по биоэтике ФГБУ «НМИЦ онкологии» Минздрава России (Протокол № 2/212 от 19.01.2023 г.).
Статистическую обработку полученных результатов проводили в программе STATISTICA 10.0 (StatSoft Inc., США). Проверку ряда на нормальность распределения оценивали с помощью критерия Шапиро–Уилка. Значимость различий средних независимых выборок оценивали с помощью параметрического критерия Стьюдента при равенстве дисперсий и непараметрического критерия Манна–Уитни, когда дисперсии были не равны, при количестве сравниваемых групп не более двух. Статистически значимыми считали различия при р<0,05.
Результаты исследования и их обсуждение. Результаты изучения содержания гормонов щитовидной железы в сыворотке крови экспериментальных животных представлены в таблице 1.
Таблица 1
Уровень гормонов щитовидной железы в сыворотке крови мышей обоего пола с LLC
|
Гормоны Группы |
ТТГ (мМЕ/л) |
Т4 (нмоль/л) |
Т3 (нмоль/л) |
|
самки |
|||
|
Опухоль LLC (контроль) |
0,063±0,003 |
47,1±3,2 |
1,70±0,09 |
|
Экзогенный Т3 + LLC (основная группа) |
0,003±0,000* |
58,9±4,1* |
2,67±0,03* |
|
самцы |
|||
|
Опухоль LLC (контроль) |
0,090±0,001 |
42,5±2,5 |
1,4±0,07 |
|
Экзогенный Т3 + LLC (основная группа) |
0,053±0,005* |
59,3±1,7* |
2,83±0,03* |
Примечание: Исследование проведено на момент эвтаназии. * – статистически значимые различия по сравнению с группой животных с опухолью LLC и эутиреозом соответствующего пола, р<0,05. Т4 – тироксин, Т3 – трийодтиронин, ТТГ – тиреотропный гормон, LLC – карцинома легкого Льюиса.
У самок мышей с LLC, получавших экзогенный трийодтиронин, установлено повышение в крови уровня тироксина в 1,3 раза (p<0,05), трийодтиронина в 1,6 раза (p<0,05) и снижение ТТГ в 21,0 раза по сравнению с показателями у мышей с ростом опухолей на фоне эутиреоза (табл. 1). У самцов мышей с LLC, получавших экзогенный трийодтиронин, установлено повышение уровня тироксина в 1,4 раза (p<0,05), трийодтиронина в 2,0 раза и снижение ТТГ в 1,7 раза (p<0,05) по сравнению с показателями у животных только с опухолью (табл. 1). Животные с гипертиреозом на фоне повышенного потребления еды теряли в весе, зарегистрировано ухудшение внешнего вида кожи и волосяного покрова. Шерсть была тусклая, собиралась клочьями, отмечалось ее повышенное выпадение (рис. 1, 2).

Рис. 1. Слева самец с LLC на фоне гипертиреоза, справа самец с LLC на фоне эутиреоза
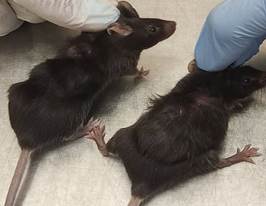
Рис. 2. Слева самка с LLC на фоне эутиреоза, справа самка с LLC на фоне гипертиреоза
Особенности роста опухолей у мышей LLC обоего пола на фоне гипертиреоза по сравнению с ростом опухолей на фоне эутиреоза представлены в таблице 2.
Таблица 2
Особенности злокачественного процесса у мышей обоего пола с LLC
|
Экспериментальные группы
Показатель |
Самцы |
Самки |
||
|
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
|
|
Выход опухолей |
на 4-е сутки |
на 3-и сутки |
||
|
У 6 из 8 (у 75%) |
У 12 из 12 (у 100%) |
У 7 из 8 (у 88%) |
У 11 из 12 (у 92%) |
|
|
Внешние некрозы |
на 13-е сутки |
на 18-е сутки |
||
|
у всех мышей в виде кровавой корки сверху, площадь большая |
у всех мышей в виде проплешин на опухолях (сбоку, где узкая часть) |
у 4 из 8 |
у 10 из 12 |
|
|
Форма опухолей |
округлая |
подковообразная |
округлая |
уплощенная |
|
Продолжительность жизни мышей |
34,9±0,5 |
27,7±0,2* |
32,8±0,1 |
27,2±0,4* |
|
Метастазы в легких (на момент эвтаназии) |
единичные |
множественные |
умеренное количество |
множественные |
Примечание: * – статистически значимые различия по сравнению с показателями у животных контрольной группы (с LLC), p<0,05. Т3 – трийодтиронин, LLC – карцинома легкого Льюиса.
Результаты наблюдения показали более активный рост подкожных опухолевых узлов у самок контрольной группы (рост опухоли на фоне эутиреоза) на начальном этапе – 5-е сутки от момента перевивки: объем опухолей у самок превышал объем опухолей у самцов в 10,5 раза (табл. 3). Однако начиная уже с 7-х суток и до 28-х суток включительно объем подкожных опухолей у самцов контрольной группы становился больше, чем у самок: на 7-е сутки в 2,0 раза, на 11-е сутки в 10,8 раза, на 14-е сутки в 5,5 раза, на 18-е сутки в 4,7 раза, на 21-е сутки в 3,6 раза, на 25-е сутки в 2,6 раза, на 28-е сутки в 1,5 раза (р<0,05) (табл. 3). Динамика объема опухоли в основной группе (рост опухоли на фоне гипертиреоза) свидетельствовала об активации злокачественного процесса под влиянием гипертиреоза на всех этапах исследования и у самцов, и у самок мышей. На всех этапах злокачественного роста у мышей обоего пола с LLC и избытком трийодтиронина объем опухолей был статистически значимо больше: у самцов – на 5-е сутки в 3,9 раза, на 7-е сутки в 1,4 раза, на 11-е сутки в 1,5 раза, на 14-е сутки в 1,4 раза, на 18-е и 21-е сутки в 1,3 раза, на 25-е сутки в 2,1 раза, на 28-е сутки в 1,7 раза; у самок – на 7-е сутки в 1,1 раза, на 11-е сутки в 3,6 раза, на 14-е сутки в 2,1 раза, на 18-е и 21-е сутки в 2,2 раза, на 25-е сутки в 2,4 раза, на 28-е сутки в 1,7 раза (табл. 3). Следовательно, в период с 11-е по 21-е сутки после перевивки у самок с гипертиреозом наблюдалось более быстрое увеличение объема опухолей по сравнению с контролем, чем у самцов. Возможно, причина этой особенности связана с бóльшими объемами опухолей у самцов. Некрозы кожи над опухолями визуализировались у всех самцов основной и контрольной группы уже через 2 недели от момента перевивки опухолевого материала, у самок – на 5 дней позже и не у всех животных: у 50% самок контрольной группы и у 83% самок основной группы (табл. 2).
Таблица 3
Динамика объема подкожных опухолевых узлов (см3) у мышей обоего пола с LLC
|
Экспериментальные группы
Сутки после перевивки опухоли |
Самцы |
Самки |
||
|
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
Опухоль LLC (контроль) |
Экзогенный Т3 + LLC (основная группа) |
|
|
5-е сутки |
0,02±0,007 |
0,09±0,05* |
0,21±0,08 |
0,15±0,05 |
|
7-е сутки |
0,30±0,07 |
0,42±0,11* |
0,15±0,06 |
0,19±0,03* |
|
11-е сутки |
3,35±0,60 |
5,10±0,30* |
0,31±0,08 |
1,13±0,25* |
|
14-е сутки |
4,60±0,66 |
6,26±0,30* |
0,83±0,19 |
1,70±0,39* |
|
18-е сутки |
4,97±0,51 |
6,51±0,50* |
1,05±0,25 |
2,26±0,36* |
|
21-е сутки |
9,37±1,09 |
12,42±0,57* |
2,58±1,10 |
5,69±0,60* |
|
25-е сутки |
6,74±0,62 |
13,88±0,42* |
2,57±0,42 |
6,24±0,61* |
|
28-е сутки |
9,50±1,68 |
15,87±0,34* |
6,44±1,09 |
10,91±0,95* |
|
32-е сутки |
11,48±0,54 |
– |
9,23±0,71 |
– |
Примечание * – статистически значимые различия по сравнению с эутиреоидными животными соответствующего пола, р<0,05
Заключение. Созданная экспериментальная модель влияния гипертиреоза на развитие злокачественной опухоли – карциномы легкого Льюиса у мышей линии C57Bl/6 обоего пола – вызывает стимуляцию роста подкожных опухолей, усиление метастазирования в легкие и уменьшение продолжительности жизни животных, то есть увеличение злокачественного потенциала опухолей. Разработанная модель дает возможность изучать патогенетические механизмы развития злокачественной опухоли на фоне гипертиреоза как коморбидной патологии, а также проводить поиск эффективных воздействий на опухоль. Причем у самок течение злокачественного процесса на фоне гипертиреоза имеет отличные от самцов особенности, что требует дальнейших исследований.
Библиографическая ссылка
Франциянц Е.М., Каплиева И.В., Васильева Е.О., Нескубина И.В., Сурикова Е.И., Трепитаки Л.К., Качесова П.С., Черярина Н.Д., Верескунова А.А. ОСОБЕННОСТИ РАЗВИТИЯ КАРЦИНОМЫ ЛЕГКОГО ЛЬЮИСА НА ФОНЕ ГИПЕРТИРЕОЗА У МЫШЕЙ ОБОЕГО ПОЛА // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33189 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33189



