Во время различных физиологических состояний, которые изменяют метаболическую активность в организме, целью вентиляции является поддержание надлежащей концентрации кислорода, углекислого газа и ионов водорода в жидкостях организма. Таким образом, суммарная метаболическая активность отдельных клеток является важнейшим фактором, регулирующим дыхательную активность [1].
Основными сенсорами кислорода в организме человека являются периферические хеморецепторы, расположенные в каротидных и аортальных тельцах. Они снабжаются чувствительными волокнами, идущими в синусовых и аортальных нервах, а также получают симпатическую и парасимпатическую двигательную иннервацию. Каротидные рецепторы и некоторые аортальные рецепторы необходимы для немедленного повышения вентиляторного и артериального давления при острой гипоксической гипоксемии, а также вносят важный вклад в дыхательную компенсацию острых нарушений кислотно-щелочного баланса. Сосудистые эффекты стимуляции периферических хеморецепторов включают коронарную вазодилатацию и вазоконстрикцию в скелетных мышцах и висцеральной области. Брадикардия и периферическая вазоконстрикция во время стимуляции каротидных хеморецепторов могут быть уменьшены или регрессированы эффектами, возникающими в результате сопутствующего гиперпноэ [2, 3].
Также периферические хеморецепторы у человека реагируют не только на гипоксемию, но и на повышение напряжения углекислого газа в артериях (PaCO2), ацидотический рН, гипогликемию и гипоперфузию [4].
С патологической точки зрения выяснено, что усиленный хемосенсорный выброс каротидного тельца способствует вегетативной дисфункции при обструктивном апноэ во сне, гипертонии, сердечной недостаточности и кардиометаболических заболеваниях. Повышенная хемосенсорная реактивность, вызванная окислительным стрессом, связана с симпатической гиперактивностью, кардиореспираторной нестабильностью, гипертонией и резистентностью к инсулину [5]. Следовательно, определение чувствительности периферического хеморефлекса имеет клиническую значимость, и ее определение играет роль в прогнозировании состояния здоровых респондентов, степени тяжести и терапевтической эффективности у людей, имеющих заболевания сердечно-сосудистой и респираторной систем.
Цель исследования: найти ответ на вопрос: «Какие методы оценки чувствительности периферического хеморефлекса изучены на данный момент и в чем их отличия?»
Материалы и методы исследования. Для поиска литературных источников русскоязычных авторов использовалась научная электронная библиотека eLIBRARY.RU, зарубежных, в основном англоязычных, – Elsevier и PubMed. Ключевыми словами в ходе скрининга служили «периферический хеморефлекс», «чувствительность периферического хеморефлекса», «методы оценки чувствительности хеморефлекса», «peripheral chemoreflex», «peripheral chemoreflex sensitivity», «test of peripheral chemoreflex sensitivity».
Критериями включения в исследование были выбраны молодой возраст (от 18 до 40 лет) респондентов, отсутствие сопутствующей патологии (обструктивного сонного апноэ, хронической сердечной недостаточности, ишемической болезни сердца и т.д.).
В анализ вошли публикации последних 10 лет (2013–2023 гг.), были исключены литературные обзоры и исследования, проведенные на животных.
Результаты исследования и их обсуждение. Всего в русскоязычной поисковой базе были найдены 72 источника, из которых 11 исследований исключены из-за наличия у респондентов сопутствующей патологии, 7 – возраст меньше или больше выбранного в критериях включения, оставшиеся статьи отсеяны ввиду другой направленности анализа.
В англоязычных научных платформах были найдены 68 источников. Отсеяны 59 статей как не соответствующие критериям включения. Таким образом, в итоговый анализ вошли 9 работ, что и составило основной пул исследований, удовлетворяющих критериям включения.
Научные исследования, вошедшие в анализ, были разделены в зависимости от вызванного стимула для определения чувствительности периферического хеморефлекса (табл. 1).
Таблица 1
Методы оценки чувствительности периферического хеморефлекса
|
№ |
Авторы |
Название и год публикации |
Стимул |
|
1. |
Hendrik Kronsbein и соавт. |
«Testing individual baroreflex responses to hypoxia-induced peripheral chemoreflex stimulation», 2020 Перевод с англ. яз.: «Тестирование индивидуальных барорефлекторных ответов на стимуляцию периферического хеморефлекса, вызванную гипоксией» |
Изокапнический гипоксический |
|
2. |
Shigehiko Ogoh и соавт. |
«Effect of acute hypoxia on blood flow in vertebral and internal carotid arteries», 2013 Перевод с англ. яз.: «Влияние острой гипоксии на кровоток в позвоночных и внутренних сонных артериях» |
|
|
3. |
Kristin M. Milloy и соавт. |
«Assessing central and peripheral respiratory chemoreceptor interaction in humans», 2022 Перевод с англ. яз.: «Оценка взаимодействия центральных и периферических респираторных хеморецепторов у человека» |
|
|
4. |
Tyler D. Vermeulen и соавт. |
«Peripheral chemoreflex contribution to ventilatory long-term facilitation induced by acute intermittent hypercapnic hypoxia in males and females», 2020 Перевод с англ. яз.: «Вклад периферического хеморефлекса в долговременное облегчение вентиляции, вызванное острой перемежающейся гиперкапнической гипоксией у мужчин и женщин» |
Гиперкапнический гипоксический |
|
5. |
Jamie R. Pfoh и соавт. |
«Comparing and characterizing transient and steady-state tests of the peripheral chemoreflex in humans», 2016 Перевод с англ. яз.: «Сравнение и характеристика переходных и стационарных тестов периферического хеморефлекса у человека» |
|
|
6. |
Trembach Nikita, Zabolotskikh Igor |
«Breath-holding test in evaluation of peripheral chemoreflex sensitivity in healthy subjects», 2017 Перевод с англ. яз.: «Тест задержки дыхания в оценке чувствительности периферических хеморефлексов у здоровых лиц» |
|
|
7. |
Nicolle J. Domnik и соавт. |
«CO2 rebreathing: an undergraduate laboratory to study the chemical control of breathing», 2013 Перевод с англ. яз.: «Возвратное дыхание CO2: студенческая лаборатория по изучению химического контроля дыхания» |
Возвратное дыхание в модификации J. Duffin |
|
8. |
Lindsey M. Boulet и соавт. |
«Influence of prior hyperventilation duration on respiratory chemosensitivity and cerebrovascular reactivity during modified hyperoxic rebreathing», 2016 Перевод с англ. яз.: «Влияние продолжительности предшествующей гипервентиляции на респираторную хемочувствительность и цереброваскулярную реактивность при модифицированном, гипероксическом, возвратном дыхании» |
|
|
9. |
Nasimi A. Guluzade и соавт. |
«A test of the interaction between central and peripheral respiratory chemoreflexes in humans», 2023 Перевод с англ. яз.: «Тест взаимодействия центральных и периферических респираторных хеморефлексов у человека» |
Изокапнический гипоксический стимул
Исследование, проведенное Hendrik Kronsbein и соавт. и направленное, в основном, на новый подход к изучению индивидуальных баро-хеморефлекторных взаимодействий с использованием повторных болюсных введений фенилэфрина, также продемонстрировало гипоксическую стимуляцию периферических хеморецепторов [6]. Сатурация артериальной крови респондентов составила 98,1±0,4% при нормоксии и 81,0±0,4% при гипоксии (р<0,001), а PetCO2 осталась на исходных значениях (38,31±0,9 [нормоксия] против 37,78±1,1 мм рт. ст. [гипоксия]; р=0,245), частота дыхания (16±1 против 16±1/мин; р=0,588) не изменилась. При гипоксии дыхательный объем увеличивался с 0,77±0,04 до 0,95±0,07 л (р=0,002), а минутный объем вентиляция увеличивался с 11,86±0,51 до 13,95±0,49 л/мин (р=0,036); средний респираторный хеморефлекторный ответ (ΔVi/SpO2) составил 11,79±4,80 (л/мин)/%.
Это наблюдение исключает серьезные изменения во взаимосвязи между симпатической активностью и вазоконстрикцией при гипоксии. В ходе исследования было выявлено, что временная гипоксия обеспечивает более селективный стимул периферических хеморецепторов, и таким образом, может служить методом оценки периферического хеморефлекса [7]. Гипоксия оказывает пролонгированное влияние на симпатическую активность [8], хотя последовательность сеансов в данной работе не повлияла на результаты. Более того, у пациентов с резистентной к лечению артериальной гипертензией не наблюдалось существенного влияния гипоксии на симпатическую активность или реакции на электрическую стимуляцию каротидного синуса [9, 10].
Исследование, опубликованное Shigehiko Ogoh и соавт., ставит перед учеными вопрос: «Равномерно ли усиливается приток крови ко всем частям головного мозга при гипоксии?» [11]. Как считают авторы данной работы, ответ может скрываться в рефлекторной регуляции кардиореспираторной системы, именно в стимуляции дыхательного хеморефлекса, таким способом снижается напряжение CO2. Добровольно участвующие достигали путем эксперимента целевого уровня гипоксии (PO2=86 мм рт. ст.). Во время воспроизведения данного метода оценки в качестве респираторных параметров определялись поток вдыхаемой газовой смеси, концентрации O2 и CO2, а также дыхательный объем (TV), минутная вентиляция (Vi), PetCO2. Кроме того, PaCO2 вычислялась с помощью уравнения [12]:
PaCO2 = 2,367 + 0,884 x PetCO2
Как гипоксия, так и изокапническая гипоксия снижали PetO2 примерно на одинаковом уровне (–65±1% и –63±2% соответственно; p<0,01 (табл. 1)). SpO2 уменьшалась на –7,7±0,4% при гипоксии, при изокапнической гипоксии — на 5,1±0,4%. PetCO2 при гипоксии снижалась на –6,3±0,9% (p<0,001) за счет гипервентиляции (Vi+12,9±2,2%; p<0,001); однако не изменялась во время изокапнической гипоксии. Частота сердечных сокращений (ЧСС) была увеличена в обоих экспериментальных условиях.
Таблица 2
Кардиореспираторные реакции на гипоксию и изокапническую гипоксию
|
Параметр |
Гипоксия |
Изокапническая гипоксия |
||
|
Базовый уровень |
Экспериментальный уровень |
Базовый уровень |
Экспериментальный уровень |
|
|
PetO2 (мм рт. ст.) |
102,6±1,6 |
35,6±1,5** |
103,4±2,3 |
38,4±2,2** |
|
SpO2 (%) |
97,2±0,3 |
89,5±0,7** |
97,6±0,3 |
92,5±0,5** |
|
PetCO2 (мм рт. ст.) |
39,9±1,4 |
37,4±1,3** |
39,4±1,2 |
38,5±0,8 |
|
Вычисленный PaCO2 (мм рт. ст.) |
37,7±1,3 |
35,4±1,1** |
37,2±1,1 |
36,4±0,7 |
|
Минутная вентиляция, Vi (л/мин.) |
7,9±0,6 |
8,9±0,5** |
8,1±0,6 |
8,4±0,6 |
|
Среднее АД (мм рт. ст.) |
80±3 |
77±4 |
78±4 |
80±5 |
|
ЧСС (уд./мин.) |
59±3 |
65±3** |
60±3 |
66±3** |
* – p < 0,05; ** – p < 0,01 в сравнении с базовым уровнем.
В заключение проведенной работы можно сделать вывод о том, что степень гипоксии при применении данного метода вызывала дыхательный ответ, характеристика которого отражалась в изменении кардиореспираторных параметров. Несмотря на это, результирующая степень гипокапнии была низкой для осмысления цереброваскулярных параметров. При изучении исследования перед авторами настоящего обзора не стояла задача анализа изменений потока крови во внутренней сонной и позвоночной артериях, однако имелось желание измерить комплексную, с точки зрения рефлекторной регуляции кардиореспираторной системы, реакцию на гипоксию [13].
Основной целью работы Kristin M. Milloy и соавт. было исследование взаимодействия между центральными и периферическими хеморецепторами у здоровых людей с использованием тестов ступенчатого увеличения фракции вдыхаемого углекислого газа для активации центральных механизмов кардиореспираторной системы и транзиторной гипоксии – для воздействия периферических [14]. Респонденты подвергались трем последовательным попыткам транзиторной гипоксии с использованием вдохов со 100% N2, между которыми, согласно протоколу эксперимента, был минимальный интервал в 2 минуты для восстановления до исходного уровня таких измеряемых параметров, как SpO2, PetO2, PetCO2 и Vi (рис. 1).
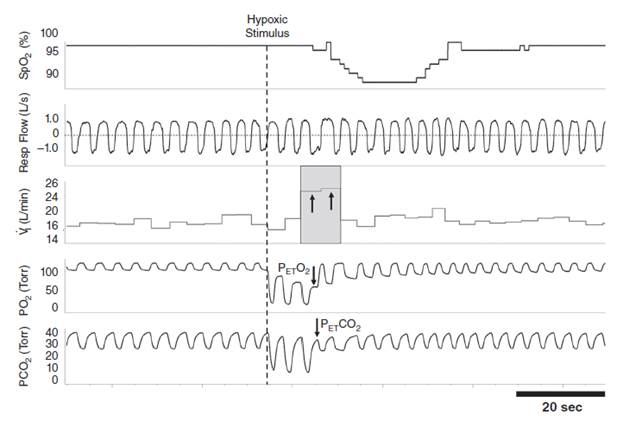
Рис. 1. Отображение реакции одного из участников на гипоксический тест, показывающий изменения значений периферической сатурации артериальной крови (SpO2), потока дыхания (Resp. Flow), минутной вентиляции (Vi), и парциального давления кислорода и углекислого газа (PO2 и PCO2 соответственно)
Основные результаты проведенного исследования заключились в том, что взаимодействия между центральными и периферическими хеморецепторами являются зависимыми по таким респираторным параметрам, как минутная вентиляция и частота дыхания, по сравнению с меньшей зависимостью в виде дыхательного объема.
Гиперкапнический гипоксический стимул
Целью исследования, описанного Tyler D. Vermeulen и соавт., было определить наличие экспрессии длительной вентиляции легких (ДВЛ) после 40-минутной периодической гиперкапнической гипоксии (ПГГ) и сохранения в течение 50-минутного изокапнически-нормоксического восстановления, и способствования тонической активности периферических хеморецепторов ДВЛ у людей [15]. Авторы предполагают, что после ПГГ минутная вентиляция (Vi) будет высокой по сравнению с исходным уровнем в течение 50 минут, а преходящее угнетение периферического хеморефлекса вследствие гипероксии приведет к снижению Vi во время восстановления после ПГГ, что может указывать на сенсорную модуляцию периферических хеморецепторов [16, 17]. В течение каждого 1-минутного цикла, усредненного по всей продолжительности воздействия, среднее минимальное значение SpO2 респондентов составляло 83±4%, среднее пиковое значение – 97±1%. Cреднее значение ΔPetCO2 было 3±1 мм рт. ст., рассчитанное как разница между пиковыми (44±2 мм рт. ст.) и исходным (41±2 мм рт. ст.). Во время ПГГ общая продолжительность показателя SpO2 ниже 95, 90 и 85% составила 24±5, 13±4 и 5±4 минуты соответственно. Во всех точках времени восстановления после ПГГ, Vi увеличивалась по сравнению с исходным уровнем, демонстрируя экспрессию ДВЛ (p<0,001), что было преимущественно результатом увеличения частоты дыхания на 5-й, 10-й и 15-й минуте восстановления (p<0,001, p=0,002 и p=0,032 по сравнению с исходными данными соответственно), повышение дыхательного объема (ДО) также наблюдалось на 30-й и 50-й минуте восстановления (p=0,002 и p=0,004 по сравнению с исходными данными соответственно). В группе участников, подверженных ПГГ, Vi была выше, чем в контрольной, в период после 5–20 минут восстановления (p<0,05) и не отличалась статистически ни в какие другие моменты времени (диапазон значений: p=0,094–0,594). Аналогично, более высокая ЧД в когорте ПГГ была очевидна только через 5, 15, 20 и 45 минут восстановления по сравнению с контрольной группой (p<0,05). Результаты данной работы контрастируют с результатами опубликованных ранее работ, в которых использовалась аналогичная ПГГ, но без успешной экспрессии ДВЛ [18, 19]. Эти противоречивые данные могут быть следствием различий в тяжести или продолжительности воздействия. Стоит отметить, что авторы пришли к выводу о том, что ПГГ индуцирует ДВЛ в первые 30 минут периода восстановления.
Jamie R. Pfoh и соавт. охарактеризовали в своем исследовании кардиореспираторные и цереброваскулярные реакции в ответ на гипоксию [20]. Протокол включал несколько гипоксических тестов, в том числе однократный вдох респондентами смеси, содержащей 13% CO2. Результаты показали, что среднее значение PetCO2 после 5 попыток составило 43,9±0,54 мм рт. ст., что соответствовало среднему значению гиперкапнического дыхательного ответа 1,20±0,2 л/мин./мм рт. ст. Частота сердечных сокращений увеличивалась на 2,42±0,6 уд./мин., или 3,35±0,83% (p=0,002), среднее артериальное давление увеличилось на 2,18±0,43 мм рт. ст., или 2,46±0,49% (табл. 3).
Таблица 3
Кардиореспираторные реакции в ответ на гиперкапническую гипоксию
|
Показатель |
Абсолютное значение |
Изменение в % |
ΔPetCO2 |
|
Частота сердечных сокращений, уд./мин. |
2,42±0,6 |
3,35±0,83 |
0,31±0,07 |
|
Среднее артериальное давление, мм рт. ст. |
2,18±0,43 |
2,46±0,49 |
0,28±0,06 |
Таким образом, авторы приходят к выводу о том, что транзиторный тест с использованием гиперкапнической смеси стимулирует периферические хеморецепторы и оказывает минимальное влияние на сердечно-сосудистые и цереброваскулярные параметры, следовательно, может быть представлен как исключительный метод оценки периферического хеморефлекса.
Nikita Trembach, Igor Zabolotskikh определили целесообразность использования теста с задержкой дыхания для оценки чувствительности периферического хеморефлекса по сравнению с однократным дыханием диоксида углерода [21]. Средняя чувствительность периферического хеморефлекса, измеренная при втором углекислотном тесте с однократным дыханием, составила 0,37±0,10 л/мин./мм рт. ст. Средняя продолжительность задержки дыхания составила 52±11 сек. Коэффициент вариабельности в пробе с однократным дыханием диоксида углерода колебался от 0 до 32% при среднем значении 10±7%. Коэффициент вариабельности теста задержки дыхания колебался от 0 до 19% при среднем значении 6±4% (р<0,05). В ходе корреляционного анализа была отмечена сильная обратная корреляция между результатами двух парадигм теста ( –0,82; R2=0,68; р<0,05).
Результаты исследования продемонстрировали положительную корреляцию между длительностью задержки дыхания и жизненной емкостью легких [22]. Учитывая вышеизложенное, продолжительность задержки дыхания зависит не только от чувствительности периферического хеморефлекса, но и от исходного уровня газов крови и скорости обмена веществ, т.е. скорости газообмена, что необходимо учитывать при проведении данного теста.
Возвратное дыхание в модификации J. Duffin
Nicolle J. Domnik и соавт. представили исследование, целью которого было рассмотреть гипотезу о том, что результаты возвратного дыхания, воспроизводимого необученными испытуемыми, достаточно надежны и достоверны для оценки чувствительности периферического хеморефлекса [23]. На основании техники J. Duffin [24, 25] были построены графики зависимости Vi от PetCO2 каждого участника исследования для визуальной идентификации базового уровня вентиляции (горизонтальное плато ниже точки перегиба, т.е. порога) и чувствительности (наклона выше порога) (рис. 2).
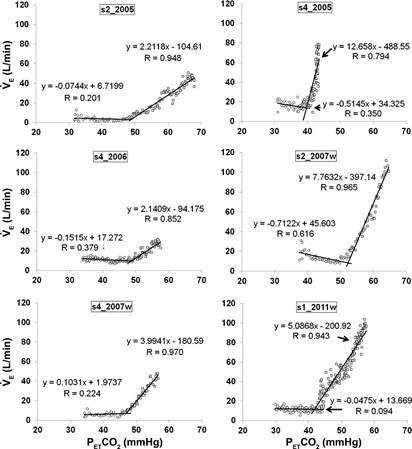
Рис. 2. Графики Vi и PetCO2 для 6 субъектов, иллюстрирующие линии регрессии для вентиляции ниже и выше порога. Пересечение линий регрессии указывает на порог. Показаны уравнения регрессии и значения R
К каждому графику были построены две линейные регрессии: для данных ниже (базовый уровень) и данных выше (чувствительность) порога. Последний определяли как точку пересечения двух линейных регрессий, а чувствительность – по наклону линейной регрессии, полученной на основе данных выше порога.
Для набора данных, включенных в окончательный анализ, среднее стандартное отклонение порога для PetCO2 составило 43,3±3,8 мм рт. ст. (диапазон: 36,4–52,2 мм рт. ст.), чувствительности — 4,6±3,04 л/мин./мм рт. ст. (диапазон: 1,64–13,54 л/мин./мм рт. ст.). Пороговые значения имели нормальное распределение (по Колмогорову–Смирнову: 0,102; p>0,2), в то время как значения чувствительности отражали распределение по Колмогорову–Смирнову 0,201; p=0,002. Данные также сравнивались со значениями для мужчин и женщин, – коэффициенты вариации чувствительности и порога составили 65,2% и 8,8% соответственно.
Авторы отмечают успешность использования в исследовании модифицированного метода возвратного дыхания, который, по сравнению с вариантом, предложенным J. Duffin [24, 25], с измененным составом газовой смеси в мешке Дугласа (95% O2 и 5% CO2 вместо 93% O2 и 7% CO2 [25]), недорог и доступен.
Lindsey M. Boulet и соавт. охарактеризовали и сравнили в своей работе кардиореспираторные реакции в широком физиологическом диапазоне на модифицированный J. Duffin [24, 25] тест с гипероксическим повторным дыханием, что позволило количественно оценить базальную вентиляцию и порог рекрутирования вентиляции (ПРВ) [26].
Стандартный протокол включал в себя 5 минут предварительной гипервентиляции для истощения запасов CO2 в организме, хотя экспериментальных доказательств обоснования этого времени нет. Авторы предположили, что индивидуальные различия в кардиореспираторных реакциях будут отсутствовать даже при укороченной продолжительности гипервентиляции перед повторным дыханием. Статистический анализ полученных данных выражался в отсутствии существенных различий реактивности ЧД (ЧД/PetCO2, p=0,69), ДО (ДО/PetCO2, p=0,33) или респираторной реактивности (Vi/PetCO2, p=0,12). Интересующая в данном систематическом обзоре респираторная реактивность как отражение хеморефлекса коррелировала между 1-й и 3-й минутами гипервентиляции (r=0,86; p<0,0001), 1-й и 5-й минутами (r=0,77; p<0,0001) и 3-й и 5-й минутами (r=0,91; p<0,0001). Также наблюдалась разница во времени до ПРВ, при этом продолжительность предшествующей гипервентиляции в течение 1 минуты была короче (135,4±19,7 сек.), чем за 3 и 5 минут (176,3±15,1 сек. и 187,2±11,6 сек. соответственно).
Рассмотренный способ оценки респираторного хеморефлекса действительно отражает его изменения в ответ на вентиляцию, а также показывает, как описывают авторы, что 5-минутная предварительная гипервентиляция не требуется во время модифицированного повторного дыхания при его использовании для количественной оценки респираторных или цереброваскулярных реакций и может быть сокращена до 1 минуты, что уменьшает время протокола и повышает комфорт участников во время эксперимента.
Респонденты в исследовании Nasimi A. Guluzade и соавт., в свою очередь, выполняли три модифицированных вдоха с фиксированным PetO2 на уровне 150, 70, 60 и 50 мм рт. ст. [27] Vi, ДО и ЧД увеличивались с исходного уровня линейно с PetCO2 (p<0,0001). Основной эффект заключался в том, что эти респираторные показатели повышались по мере падения PetO2.
У большинства респондентов не наблюдалось гипо- или гипераддитивного эффекта центральных хеморецепторов на периферический хеморефлекс. Исходя из этого, периферический хеморефлекторный ответ на гипоксию сохранял положительную линейную связь с PetCO2, несмотря на увеличение активации центрального хеморефлекса. Эти данные свидетельствуют о том, что у здоровых людей центральные хеморецепторы не оказывают существенного влияния на периферический респираторный хеморефлекторный ответ на гипоксию. Кроме того, зависимость чувствительности периферического хеморефлекса от PetCO2 в большинстве случаев была линейной, что также свидетельствует о том, что периферические хеморецепторы, вероятно, не влияют на центральный респираторный хеморефлекс.
Выводы. Большинство исследований последних 10 лет, направленных на изучение периферических хеморецепторов и их функции, в особенности периферического хеморефлекса, отразили высокую чувствительность в анализе данного явления. Однако в ходе исследования работ, удовлетворяющих критериям включения в анализ, обнаружены некоторые ограничения. В частности, это малые группы, участвующие в экспериментах, описанных авторами вышеизложенных статей.
У каждого метода оценки периферического хеморефлекса есть как преимущества, так и недостатки: одни относительно точные, но имеют вероятность развития осложнений, достаточно трудоемкие, дорогостоящие, требующие дополнительного оборудования; другие – хотя безопасны, просты и воспроизводят естественные реакции адаптации организма на воспроизводимые воздействия, в то же время косвенны и нуждаются в валидации метода на более обширной группе респондентов.
Значение и роль периферических хеморецепторов в процессе регуляции дыхания неоспоримы, хотя ответы на поставленные в анализе вопросы неоднозначны и остаются открытыми.
Библиографическая ссылка
Трембач Н.В., Трембач И.А., Вейлер Р.В., Мусаева Т.С., Федунец Д.Э., Дряев С.А., Голубцов В.В. СРАВНИТЕЛЬНЫЙ АНАЛИЗ МЕТОДОВ ОЦЕНКИ ЧУВСТВИТЕЛЬНОСТИ ПЕРИФЕРИЧЕСКОГО ХЕМОРЕФЛЕКСА // Современные проблемы науки и образования. 2024. № 1. ;URL: https://science-education.ru/ru/article/view?id=33186 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.33186



