Цель: провести систематический обзор научных статей, опубликованных за последние 10 лет, по базам данных Embase (Elsevier) и eLibrary (РИНЦ) и проанализировать результаты исследований о влиянии ревматоидного артрита на репродуктивную функцию пациентов, фертильность, беременность и исходы родов.
Ревматоидный артрит (РА) – хроническое аутоиммунное заболевание соединительной ткани, которое характеризуется системным воспалительным поражением суставов и внутренних органов, природа которого до сих пор остается неизвестной. Длительное течение заболевания приводит к ранней инвалидности и снижению продолжительности жизни пациентов. РА встречается в любом возрасте и у представителей обоего пола, но преимущественно у женщин (в 3 раза чаще, чем у мужчин), в основном в трудоспособном возрасте, и наиболее часто поражает женщин именно детородного возраста [1].
Фертильность женщин определяется как способность к зачатию после незащищенных половых актов в течение года. Количество детей у женщины зависит от исхода беременностей и может быть меньше, чем ожидалось, вследствие выкидышей, неонатальной и перинатальной смертности. У мужчин фертильность связана с количеством их детей и зависит от качества спермы и имеющихся сексуальных нарушений. Фертильность больных РА мало изучена, ранее считалось, что РА не оказывает прямого действия на репродуктивную способность пациентов, за исключением приема отдельных лекарственных средств (ЛС) [2].
Фертильность у женщин с РА. О снижении фертильности у женщин с РА сообщалось в некоторых исследованиях [3]. Однако возникает вопрос о том, является ли снижение фертильности результатом патологического процесса при заболевании или оно связано с побочными эффектами медикаментозной терапии или индивидуальными решениями о размере семьи, так как ограничению числа детей при РА способствуют не только проблемы, связанные с болезнью, но и снижение возможности заботиться о маленьких детях, опасение негативного воздействия лекарственных препаратов на потомство, боязнь передачи болезни по наследству. Были отмечены нарушения фертильности, связанные с более длительным периодом времени, необходимым пациенткам с РА для наступления беременности [4] по сравнению со здоровыми женщинами, они также более часто проходили курс лечения бесплодия. В частности, 64 забеременевшим из 245 пациенток с РА (31%) потребовалось более 12 месяцев половой жизни до успешного зачатия [4]. Эти 64 женщины вместе с 40 женщинами, которые вообще не забеременели за период исследований, чаще были АНЦА-позитивными (антинейтрофильные цитоплазматические антитела) и чаще принимали нестероидные противовоспалительные препараты (НПВП) и преднизолон. У 40 бесплодных женщин был значительно более высокий уровень активности заболевания, чем у тех, кто забеременел, и у них чаще был положительный ревматоидный фактор. Эти данные показали, что высокая активность заболевания, применение НПВП и преднизолона в суточной дозе >7,5 мг коррелировали с длительным периодом до наступления беременности [3]. Женская фертильность снижается с возрастом, при этом после 30 лет заметно уменьшение количества фолликулов яичников. В нескольких исследованиях изучалось, может ли хроническое воспаление привести к снижению функции и преждевременной недостаточности яичников как результат воздействия различных факторов, включая аутоантитела к ткани половых желез (аутоиммунный оофорит), или как побочный эффект лечения цитотоксическими препаратами. Учитывая, что регулярность менструаций не является надежным критерием, наиболее точным показателем овариального резерва стал антимюллеров гормон (АМГ), который секретируется фолликулами яичника ипоказывает репродуктивный потенциал женщины. Уровень АМГ в сыворотке достаточно стабилен в течение всего менструального цикла и используется для проверки способности яичников производить яйцеклетки. Сообщалось о противоречивых результатах относительно уровня АМГ в сыворотке крови женщин с РА. Было обнаружено значительное снижение уровня АМГ в сыворотке у пациенток, которые не получали терапии цитотоксическими препаратами, по сравнению со здоровыми женщинами того же возраста [5]. Напротив, в другом исследовании уровень АМГ в сыворотке 72 женщин с впервые диагностированным РА, которые не получали фармакотерапию, существенно не отличался от уровня АМГ здоровых женщин того же возраста ни при постановке диагноза, ни через шесть месяцев после него [6].
Фертильность у мужчин с РА. В исследованиях фертильности мужчин использовали оценку различных параметров, таких как состояние половых желез, их гормональная функция, качество спермы, изменения яичек и антиспермальные антитела. У мужчин с РА обнаружен гипогонадизм с низким уровнем биодоступного тестостерона; более того, было показано, что хроническое воспаление влияет на гипоталамо-гипофизарно-гонадную ось, а успешное лечение РА способствует улучшению функции яичек [7].
Влияние противоревматических препаратов на фертильность. Противоревматические препараты могут нарушать фертильность путем воздействия на овуляцию и сперматогенез или путем вмешательства в секрецию гормонов гипофиза и половых желез, а у женщин с РА бесплодие также может быть результатом воздействия препаратов, повышающих риск выкидыша. Результаты некоторых исследований влияния противоревматических препаратов на фертильность обсуждаются ниже.
Управление по контролю за качеством пищевых продуктов и лекарственных препаратов США (FDA) предложило оценивать степень риска применения медикаментов при беременности с использованием буквенных обозначений A, B, C, D и X [8].
В таблице 1 содержится информация о лекарственных средств (ЛС), используемых для лечения РА.
Таблица 1
Риск применения некоторых ЛС при беременности согласно FDA (по П.А. Шестерня, 2017)
|
Риск |
Характеристика |
Препарат |
Комментарии |
|
A |
Адекватные контролируемые исследования не выявили риска для плода в I триместре и отсутствуют доказательства риска в дальнейшем |
– |
– |
|
B |
В эксперименте на животных нет данных о риске для плода; у женщин адекватные контролируемые клинические исследования не проводились |
НПВП |
Неселективные НПВП, кроме перечисленных в C (избегать применения в I и III триместре – категория D) |
|
Сульфасалазин |
Может применяться в течение всего гестационного периода и лактации в дозе < 2 г/сут + фолиевая кислота 5 мг/сут |
||
|
Ингибиторы ФНОα: ЭТА, ИНФ, АДА, ЦЗП |
– |
||
|
АНА |
– |
||
|
C |
В эксперименте на животных выявлены побочные влияния на плод, у женщин адекватные контролируемые клинические исследования не проводились; потенциальная польза может превышать возможный риск |
НПВП |
Целекоксиб, диклофенак, кеторолак, пироксикам, эторикоксиб, мелоксикам, нимесулид |
|
ГКС |
< 15 мг/сут (по преднизолону) |
||
|
Гидроксихлорохин, циклоспорин |
Может применяться в течение всего гестационного периода и лактации в стандартных дозировках |
||
|
РТМ, АБЦ, ТЦЗ |
– |
||
|
D |
Имеется практическое доказательство риска для плода, основанное на экспериментальных данных и клиническом опыте; потенциальная польза лекарства может оправдать его использование у беременных, несмотря на возможный риск |
НПВП |
Все НПВП во II триместре |
|
ГКС |
Дексаметазон, бетаметазон, высокие дозы преднизолона |
||
|
Азатиоприн |
< 2 мг/кг/сут |
||
|
Циклофосфамид |
Только по жизненным показаниям |
||
|
Микофенолата мофетил |
Отмена за 3 месяца |
||
|
X |
Тератогенное действие доказано как у животных, так и у человека. Возможный риск явно превосходит потенциальную пользу |
МТ |
Отмена за 3 месяца + фолиевая кислота 5 мг/сут на протяжении всей беременности |
|
Лефлуномид |
Отмена за 3 месяца, процедура отмывания холестирамином |
Примечание: ГКС – глюкокортикостероиды, НПВП – нестероидные противовоспалительные препараты, МТ – метотрексат, ИНФ – инфликсимаб, ЭТА – этернацепт, АДА – адалимумаб, ЦЗП – цертолизумаб пегол, АНА – анакинра, РТМ – ритуксимаб, АБЦ – абатацепт, ТЦЗ – тоцилизумаб.
Метотрексат используется для лечения заболеваний опорно-двигательного аппарата, дерматологических, желудочно-кишечных, онкологических состояний, а также в акушерстве для прерывания внематочной беременности. Исследование с участием женщин, получавших метотрексат при внематочной беременности, не показало его существенного влияния на овариальный резерв [9], точно так же не снижался уровень АМГ в сыворотке крови женщин с РА, получавших метотрексат [6]. Проспективное контролируемое исследование показало, что частота выкидышей у беременных, принимавших метотрексат в первом триместре, составила 42,5% по сравнению с 14,4% у беременных, подвергшихся воздействию метотрексата в течение 10 недель до зачатия [10]. Данные о возможном влиянии метотрексата на мужскую фертильность противоречивы – у мужчин, получавших метотрексат как часть цитотоксической комбинированной терапии рака, сообщалось об олигоспермии и азооспермии [11, 12].
Сульфасалазин не оказывает отрицательного влияния на женскую фертильность, не тератогенен, поэтому этот препарат можно принимать во время беременности [8]. У мужчин сульфасалазин может вызвать преходящее бесплодие вследствие олигоспермии, нарушения морфологии и снижения подвижности сперматозоидов. В частности, у мужчин с язвенным колитом при лечении сульфасалазином наблюдалась сниженная подвижность сперматозоидов как наиболее частая аномалия у 40–86% больных [13].
Лефлуномид отнесен к категории X по классификации FDA, рекомендованы его отмена за 3 месяца до планируемой беременности или процедура отмывания с помощью холестирамина для снижения уровня метаболитов препарата в крови. Мужчинам, получающим лефлуномид, в период лечения рекомендовано использовать средства контрацепции ввиду возможного фетотоксического действия препарата [14].
Нестероидные противовоспалительные препараты (НПВП) бывают либо неселективными, либо селективными ингибиторами циклооксигеназы (ЦОГ) 1 и ЦОГ 2 – ферментов, необходимых для синтеза простагландинов. Ингибирование синтеза простагландинов в преовуляторную фазу препятствует разрыву стенки фолликула и выходу яйцеклетки – этот феномен называется синдромом лютеинизации неовулировавшего фолликула (ЛНФ). Исследования с участием здоровых женщин и женщин с воспалительными заболеваниями суставов показали, что лечение стандартными дозами индометацина, напроксена, диклофенака, пироксикама, мелоксикама или рофекоксиба в предовуляторную фазу приводило к появлению ЛНФ в 50–100% случаев [15]. В проведенном исследовании синдром ЛНФ был выявлен при интравагинальном УЗИ у 35,6% пациенток, получавших НПВП, по сравнению с 3,4% среди женщин, не получавших НПВП. Следует отметить, что частота синдрома ЛНФ была значительно выше у женщин, получавших селективный ингибитор ЦОГ-2 эторикоксиб, чем у женщин, получавших неселективные ингибиторы ЦОГ, такие как диклофенак, ибупрофен или кетопрофен [15]. Имеются ограниченные данные о влиянии НПВП (например, аспирина и индометацина) на функцию мужских гонад. В исследовании с участием мужчин, которые лечились от бесплодия в клинике и использовали безрецептурные НПВП в течение не менее 6 месяцев, наблюдались снижение объема семенной жидкости, концентрации, качества и подвижности сперматозоидов в зависимости от дозы [16]. Однако при изучении влияния парацетамола, аспирина и индометацина на семенники взрослого человека, вопрос о том, могут ли НПВП снижать фертильность у мужчин при РА, до конца не выяснен [17].
Глюкокортикоиды. Влияние глюкокортикоидов на фертильность связано с их воздействием на гипоталамо-гипофизарно-гонадную ось у пациентов и мужского, и женского пола, также глюкокортикоиды могут действовать непосредственно на гонады, взаимодействуя с рецепторами, присутствующими как на клетках тестикул, так и на клетках яичников [18]. Длительное лечение высокими дозами глюкокортикоидов может ингибировать высвобождение лютеинизирующего гормона и фолликулинстимулирующего гормона, которые необходимы для овуляции. Исследование с участием здоровых женщин показало, что лечение триамцинолоном подавляло подъем уровня лютеинизирующего гормона в середине цикла и способствовало ингибированию овуляции [2]. У мужчин высокие дозы глюкокортикоидов могут снижать уровень тестостерона, а также уменьшать концентрацию сперматозоидов в семенной жидкости [19, 20, 21].
Генно-инженерные биологические препараты (ГИБП), такие как моноклональные антитела и рекомбинантные белки, применяются в ревматологии не так давно, но с большим успехом воздействуют на основные звенья патогенеза РА; представляют новый класс ЛС, в том числе: ингибиторы α-фактора некроза опухоли (ФНОα) – инфликсимаб, адалимумаб, голимумаб, этанерцепт, цертолизумаб пегол; ингибитор рецепторов интерлейкина-6 – тоцилизумаб; блокатор интерлейкина-1 – анакинра; блокатор активации Т-лимфоцитов – абатацепт и анти-В-лимфоцитарный препарат – ритуксимаб [10]. Было установлено, что все ГИБП, а также ингибиторы Янус-киназ (тофацитиниб и барицитиниб) обладают хорошей эффективностью и безопасностью [22] и терапия ГИБП не сопровождается снижением числа беременностей или количества рожденных детей [14]. С учетом физиологической роли ФНОα в сперматогенезе существовали опасения по поводу лечения пациентов мужского пола, поскольку ФНОα продуцируется герминативными клетками яичка, в физиологических дозах ингибирует апоптоз и способствует выживанию этих клеток, но высокие дозы ингибиторов ФНОα нарушают сперматогенез. Однако сравнительные исследования мужчин, получавших ингибиторы ФНОα, и здоровых мужчин не выявили нарушений качества спермы после лечения [23, 24].
Консультирование и лечение. Фертильность больных РА часто игнорируется медицинскими работниками [25]. Недостаточные коммуникативные навыки врачей, отсутствие подготовки в области сексологии и репродукции мешают открытому общению с пациентами по вопросам репродукции [26]. Такие ассоциации, как Arthritis Foundation (США) и Arthritis Care (Великобритания), предлагают брошюры для образования пациентов [27].
При появлении проблем с фертильностью больного следует направить к специалисту по репродукции. Пациентов нужно информировать, что беременность возможна даже при сниженной репродуктивной функции, например при снижении овариального резерва или нарушении сперматогенеза, так как шанс иметь детей значительно увеличивается с помощью вспомогательных репродуктивных технологий [27]. Пока не выяснен вклад РА в развитие преждевременной недостаточности яичников аутоиммунного генеза [28].
Медикаментозная терапия может влиять на фертильность из-за тератогенности или токсичного воздействия применяемых препаратов на половые железы. В этом случае необходимо отложить беременность и установить безопасный интервал между прекращением приема препарата и зачатием. В некоторых случаях коррекция дозировки препарата и сроков медикаментозного лечения может снизить неблагоприятное воздействие препаратов на фертильность, например лечение неселективным ингибитором циклооксигеназы в самой низкой эффективной дозе с перерывом в середине цикла уменьшает риск ингибирования овуляции [29].
Данные о влиянии противоревматических препаратов на фертильность ограничены. Цитостатические препараты, применяющиеся в ревматологии, могут вызывать значительное снижение фертильности у обоих полов [30]. В таких случаях пациентам необходимо объяснить возможность сохранения фертильности и рекомендовать криоконсервацию яйцеклеток и спермы для их возможного использования в репродуктивных технологиях [31, 32]. Исследования других препаратов имеют серьезные недостатки, поскольку они либо не были предназначены для изучения фертильности, либо не учитывали возможные искажающие факторы (например, проблемы с фертильностью партнера, активность заболевания, предшествующие урогенитальные заболевания) или личный выбор, а также редко касались пациентов с РА мужского пола. Побочные эффекты лекарств иногда были основаны на теоретических предположениях, а не на результатах клинических испытаний. Недостаток исследований особенно касается таких «старых лекарств», как НПВП, глюкокортикоиды и метотрексат, которые десятилетиями использовались в ревматологии [33, 34, 35].
Нарушения репродуктивной функции, которые наблюдаются у больных РА, зависят от нескольких факторов, показанных на рисунке.
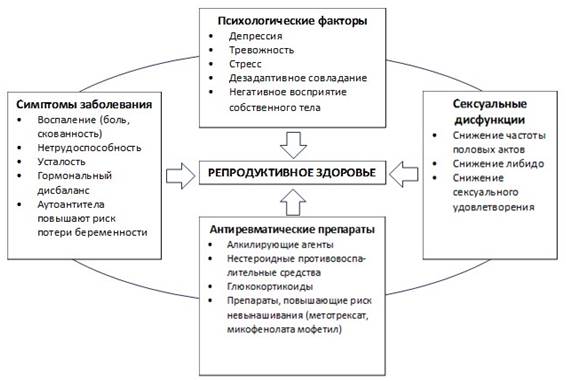 |
Факторы, влияющие на репродуктивное здоровье больных РА [31]
Выводы. Проведенные исследования свидетельствуют о том, что фертильность у женщин с РА снижена по сравнению со здоровыми женщинами аналогичного возраста. Такие факторы, как невынашивание беременности, неонатальная и перинатальная смертность, а также наличие аутоантител, которые вредны для беременности и для плода, по-видимому, способствуют снижению фертильности у женщин с РА. Сниженный овариальный резерв, препараты, подавляющие овуляцию или токсичные для яичников, тератогенные препараты, медицинские рекомендации отложить зачатие вплоть до наступления ремиссии и личные опасения пациенток могут привести к отсрочке или отсутствию зачатия. Пациентки с РА иногда рассматривают добровольную бездетность из-за беспокойства о неблагоприятных репродуктивных исходах или боязни наследственной передачи болезни детям. Немногочисленные исследования фертильности мужчин с РА показали нарушение функции гонад, которое приводит к снижению качества спермы и уровня тестостерона. Нет данных об уменьшении числа детей в семьях мужчин с РА и о проблемах, связанных с зачатием потомства. Поэтому исследования сексуальности и фертильности пациентов с РА остаются актуальными. Первым шагом к решению имеющихся проблем являются осознание важности этих до сих пор табуированных аспектов здоровья человека и готовность обсуждать эту тему с больными РА.
Библиографическая ссылка
Грехов Р.А., Емельянов Н.И. РЕПРОДУКТИВНОЕ ЗДОРОВЬЕ БОЛЬНЫХ РЕВМАТОИДНЫМ АРТРИТОМ // Современные проблемы науки и образования. 2024. № 1. ;URL: https://science-education.ru/ru/article/view?id=33183 (дата обращения: 07.02.2026).
DOI: https://doi.org/10.17513/spno.33183



