Меланома кожи в начале XXXI века остается серьезным злокачественным новообразованием, представляющим угрозу для жизни. Заболеваемость меланомой продолжает расти среди лиц со светлым типом кожи. Меланома слизистых характерна для лиц с более темным типом кожи. Эта разновидность опухоли встречается реже, но бывает более агрессивной в течении.
Меланома кожи поддается успешному лечению на ранних стадиях при помощи хирургических вмешательств. Однако при диссеминированных формах опухоли варианты лечения становятся ограниченными, и показатели выживаемость снижаются в значительной степени. Меланома кожи, как и другие злокачественные опухоли, формируется в результате разивающихся в клетках генетических и эпигенетических изменений, которые до сих пор недостаточно изучены [1]. Одними из характерных эпигенетических регуляторов канцерогенеза являются микроРНК [2].
МикроРНК – это некодирующие РНК, которые контролируют экспрессию генов, взаимодействуя с целевой мРНК и либо вызывая ее распад, либо ингибируя процесс трансляции. Процесс синтеза микроРНК начинается в ядре клетки, где образуется первичный транскрипт, известный как прай-микроРНК. Затем под действием нуклеазы-РНКазы III типа образуются молекулы микроРНК размером примерно 60–70 нуклеотидов. Эти молекулы связываются с экспортином и перемещаются в цитоплазму. Фермент Dicer формирует асимметричный дуплекс микроРНК, который взаимодействует с РНК-индуцированным комплексом сдвига (комплексом RISC), в результате образуется зрелая, функционально активная микроРНК [3]. МикроРНК регулируют многочисленные процессы канцерогенеза, но их функционирование также связывают с развитием лекарственной устойчивости опухолей – процессы уклонения от апоптоз-индуцирующих стимулов, фенотипического перепрограммирования, модификации молекулярных мишеней и репарации ДНК опухолевых клеток находятся под регуляторным воздействием микроРНК [4].
Дакарбазин является химиотерапевтическим препаратом, эффекты которого связаны с повреждением ДНК посредством ее алкилирования с последующей индукцией апоптоза. Эффективность дакарбазина низкая, но вместе с тем он остается референсным средством для создания новых способов лекарственной терапии при меланоме.
Целью данного исследования являлось соотнесение транскриптомного профиля и профиля микроРНК клеток меланомы, сохранявших жизнеспособность после воздействия дакарбазином, для определения новых маркеров и механизмов развития лекарственной устойчивости.
Материал и методы исследования
Культивирование клеток меланомы
Клеточную линию меланомы кожи человека BRO культивировали в среде DMEM (ООО НПП «ПанЭко», Москва, Россия) с добавлением 10% эмбриональной бычьей сыворотки (FBS) (HyClone, GmbH, Паршинг, Австрия) и 1% раствора антибиотик/антимикотик (Gibco Life Technologies, Гранд-Айланд, Нидерланды) в инкубаторе (Sanyo Electric Co. Ltd., Япония) при 37°С и 5% CO2. При достижении монослоя с конфлюэнтностью 80% клетки подвергались дезагрегации методом трипсинизации и рассеву для дальнейших экспериментов. В питательную среду без добавления антибиотика вносили дакарбазин в концентрации 1.2 мМ и культивировали в CO2 инкубаторе в течение 72 ч при 37°С. В качестве контроля использовали клетки с добавлением растворителя дакарбазина – диметилсульфоксид (ДМСО) (Helicon, Москва, Россия). Через 72 часа клетки промывали фосфатно-солевым раствором (PBS) (Helicon, Москва, Россия), помещали в свежую среду без цитостатика и инкубировали еще 48 часов. По завершении инкубации клетки повторно промывали PBS и приступали к дальнейшим экспериментам.
Микрочипирование микроРНК
В исследовании микроРНК использовалась система GeneAtlas Microarray System (Affymetrix, Inc, США). Образцы РНК подвергали мечению с помощью Flash TagTM Biotin HSR Labeling kit (Thermo Fisher Scientific, USA). Концентрацию и чистоту образцов проверяли с помощью прибора Qubit® 2.0. (Invitrogen, USA). Для анализа использовали 100 нг общей РНК. Гибридизацию производили на чипе Affymetrix miRNA 4.1 Array Strip при 48°C в течение 20 часов. Результаты обрабатывали с помощью программы Transcriptome Analysis Console v. 4.0.3. (Affymetrix, USA). Дифференциально-экспрессируемые микроРНК отбирали на основе статистической значимости (p<0,05) и кратности различий (2 и более), используя коэффициент ложного обнаружения FDR. Контроль качества проводили на каждом этапе с использованием GeneAtlas Transcriptome Analysis Console (TAC) и комплекса реагентов Hybridization Control Kit (Thermo Fisher Scientific, USA).
Микрочипирование мРНК
Для анализа транскриптома клеток меланомы BRO образцы тотальной РНК нормализовали до концентрации 250 нг/мкл. Затем синтезировали кДНК в два этапа, амплифицировали кРНК, осуществляли ее очистку с использованием магнитных частиц, и на ее основе синтезировали в целевую ДНК, фрагментировали целевую ДНК и подвергали мечению. Гибридизация выполнялась на микрочипе, детектировался в последующем флуоресцентный сигнал и производился анализ дифференциально-экспрессируемых транскриптов на основе статистической значимости (p<0,05), коэффициента ложного обнаружения FDR и кратности различий (2 и более).
Биоинформатический анализ
Анализ сигнальных путей, которые регулируются измененными микроРНК, был проведен с использованием интернет-ресурса DIANA-mirPath v.3.0, который основывается на Киотской энциклопедии генов и геномов [5]. Уровень значимости составлял p<0.05.
Для анализа дифференциально экспрессирующихся генов-мишеней с точки зрения их биологической значимости и для выявления наиболее значимых сигнальных путей, в которых они участвуют, был использован метод анализа обогащения (ORA).
Статистический анализ
Программа Transcriptome Analysis Console (TAC) v. 4.0.1 использовалась для обработки данных, выполнения статистического анализа и визуализации результатов. Этот инструмент предоставил нам необходимые средства для расчета поправки на множественную проверку гипотез по методу Беньямини–Хохберга. Для подтверждения надежности результатов мы провели контроль качества, который включал в исследование только те гены, у которых значение FDR<0.05.
Результаты исследования и их обсуждение
В клетках, сохранявших жизнеспособность после воздействия дакарбазином, было определено изменение уровня более чем 8000 мРНК, 36 микроРНК. При анализе профиля экспрессии микроРНК в клеточной линии меланомы BRO после воздействия дакарбазином обнаружено статистически значимое (p <0,05) повышение экспрессии микроРНК hsa-miR21-5p и hsa-miR-146a-5p в 7 и 6,93 раза соответственно относительно контрольной группы. При этом обнаружено статистически значимое снижение (p <0,05) экспрессии микроРНК hsa-miR-320a и hsa-miR-6871-5p в 2,77 и 2,73 раза соответственно относительно контрольной группы.
Проведенный в ходе исследования полнотранскриптомный мРНК анализ клеток меланомы BRO до и после воздействия дакарбазином определил статистически значимые изменения экспрессии 8279 генов (p<0,05). У 3519 генов повысилась экспрессия после воздействия дакарбазином по сравнению с контрольной группой, у 4760 генов снизилась экспрессия после воздействия дакарбазином. Результаты транскриптомного профилирования клеток меланомы после воздействия дакарбазином были загружены в базу данных ArrayExpress Archive E-MTAB-11399 (https://www.ebi.ac.uk/arrayexpress/experiments/E-MTAB-11399).
Таким образом, hsa-miR-21-5p являлась микроРНК с наиболее повышенной экспрессией после воздействия с дакарбазином. Известно, что изменения уровня данной микроРНК наблюдаются при многих типах злокачественных новообразований. В ряде исследований hsa-miR-21-5p рассматривается как своеобразный регуляторный «хаб» в опухолевых клетках. Действительно, согласно транскриптомному исследованию мРНК определили, что 278 генов, являющихся мишенью hsa-miR-21-5p, показали изменение экспрессии в клетках меланомы после воздействия дакарбазином более чем в 2 раза. При этом у 246 наблюдалось повышение экспрессии, у 32 – снижение (рис. 1).
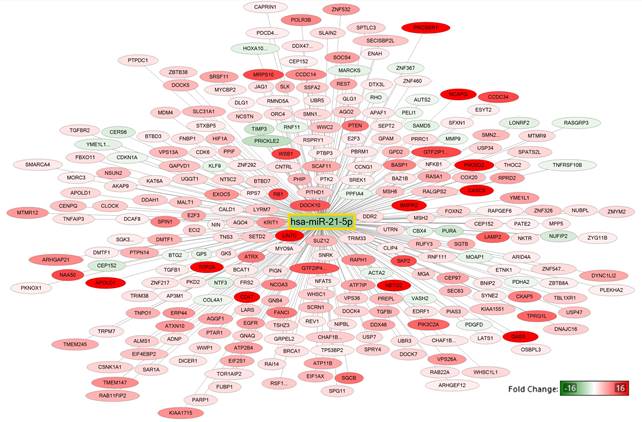
Рис. 1. Гены-мишени hsa-miR-21-5p, измененные более чем в 2 раза по результатам полнотранскриптомного анализа мРНК. В квадрате обозначена микроРНК с измененным уровнем экспрессии (p<0,05), а в овалах представлены ее гены-мишени: красным цветом показаны с повышенной экспрессией, зеленым – с пониженной
Биоинформатический анализ сигнальных путей (KEEG) 278 генов-мишеней микроРНК hsa-miR-21-5p с измененной экспрессией после воздействия дакарбазином выявил как один из наиболее обогащенных измененными транскриптами сигнальных путей сигнальный каскад формирования лекарственной устойчивости к препаратам платины. Устойчивость реализуется путем нарушения процессов репарации ошибочно спаренных нуклеотидов, тем самым повышается толерантность к химиотерапевтическому препарату платины. Также повышается активность механизмов эксцизионной репарации нуклеотидов, тем самым нивелируется повреждающее действие химиотерапевтических препаратов. Вероятно, что аналогичные процессы происходят при воздействии на опухолевые клетки алкилирующего агента дакарбазина [6].
Согласно проведенному биоинформатическому анализу, гены-мишени микроРНК hsa-miR-21-5p с измененной экспрессией являются внутриклеточного сигнального каскада, регулирующего клеточный цикл в фазах G1 и S. Компонентами данного механизма внутриклеточной сигнализации являются дифференциально измененные мРНК генов ATRX, NIPBL, TGFB, SKP2, RB, CDK4 и ORK4, участвующие в реализации процессов хода клеточного цикла, процессов клеточного старения [7].
На рисунке 1 показаны результаты выполненного анализа с применением метода анализа обогащения (ORA), демонстрирующие высокую регуляторную активность hsa-miR-21-5p в клетках меланомы. Стоит обратить внимание, что большинство генов-мишеней этой микроРНК характеризовались повышением экспрессии, а та меньшая часть, у которой снижалась экспрессия, демонстрировала относительно невысокие уровни изменений. Таким образом, стоит предположить, что hsa-miR-21-5p активно регулирует процессы, связанные с лекарственной устойчивостью опухолевых клеток.
Помимо hsa-miR-21-5p к микроРНК с наиболее измененным уровнем после воздействия на клетки меланомы дакарбазина относится hsa-miR-146a-5p. Анализ полнотранскриптомных данных мРНК также показал статистически значимую дисрегуляцию 81 гена-мишени hsa-miR-146a-5p. Из них 63 гена показали увеличение экспрессии, в то время как у 17 генов наблюдалось снижение уровня экспрессии (рис. 2).
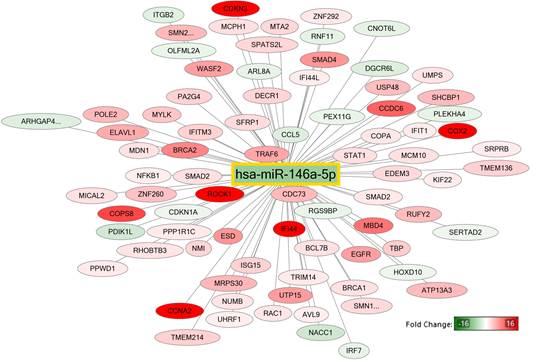
Рис. 2. Гены-мишени hsa-miR-146a-5p, измененные более чем в 2 раза по результатам полнотранскриптомного анализа мРНК. В квадрате обозначена микроРНК с измененным уровнем экспрессии (p<0,05), а в овалах представлены ее гены-мишени: красным цветом показаны с повышенной экспрессией, зеленым – с пониженной
Биоинформатический анализ сигнальных путей (KEEG) вышеуказанных 81 гена показал, что генами-мишенями hsa-miR-146a-5p являются ингибитор циклинзависимой киназы 1А (CDKN1A), транскрипционные факторы-опухолевые супрессоры SMAD2, SMAD4, циклин А2 (CCNA2), участвующие также в регуляции клеточного цикла в S, G2 и M-фазах [8, 9, 10]. Данные изменения могут свидетельствовать о нарушениях динамики клеточного цикла, происходящих в клетках меланомы под воздействием дакарбазина. Это согласуется с известными данными о механизмах действия алкилирующих агентов – противоопухолевых препаратов. Вместе с тем, если ранее предполагалось, что остановка клеточного цикла неизбежно связана с необратимым процессом клеточного старения и последующим развитием апоптоза, то сейчас становится очевидным, что клеточное старение может быть обратимым, а значит, опухолевые клетки с поврежденным геномом могут далее пролиферировать, обеспечивая еще большую гетерогенность опухоли и ее прогрессию в последующем.
Интересно, что 9 генов-мишеней hsa-miR-21-5p и hsa-miR-146a-5p были общими, что может иметь важное значение для понимания биологических изменений, связанных с этими молекулами микроРНК. В число измененных генов входят столь важный регулятор процессов репарации ДНК BRCA1, а также вышеупомянутый CDKN1A, участвующий в формировании фенотипа клеточного старения, ген NFKB1, кодирующий многофункциональный одноименный белок – транскрипционный фактор, опосредующий процессы воспаления, апоптоза, пролиферации гена. Таким образом, микроРНК hsa-miR-21-5p и hsa-miR-146a-5p вызывают повышение уровня генов, участвующих в процессах репарации ДНК в опухолевых клетках и переключении их фенотипа, позволяющем сохранять жизнеспособность в условиях действия неблагоприятных факторов.
К числу микроРНК, уровни которых были снижены в клетках меланомы после воздействия дакарбазином, относятся hsa-miR-320a и hsa-miR-6871-5p. Генами-мишенями hsa-miR-320a были гены, кодирующие белки цитоскелета TUBA1А, TUBA1B, ACTG1, а также гены, кодирующие белки, участвующие в осуществлении контактов с внеклеточным матриксом (LMNB1) и реализации апоптоза (MCL1), что вместе свидетельствует об изменении характера взаимодействия с внеклеточным матриксом (рис. 3). Последнее может быть связано с процессами сохранения жизнеспособности опухолевых клеток и избеганием апоптоза в метастатических нишах, а также с процессом метастазирования. По результатам полнотранскриптомного исследования мРНК наблюдалась дисрегуляция 32 генов-мишеней hsa-miR-6871-5p. Экспрессия 24 генов снизилась, 8 – повысилась более чем в 2 раза (рис. 4). hsa-miR-6871-5p посредством регуляции генов E2F3, MCM7 и BUB1, возможно, влияет на G1, S и G2 фазы клеточного цикла, супрессируя ход клеточного цикла.
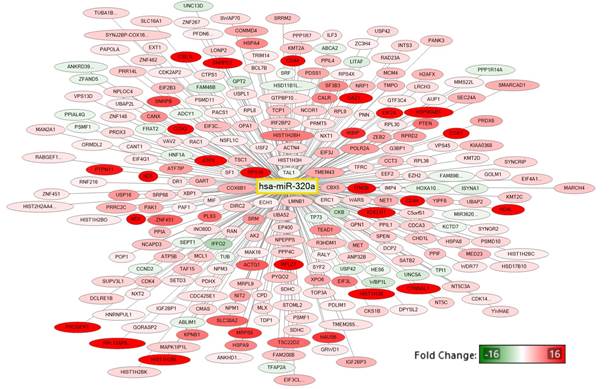
Рис. 3. Гены-мишени hsa-miR-320a, измененные более чем в 2 раза по результатам полнотранскриптомного анализа мРНК. В квадрате обозначена микроРНК с измененным уровнем экспрессии (p<0,05), а в овалах представлены ее гены-мишени: красным цветом показаны с повышенной экспрессией, зеленым – с пониженной
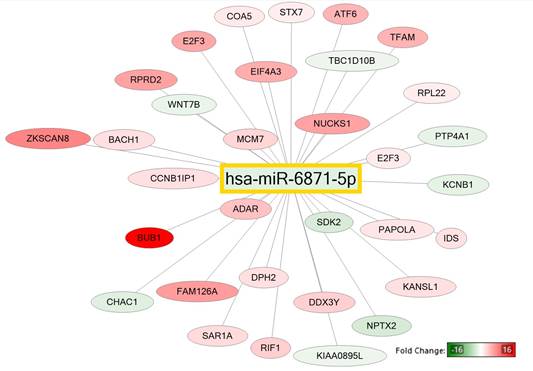
Рис. 4. Гены-мишени hsa-miR-6871-5p, измененные более чем в 2 раза по результатам полнотранскриптомного анализа мРНК. В квадрате обозначена микроРНК с измененным уровнем экспрессии (p<0,05), а в овалах представлены ее гены-мишени: красным цветом показаны с повышенной экспрессией, зеленым – с пониженной
Выводы
Исследование, проведенное на клетках меланомы BRO после воздействия дакарбазином, выявило значительные изменения в экспрессии генов и микроРНК. Эти результаты показывают вовлеченность микроРНК в процессы перепрограммирования транскриптома, возникающего в опухолевых клетках в ответ на действие повреждающего фактора – противоопухолевого агента дакарбазин.
По результатам исследования профиля экспрессии микроРНК было показано статистически значимое повышение экспрессии hsa-miR21-5p и hsa-miR-146a-5p, а также статистически значимое снижение экспрессии hsa-miR-320a и hsa-miR-6871-5p после инкубации клеток с дакарбазином. Эти результаты указывают на потенциальную важность этих микроРНК в механизмах ответа на лечение дакарбазином.
Дальнейший биоинформатический анализ транскриптома клеток и профилирования микроРНК показал наибольшие изменения в процессах регуляции репарации ДНК, избегания апоптоза, а также хода клеточного цикла. Клетки меланомы при воздействии дакарбазина демонстрируют фенотипическую пластичность, выражающуюся в переходе в непролиферирующее состояние и позволяющую сохранять жизнеспособность.
Библиографическая ссылка
Зинченко И.С., Рукша Т.Г. МЕХАНИЗМЫ ЭПИГЕНЕТИЧЕСКОЙ РЕГУЛЯЦИИ ЛЕКАРСТВЕННОЙ УСТОЙЧИВОСТИ КЛЕТОК МЕЛАНОМЫ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33179 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33179



