Проблема повышения эффективности лечения больных ургентными заболеваниями живота остается в центре внимания современной хирургии. В первую очередь, это определяется сохраняющейся высокой вероятностью развития различных осложнений, которые могут приводить к фатальному исходу [1–3].
Одной из важнейших причин развития неблагоприятного течения острых заболеваний органов брюшной полости является чрезмерно повышенный уровень токсинов. В патогенезе синдрома эндогенной интоксикации важную роль играет не только избыточная продукция эндотоксинов, но и снижение функциональной активности органов детоксикационной системы, в том числе почек [4]. Несмотря на существующее мнение, что почки являются медленно повреждаемым органом [5], в результате многочисленных исследований в почках обнаруживаются весьма существенные функциональные и структурные изменения при воспалительных процессах в других органах. Эти нарушения проявляются уменьшением дезинтоксикационной, синтетической и экскреторной функций, нарушениями водно-солевого обмена и щелочно-кислотного равновесия [6, 7].
В связи с этим актуальным является исследование особенностей поражения органов детоксикационной системы в зависимости от экстренной абдоминальной патологии, сопровождающейся асептическим или гнойным воспалением [8].
Цель исследования – определение ключевых механизмов поражения почек в зависимости от характера воспалительного процесса: асептического (на примере ранней фазы острого панкреатита) и гнойного (на примере острого перитонита).
Материал и методы исследования
Проведено обследование 72 пациентов с острыми абдоминальными заболеваниями. Они были разделены на 2 группы в зависимости от вида патологии. Первая группа (n=34) включала больных с острым гнойным местным перитонитом в возрасте 53,1±3,4 года, мужчин было 20 (58,8%), а женщин – 14 (41,2%). Вторая группа (n=38) состояла из пациентов с острым отечным панкреатитом средней степени тяжести в возрасте 48,5±2,8 года, мужчин было 21 (55,3%), женщин – 17 (44,7%).
Критерии выбора исследуемых. Возраст – 30–65 лет, пол – женский и мужской, письменное согласие на участие в исследовании, сопутствующие заболевания в стадии компенсации; оперативное лечение проведено пациентам первой группы, консервативная терапия – второй группы.
Критерии исключения – отказ пациента от исследования, тяжелые сопутствующие заболевания, нарушения исследовательского протокола, обнаружение признаков панкреонекроза, требующего оперативного лечения, летальный исход.
В качестве контроля для сравнения изучаемых параметров с референсными показателями в исследовании участвовали здоровые люди (n=16, возраст – 35,2±5,7 года, среди них было 10 мужчин и 6 женщин).
Все больные первой группы с острым гнойным местным перитонитом аппендикулярного генеза были оперированы, выполнены типичная аппендэктомия, санация и дренирование брюшной полости, интраоперационно диагностирован местный гнойный перитонит.
Пациентам второй группы с острым отечным панкреатитом проводилось стандартное комплексное консервативное лечение в соответствии с известными российскими клиническими рекомендациями [9].
Тяжесть обоих заболеваний оценивалась по шкале APACHE-II при госпитализации больных в клинику. При остром перитоните количество баллов составило 7,63±0,51, при остром панкреатите – 7,23±0,43 (р>0,05), что соответствовало среднетяжелому состоянию [10].
Наличие, характер и тяжесть острого панкреатита наряду с клинической картиной верифицировались при помощи лабораторных показателей (активность амилазы, фосфолипазы А2 в плазме крови и моче) и инструментальных методов диагностики (УЗИ, КТ).
Пациентам в динамике в течение 7 суток пребывания в стационаре (1-е сутки – первый этап; 2-е сутки – второй; 4–5-е сутки – третий; 7-е сутки – четвертый этап) проводилось комплексное инструментальное и лабораторное обследование, включающее общие анализы крови и мочи, биохимические исследования крови и мочи, УЗИ, КТ и иное, и ряд специальных исследований.
В крови (по содержанию первичных продуктов – диеновых конъюгатов, вторичных продуктов – малонового диальдегида) и в моче (по содержанию малонового диальдегида) оценивали активность оксидативного стресса [11, 12], по уровню фосфолипазы А2 определена активность фосфолипаз [13].
Явления эндотоксемии устанавливали по содержанию гидрофильных токсинов в крови – молекулам средней массы (МСМ λ=254 и МСМ λ=280 нм) [14], гидрофобных токсинов – индексу токсичности плазмы (ИТ) и резерву связывания альбумина (РСА), рассчитанных на основе эффективной (ЭКА) и общей (ОКА) концентрации альбумина: РСА=ЭКА/ОКА; ИТ=ОКА/ЭКА-1 [15].
Функциональное состояние почек определено при помощи следующих показателей: уровню креатинина и мочевины в крови и моче, минутному диурезу, клубочковой фильтрации, уровню МСМ в моче.
Статистическую обработку проводили с использованием пакета статистических программ Microsoft Excel 2013 и Statistica 6.1 с расчетом дескриптивных показателей: средней арифметической выборочной совокупности (М), ошибки средней арифметической (m), уровня значимости (p), коэффициента корреляции (r) – и непараметрического метода – критерия согласия Пирсона (χ2).
Результаты исследования и их обсуждение
Для корректного достижения поставленной цели перед авторами, прежде всего, стояла задача адекватного подбора больных различными ургентными заболеваниями живота, что позволило бы провести сравнительную оценку функционального состояния почек в ранние сроки заболевания.
Как указано выше, с этой целью в этой работе применена система оценки тяжести по шкале APACHE-II.
Другим оценочным маркером сравнительной характеристики выраженности нарушений гомеостаза избрана выраженность эндогенной интоксикации, которая определена по содержанию в крови токсинов гидрофильной и гидрофобной природы (табл. 1). Важно отметить, что эндотоксемия является одним из основных компонентов патогенетического процесса ургентных патологий живота, вызывая нарушение системы гомеостаза, утяжеление течения заболевания, и функциональной полиорганной недостаточности, особенно почечной [11].
Таблица 1
Маркеры эндотоксикоза у пациентов с острым перитонитом и острым панкреатитом
|
Показатель |
Группа |
Норма |
Этапы периода наблюдения |
|||
|
1-е сутки |
2-е сутки |
4-5-е сутки |
7-е сутки |
|||
|
МСМ (λ=254 нм), у.е. |
I |
232,1± 12,7 |
518,3± 22,3* |
477,2± 25,8* |
374,3± 21,0* |
297,5± 22,1* |
|
II |
487,5± 25,0* |
488,1± 27,3* |
391,1± 25,0* |
271,8± 25,1* |
||
|
МСМ (λ= 280 нм) у.е. |
I |
309,2± 19,3 |
600,3± 32,7* |
537,5± 28,7* |
475,1± 25,9* |
377,9± 21,7* |
|
II |
558,3± 27,5* |
563,2± 29,1* |
503,3± 28,4* |
401,7± 23,8* |
||
|
ЭКА, г/л |
I |
47,2± 2,8 |
20,3± 1,5* |
17,4± 1,7* |
21,9± 1,9* |
28,4± 1,9* |
|
II |
24,3± 1,9* |
20,1± 2,1* |
23,6± 2,7* |
26,7± 2,6* |
||
|
РСА, у.е. |
I |
0,75± 0,03 |
0,48± 0,04* |
0,51± 0,04* |
0,57± 0,03* |
0,63± 0,04* |
|
II |
0,52± 0,05* |
0,50 0,04* |
0,52± 0,04* |
0,60± 0,03* |
||
|
ИТ, у.е. |
I |
0,21± 0,02 |
0,97± 0,05* |
0,92± 0,04* |
0,61± 0,05* |
0,51± 0,04* |
|
II |
0,85± 0,06* |
0,88± 0,07* |
0,74± 0,06* |
0,63± 0,05* |
||
Примечание: I – острый перитонит; II – острый панкреатит; * – статистически значимые отличия от показателей нормы (p<0,05); жирный шрифт – статистически значимые отличия от данных I группы (p<0,05); МСМ – молекулы средней массы; ЭКА – эффективная концентрация альбумина; РСА – резерв связывания альбумина; ИТ – индекс токсичности плазмы по альбумину.
Установлено, что при сравнительной оценке уровня токсинов в обеих группах пациентов в ранние сроки (до 7 суток) существенных отличий между группами не было. Только на третьем и четвертом этапах периода наблюдения индекс токсичности по альбумину при остром панкреатите (0,74±0,06 и 0,63±0,05) был выше, чем при остром перитоните (0,61±0,05 и 0,51±0,04) на 21,3% и 23,5% (p<0,05) соответственно (табл. 1). Это, по всей видимости, обусловлено тем, что к этому времени явления острого перитонита существенно регрессировали, тогда как при остром панкреатите воспалительные изменения в поджелудочной железе еще сохранялись.
Лабораторно-инструментальными исследованиями установлено, что при выбранных заболеваниях независимо от характера воспалительного процесса отмечались заметные нарушения функционального состояния почек, при этом их выраженность в начальные сроки заболевания различалась существенно (табл. 2).
Таблица 2
Некоторые показатели функционального состояния почек при остром перитоните и остром панкреатите
|
Показатель |
Группа |
Норма |
Этапы периода наблюдения |
|||
|
1-е сутки |
2-е сутки |
4-5-е сутки |
7-е сутки |
|||
|
Креатинин плазмы крови, мкмоль/л |
I |
84,6±6,2 |
124,6±9,4* |
143,3±8,3* |
153,5±7,5* |
137,1±6,9* |
|
II |
148,1±10,2* |
201,1±9,0* |
127,9±7,1* |
102,3±7,4* |
||
|
Креатинин мочи, мкмоль/л |
I |
14,3±1,5 |
18,17±1,76* |
20,34±1,88* |
23,31±1,65* |
19,27±1,35* |
|
II |
25,32±1,92* |
25,08±1,65* |
19,65±1,72* |
17,53±1,73* |
||
|
Мочевина крови, ммоль/л |
I |
4,88±0,11 |
9,15±0,68* |
12,62±0,59* |
16,32±0,62* |
12,09±0,55* |
|
II |
12,36±0,51* |
17,37±0,63* |
12,08±0,81 |
8,13±0,60* |
||
|
Минутный диурез, мл/мин. |
I |
1,24±0,04 |
1,12±0,05* |
0,99±0,06* |
0,91±0,07* |
1,08±0,06* |
|
II |
0,88±0,06* |
0,73±0,04* |
1,08±0,05* |
1,15±0,05 |
||
|
Клубочковая фильтрация, мл/мин. |
I |
123,3±6,2 |
110,6±5,2* |
106,9±6,1* |
100,2±5,1* |
103,3±6,3* |
|
II |
93,3±4,4* |
91,2±5,2* |
106,2±4,8* |
112,7±5,8 |
||
Известно, что развитие острых хирургических заболеваний органов брюшной полости приводит к ухудшению глобулярной функции, снижению реабсорбции, прогрессированию тубулоинтерстициальной дисфункции, нарушению локального метаболизма в почках и почечной депрессии [16, 17].
Нами показано, что у больных острым панкреатитом уровень креатинина в плазме крови через сутки (первый этап исследования) был выше, чем таковой при остром перитоните, на 11,9% (p<0,05), на втором этапе исследования – на 40,3% (p<0,05).
На третьем этапе отмечено уменьшение его содержания при остром панкреатите по сравнению с острым перитонитом на 16,3% (p<0,05), а на четвертом этапе (7 суток) – на 25,4% (p<0,05).
Динамика изменений содержания креатинина в моче аналогична. Его уровень на первом этапе при остром панкреатите был выше такового при остром перитоните на 39,4% (p<0,05), на втором – на 23,3% (p<0,05), а на третьем этапе отмечено уменьшение на 15,7% (p<0,05).
В ранние сроки заболеваний зарегистрированы изменения уровня мочевины в крови. Динамика ее содержания соответствовала таковой у креатинина. Так, на первом этапе ее концентрация была выше при остром панкреатите, чем при остром перитоните, на 35,1% (p<0,05), на втором – на 37,6%, а на третьем и четвертом этапах, напротив, уменьшалась на 26,0% и 32,8% (p<0,05) соответственно.
Различия на начальных этапах исследованных патологий установлены и в отношении минутного диуреза. На первых двух этапах он при остром панкреатите был меньше, чем при остром перитоните, на 21,4% и 26,3% (p<0,05) соответственно, а на третьем этапе, напротив, больше на 18,7% (p<0,05).
Основой тому явились различия клубочковой фильтрации, которая при остром панкреатите на первых двух этапах была меньше, чем при остром перитоните, на 15,6% и 14,7% (p<0,05) соответственно. В последующих этапах она была выше при остром панкреатите, хотя статистически не значимо.
Интересные данные получены при исследовании содержания в моче веществ средней молекулярной массы (рисунок).
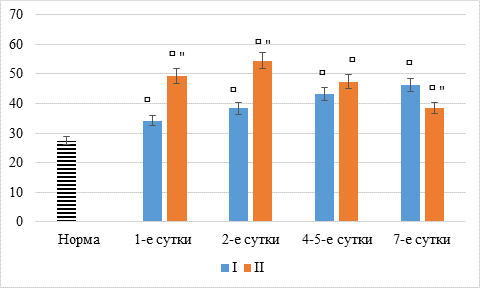
Динамика МСМ: ⸋ – статистически значимые отличия от показателей нормы (p<0,05); " – статистически значимые отличия от данных первой группы (p<0,05)
Оказалось, что при остром панкреатите их уровень на первых двух этапах (1 и 2 суток) было выше, чем при остром перитоните, на 43,3% и 42,3% (p<0,05) соответственно. На последующих же этапах их концентрация была выше при остром перитоните, причем на четвертом этапе статистически значимо – на 16,9 % (p<0,05).
Таким образом, анализ результатов по оценке функционального состояния почек показывает, что при остром панкреатите острое поражение почек происходит быстрее, чем при остром гнойном перитоните.
В исследованиях по установлению механизмов поражения почек при ургентных болезнях живота получены весьма значимые данные (табл. 3).
В литературе приводятся данные о том, что на фоне формирования ургентных заболеваний живота накопление токсических метаболитов в крови и органах сопровождается активацией перекисного окисления липидов и фосфолипазной реакции, увлечением концентрации свободных радикалов, ухудшением функциональности мембраны, дисфункцией внутренних органов, в том числе почек, прогрессированием заболевания, развитием осложнений [11].
Таблица 3
Маркеры перекисного окисления липидов (МДА) и фосфолипазной активности (фосфолипазы А2) в моче при остром перитоните и остром панкреатите
|
Маркер |
Группа |
Норма |
Этапы периода наблюдения |
|||
|
1-е сутки |
2-е сутки |
4–5-е сутки |
7-е сутки |
|||
|
МДА, мкмоль/л |
I |
1,27± 0,12 |
3,87± 0,35* |
3,92± 0,32* |
3,08± 0,30* |
2,63± 0,23* |
|
II |
1,73± 0,22* |
1,88± 0,30* |
1,91± 0,23* |
1,41± 0,31 |
||
|
Фосфолипаза А2, у.е. |
I |
0,21± 0,018 |
0,28± 0,041 |
0,35± 0,052* |
0,30± 0,031* |
0,27± 0,034 |
|
II |
0,85± 0,061* |
1,12± 0,076* |
1,36± 0,059* |
0,95± 0,052* |
||
Оказалось, что выраженность процессов перекисного окисления мембранных липидов в тканевых структурах почек, судя по содержанию в моче одного из молекулярных продуктов – малонового диальдегида, при остром панкреатите была меньше, чем при остром перитоните на первом этапе, на 55,3% (p<0,05), на втором – на 52,0% (p<0,05), на третьем – на 38,0 % (p<0,05), на конечном этапе (7 суток) – на 46,4% (p<0,05) (табл. 3).
При исследовании выраженности фосфолипазной активности установлено, что при остром панкреатите в начальные сроки активность фосфолипазы А2 в моче при остром панкреатите была значительно выше, чем при остром перитоните. Так, на первом этапе периода наблюдения ее активность была выше на 203,6% (p<0,05), на втором – на 220,0% (p<0,05), на третьем – на 353,3% (p<0,05), на четвертом этапе – на 251,9% (p<0,05).
Полученные результаты свидетельствуют о том, что при развитии острых заболеваний живота, в том числе острого панкреатита и перитонита, в системе гомеостаза развиваются эндогенная интоксикация, достоверная интенсификация процессов перекисного окисления липидов, активизация фосфолипазы А2, что обусловливает срыв функционального состояния почек.
Анализ полученных нами данных показал, что между показателями функционального состояния почек и активностью основных триггеров поражения мембран клеток почек имеется тесная корреляционная связь (r=0,734–0,955, р<0,05).
Выводы
1. Поражение почек при сравнительно сопоставимых явлениях эндогенной интоксикации возникает быстрее при остром панкреатите (асептический воспалительный процесс), чем при остром перитоните (гнойной воспалительный процесс): в первые трое суток у больных острым панкреатитом уровень креатинина в плазме крови выше, чем при остром перитоните, на 11,9–40,3% (p<0,05); мочевины – на 35,1–37,6% (p<0,05); минутный диурез меньше на 21,4–26,3% (p<0,05); клубочковая фильтрация – на 14,7–15,6% (p<0,05), уровень МСМ в моче больше на 42,3–43,3% (p<0,05).
2. Ведущим триггером поражения почек при остром гнойном перитоните в ранние сроки (до 7 суток) служит оксидативный стресс, при остром асептическом панкреатите – избыточная активность фосфолипаз: содержание в моче малонового диальдегида при остром панкреатите меньше, чем при остром перитоните, на 38,0–55,3% (p<0,05); активность фосфолипазы А2 выше на 203,6–353,3% (p<0,05).
Библиографическая ссылка
Власов А.П., Рязанцев В.Е., Дуваяров З.А., Мышкина Н.А., Синявина К.М., Машнин И.В., Ларина В.С. НАРУШЕНИЕ ФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ПОЧЕК ПРИ РАЗЛИЧНОМ ВОСПАЛИТЕЛЬНОМ ПРОЦЕССЕ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33178 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33178



