Широкое распространение новой коронавирусной инфекции (НКВИ) COVID-19, вызванной вирусом SARS-CoV-2, было признано 11 марта 2020 г. Всемирной организацией здравоохранения (ВОЗ) пандемией, завершение которой объявлено 05.05.2023 г. В настоящее время, несмотря на улучшение общей ситуации по COVID-19, продолжает выявляться много случаев заболевания и регистрируются новые штаммы вируса, что вызывает тревогу. Согласно данным ВОЗ, по состоянию на 08.11.2023 г. в мире было зарегистрировано 771 820 937 подтвержденных случаев заболевания и 6 978 175 летальных исходов; в Российской Федерации по данным от 30.10.2023 г. выявлено 2 3124 717 подтвержденных случаев COVID-19, число умерших составило 400 256 человек [1]. Высокая контагиозность инфекции, вариабельность клинического течения болезни и большое количество тяжелых, осложненных форм заболевания, а также отсутствие эффективной этиотропной терапии привели к высокой летальности и значительным социально-экономическим потерям. Поэтому во всем мире проводятся изучение механизмов развития и особенностей течения болезни, совершенствование и поиск новых методов диагностики и лечения. Результаты этих исследований имеют большое значение для практического здравоохранения.
Важная роль в любом лечебном процессе отводится объективной оценке тяжести состояния больного и раннему выявлению осложнений болезни. Правильная интерпретация лабораторных, инструментальных и клинических данных позволяет понять механизмы развития патологического процесса, прогнозировать течение болезни и обосновать выбор лечебной тактики. При этом среди множества лабораторных и клинических показателей следует ориентироваться на параметры, которые имеют тесные корреляционные связи с тяжестью патологического процесса и обладают высокой значимостью и специфичностью с болезнью. С этих позиций актуальность изучения взаимосвязи лабораторных показателей и клинических данных, их корреляции с тяжестью течения и исходом болезни у больных с COVID-19, особенно при осложненных формах заболевания, не вызывает сомнения. Такое исследование представляет научный интерес и имеет практическое значение.
Цель исследования – изучение взаимосвязи клинико-лабораторных показателей с исходом заболевания у больных с тяжелой COVID-ассоциированной пневмонией.
Материалы и методы исследования. Проведено обсервационное исследование «случай-контроль» на базе отделения анестезиологии, реанимации и интенсивной терапии (ОАРИТ) Государственного бюджетного учреждения Республики Саха (Якутия) «Якутская республиканская клиническая больница (ГБУ РС(Я) «ЯРКБ») в период 2020–2023 гг. В исследование включен 591 пациент, объем выборки рассчитан на программе G.Power 3.1. методом случайных чисел. Всем пациентам проводилась терапия согласно актуальным на момент их лечения в ОАРИТ Временным методическим рекомендациям МЗ РФ по профилактике, диагностике и лечению новой коронавирусной инфекции (COVID-19).
Протокол исследования был одобрен локальным комитетом по биомедицинской этике ФГАОУ ВО «Северо-Восточный федеральный университет им. М.К. Аммосова» (№ 25 от 07.10.2020 г., решение № 4). Критерии включения в исследование – пациенты в возрасте 18 лет и более, находившиеся на лечении в ОАРИТ, с диагнозами U07.1 «COVID-19, вирус идентифицирован» и U07.2 «предполагается COVID-19, вирус не идентифицирован», течение которых осложнилось тяжелой COVID-19-ассоциированной пневмонией (поражение более 50% легких по результатам компьютерной томографии (КТ)). Критерии исключения: пациенты, умершие в течение 12 часов после госпитализации в ОАРИТ; отсутствие подтверждения НКВИ COVID-19 (лабораторного, клинического и эпидемиологического); пациенты, лечение которых по разным причинам не соответствовало временным рекомендациям по лечению пациентов с НКВИ COVID-19; пациенты, переведенные в другие больницы в связи с развитием острой хирургической патологии, острого нарушения мозгового кровообращения, острого коронарного синдрома; беременные и женщины в раннем послеродовом периоде (менее 2 месяцев после родов); пациенты без тяжелой пневмонии (поражение по РКТ менее 50%); сопутствующая онкологическая патология 4-й стадии и/или недавнее (менее 3 месяцев) лечение онкологического заболевания – химиотерапия, лучевая терапия; ранее выполненная вакцинация (иммунопрофилактика COVID-19).
Проведен факторный анализ клинических показателей, таких как: возраст, тяжесть заболевания по шкалам APACHE II (Acute Physiology Age Chronic Health Evaluathion II) и SOFA (The Sepsis-related Organ Failure Assessment), уровень сознания по шкале ком Глазго (ШКГ), уровень сатурации смешанной крови и индекса оксигенации при поступлении, а также определены клинические и биохимические лабораторные показатели.
Статистический анализ выполнен с использованием программы IBM SPSS Statistics, версия 26.0.0.0. Проверка показателей на нормальность распределения была проведена с помощью критерия Колмогорова–Смирнова с поправкой Лиллиефорса (при n>50) и критерия Шапиро–Уилка (при n<50), при p-value>0,05 – распределение нормальное. После проверки при распределении, отличном от нормального, описательная статистика проведена с помощью Ме (медианы) и IQR (межквартильный интервал), сравнительный непараметрический анализ проведен с помощью U-критерия Манна–Уитни для бинарных совокупностей. При нормальном распределении рассчитаны среднее значение и стандартное отклонение; использованы параметрические методы – оценка дисперсий проведена с помощью критерия Ливиня, при p>0,05 выбран t-критерий Стьюдента, при p<0,05 – t-критерий Стьюдента в модификации Уэлча. Факторная нагрузка для исследованных показателей установлена после проведения вращения «Варимакс». В корреляционной матрице выделены основные компоненты, определен вклад каждой компоненты в суммарную дисперсию, извлечение ведущих компонент согласно их собственному значению представлено на графике «scree plot» («каменистой россыпи»). Вычислена мера выборочной адекватности Кайзера–Мейера–Олкина, оценка распределения переменных проведена с помощью критерия сферичности Бартлетта.
Результаты исследования и их обсуждение
Результатом факторного анализа клинико-лабораторных показателей и расчетных шкал стали матрица факторных нагрузок и определение 13 компонент – факторов, сформированных из параметров с высокими корреляционными взаимосвязями (табл. 1).
Таблица 1
Матрица факторных нагрузок клинико-лабораторных показателей у больных с тяжелой COVID-19-ассоциированной пневмонией
|
№ |
Показатель |
Факторы |
||||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
||
|
1 |
Креатинин |
,820 |
-,069 |
-,156 |
-,040 |
-,027 |
,085 |
-,012 |
,012 |
,141 |
,110 |
-,010 |
,080 |
-,066 |
|
2 |
Мочевина |
,795 |
,049 |
-,049 |
-,067 |
,062 |
,055 |
-,128 |
,158 |
,094 |
-,053 |
,057 |
,222 |
,001 |
|
3 |
СКФ |
-,787 |
-,041 |
-,063 |
,000 |
-,074 |
-,043 |
,148 |
-,097 |
-,006 |
-,003 |
,101 |
,046 |
-,052 |
|
4 |
Прокальцитонин |
,682 |
-,106 |
-,176 |
,083 |
,157 |
,151 |
,127 |
,077 |
-,097 |
-,142 |
,199 |
-,123 |
-,003 |
|
5 |
Лейкоциты |
-,037 |
,923 |
,023 |
-,320 |
,158 |
-,073 |
-,053 |
,071 |
,079 |
-,044 |
,061 |
,120 |
,005 |
|
6 |
Нейтрофилы, абс. |
-,038 |
,904 |
,027 |
-,338 |
,146 |
-,057 |
-,060 |
,060 |
,054 |
-,058 |
,048 |
,112 |
,004 |
|
7 |
Тромбоциты |
,008 |
,468 |
-,015 |
,011 |
-,093 |
,086 |
,217 |
-,193 |
-,198 |
,103 |
-,068 |
-,255 |
-,225 |
|
8 |
Гематокрит |
-,162 |
,069 |
,887 |
-,011 |
-,034 |
-,118 |
,080 |
,035 |
,006 |
,040 |
,126 |
,067 |
-,041 |
|
9 |
Гемоглобин |
-,164 |
,089 |
,900 |
,046 |
-,081 |
-,098 |
,067 |
,012 |
-,014 |
,045 |
,073 |
,070 |
-,060 |
|
10 |
Эритроциты |
,048 |
-,103 |
,587 |
-,081 |
,121 |
-,104 |
,038 |
-,050 |
-,017 |
,034 |
-,005 |
-,052 |
,000 |
|
11 |
RDW |
,061 |
-,380 |
-,405 |
-,183 |
,165 |
,005 |
-,060 |
,026 |
,077 |
,178 |
,092 |
,137 |
-,212 |
|
12 |
Нейтрофилы, % |
,010 |
,389 |
,073 |
-,884 |
-,009 |
-,054 |
-,033 |
-,015 |
-,081 |
-,045 |
-,002 |
,000 |
,039 |
|
13 |
Лимфоциты, % |
-,055 |
-,317 |
,019 |
,871 |
,070 |
-,022 |
-,028 |
,083 |
-,002 |
-,005 |
-,018 |
-,041 |
-,080 |
|
14 |
Лимфоциты, абс. |
,074 |
,493 |
,034 |
,666 |
,045 |
-,258 |
,017 |
-,055 |
,088 |
,112 |
,084 |
,117 |
-,022 |
|
15 |
Шкала SOFA |
,129 |
,048 |
,010 |
,003 |
,883 |
-,075 |
,015 |
-,009 |
-,033 |
,096 |
,058 |
,078 |
,056 |
|
16 |
Шкала APACHЕ II |
,061 |
,047 |
-,064 |
,123 |
,814 |
,110 |
-,083 |
,310 |
-,008 |
,095 |
-,075 |
,046 |
-,012 |
|
17 |
Шкала ком Глазго |
-,146 |
-,249 |
-,111 |
,037 |
-,548 |
-,184 |
-,164 |
,197 |
,022 |
,342 |
-,253 |
-,029 |
-,014 |
|
18 |
СРБ |
,200 |
-,054 |
-,103 |
-,082 |
,027 |
,775 |
,008 |
,041 |
-,037 |
,077 |
,074 |
,000 |
,055 |
|
19 |
СОЭ |
,161 |
-,084 |
-,299 |
,049 |
-,022 |
,715 |
,040 |
,045 |
-,084 |
-,069 |
-,014 |
-,018 |
,095 |
|
20 |
ИЛ-6 |
,046 |
,022 |
,004 |
-,055 |
-,008 |
-,557 |
,217 |
,033 |
-,068 |
,007 |
,327 |
-,020 |
,419 |
|
21 |
Фибриноген |
-,050 |
,094 |
-,056 |
-,113 |
,131 |
,469 |
,146 |
,075 |
-,005 |
,087 |
,441 |
-,030 |
-,053 |
|
22 |
АСТ |
-,056 |
-,041 |
,034 |
,068 |
,014 |
,045 |
,875 |
,028 |
-,034 |
-,029 |
-,026 |
,153 |
-,009 |
|
23 |
АЛТ |
-,156 |
,084 |
,202 |
-,026 |
-,029 |
-,073 |
,825 |
,010 |
,031 |
,075 |
-,083 |
-,003 |
-,017 |
|
24 |
Ферритин |
,121 |
,067 |
,008 |
,079 |
,172 |
,115 |
,192 |
,805 |
,003 |
,074 |
-,050 |
-,079 |
-,177 |
|
25 |
Фракция выброса |
-,025 |
,106 |
-,072 |
,037 |
,029 |
-,010 |
,072 |
-,678 |
-,084 |
,079 |
-,067 |
-,103 |
-,058 |
|
26 |
NT-proBNP |
,408 |
,026 |
-,188 |
,062 |
,048 |
-,015 |
,020 |
,618 |
-,079 |
-,042 |
-,032 |
,040 |
,019 |
|
27 |
Тропонин I |
,109 |
,104 |
,024 |
-,015 |
,071 |
,005 |
-,057 |
,390 |
-,125 |
-,022 |
-,044 |
,095 |
,089 |
|
28 |
Сатурация |
,097 |
,006 |
,026 |
,047 |
,014 |
-,063 |
,023 |
-,022 |
,896 |
-,028 |
-,065 |
-,038 |
,063 |
|
29 |
Индекс оксигенации |
,034 |
-,013 |
-,071 |
,051 |
-,063 |
-,022 |
-,035 |
,052 |
,877 |
-,063 |
-,056 |
-,051 |
-,006 |
|
30 |
ЛДГ |
-,074 |
,124 |
,193 |
,109 |
-,110 |
,253 |
,016 |
,008 |
-,041 |
,639 |
,202 |
,319 |
079 |
|
31 |
Альбумин |
-,039 |
,048 |
,190 |
,198 |
-,154 |
,056 |
,053 |
,064 |
-,123 |
-,581 |
,146 |
,087 |
,027 |
|
32 |
Гликированный Hb |
,069 |
,008 |
,187 |
,057 |
,016 |
-,002 |
-,154 |
-,014 |
-,119 |
-,007 |
,687 |
-,039 |
,007 |
|
33 |
Общая креатинкиназа |
,242 |
-,026 |
,072 |
,122 |
,008 |
,038 |
,249 |
-,203 |
-,024 |
,127 |
-,167 |
,533 |
,007 |
|
34 |
Общий билирубин |
-,156 |
-,064 |
-,141 |
-,192 |
,171 |
-,148 |
,269 |
,040 |
,033 |
-,275 |
,190 |
,516 |
-,126 |
|
35 |
Креатинкиназа МВ |
,014 |
-,025 |
-,005 |
-,027 |
,231 |
,063 |
-,039 |
-,085 |
-,017 |
,006 |
-,088 |
,386 |
,266 |
|
36 |
Д-Димер |
,069 |
,075 |
-,066 |
-,188 |
,029 |
,304 |
,181 |
,262 |
-,040 |
-,165 |
,053 |
-,282 |
,394 |
Примечание. СКФ – скорость клубочковой фильтрации, RDW – ширина распределения эритроцитов, ШКГ – шкала ком Глазго, СРБ – С-реактивный белок, СОЭ – скорость оседания эритроцитов, ИЛ-6 – интерлейкин-6, АСТ – аспартатаминотрансфераза, АЛТ – аланинаминотрансаминаза, ПКТ – прокальцитонин, ФВ – фракция выброса, NT – proBNP-N-концевой прогормон мозгового натрийуретического пептида, ЛДГ – лактатдегидрогеназа, Hb – гемоглобин.
Фактор 1 представлен имевшими прямые корреляционные связи показатели в крови креатинина (+0,820), мочевины (+0,795), прокальцитонина (+0,682) и обратную связь со скоростью клубочковой фильтрации – СКФ (-0,782), отражает функцию почек и определен авторами как «почечная дисфункция». Заметим, что наряду с признанными маркерами выделительной функции почек – показателей мочевины, креатинина и СКФ, представлен прокальцитонин. Действительно, в последнее время прокальцитонин (предшественник гормона кальцитонина) рассматривается как потенциальный маркер нарушения функции почек, и во многих исследованиях отмечалось увеличение его уровня у пациентов с хронической почечной недостаточностью даже при отсутствии инфекции [2, 3]. В метаанализе 28 исследований, включавших результаты лечения 18 043 взрослых пациентов с COVID-19, который провели R. Passoni и соавт., одним из предикторов острого почечного повреждения являлась вторичная инфекция, что также сопровождалось повышением уровня прокальцитонина [4]. Почечная дисфункция является независимым предиктором летального исхода при COVID-19 [5].
Фактор 2 объединен показателями абсолютных значений лейкоцитов (+0,923), нейтрофилов (+0,904), тромбоцитов (+0,468) и интерпретирован как «лейкоцитарно-тромбоцитарная ассоциация».
Фактор 3 сформирован показателями эритроцитов крови (+0,587), гематокрита (+0,887), гемоглобина (+0,900) и RDW (–0,405), обозначен как «анемия».
Фактор 4 представлен удельными и абсолютными значениями лимфоцитов (+0,871 и +0,666) и удельным значением нейтрофилов (–0,884) и определен как «нейтрофильно-лимфоцитарная диссоциация». Срыв клеточного иммунитета при COVID-19 приводит к повышенной продукции нейтрофилов и апоптозу лимфоцитов, поэтому сочетание нейтрофилии и лимфоцитопении специфично для больных и коррелирует с тяжестью течения заболевания [6].
Фактор 5 включил оценку тяжести состояния при поступлении – шкалы SOFA (+0,883), APACHE II (+0,814) и уровень сознания по ШКГ (–0,584). Данный фактор представлен как «тяжесть состояния при поступлении». Применение указанных шкал сегодня является обязательным требованием для объективной оценки тяжести состояния больных реанимационного профиля и имеют тесную корреляционную связь [7]. При COVID-19 высокие баллы SOFA и APACHE II ассоциируются с неблагоприятным исходом [8].
Фактор 6 объединил показатели с прямой корреляционной связью – СРБ (+0,775), СОЭ (+0,715), фибриноген (+0,469), и с обратной связью – ИЛ-6 (–0,557), что было обозначено как «системное воспаление». СРБ, СОЭ, ИЛ-6 и уровень фибриногена используют в качестве маркеров воспалительного процесса; безусловно, они отражают тяжесть течения COVID-19, являются проявлением цитокинового шторма, и их высокие значения свидетельствуют о высоком риске неблагоприятного исхода [9, 10].
Фактор 7 характеризуется прямыми корреляционными связями с АСТ (+0,875) и АЛТ (+0,825), определен как «печеночная дисфункция». Повышение трансаминаз характерно для острой печеночной недостаточности, и ее развитие при COVID-19 обусловлено прямым цитотоксическим повреждением печеночных клеток вирусом SARS-CoV-2, гипоксическим гепатоцитолизом, а также побочным гепатотоксическим действием препаратов, используемых в лечении больных, и коррелирует с летальным исходом [11].
Фактор 8 включил прямую корреляционную связь ферритина (+0,805), NT-proBNP (+0,618) и тропонина I (+0,390), обратную связь с фракцией выброса (–0,678), назван «ферритин и повреждение миокарда». Если взаимосвязь NT-proBNP – мозгового натрийуретического гормона, образующегося в левом желудочке сердца и используемого для диагностики сердечной недостаточности, тропонина I и ФВ понятна, то их взаимосвязь с ферритином (железопротеид, выполняющий функцию основного внутриклеточного депо железа) требует объяснения. На гиперферритинемию было обращено внимание с самого начала лечения больных с COVID-19, и сегодня мнения о ее причине остаются спорными. Например, по мнению Ю.А. Полушина и соавторов, причина повышения в крови уровня ферритина является результатом не нарушения обмена железа и не гемотоксического действия вируса, а обусловлено его ролью как острофазного белка при цитокиновом шторме. При этом авторы отмечают, что различие уровней ферритина в группах выживших и умерших значимо (р=0,0013), а повышение его уровня в крови до 1000 мкг/л является прогностическим признаком высокой вероятности летального исхода [12]. О значении высокого уровня ферритина как маркера активности воспалительного процесса и прогноза при COVID-19 указано в работе М.И. Каледы, Е.С. Федорова [13]. Действительно, в настоящее время ферритин рассматривается не только как показатель запаса железа в организме человека, но и как провоспалительный и иммунокорригирующий маркер. Влияние повреждения миокарда на течение болезни не вызывает сомнения и подтверждено метаанализом 13 исследований, включавших результаты лечения 2389 пациентов, который выявил, что повышение тропонина I, свидетельствующее о повреждении миокарда, у больных с COVID-19 повышает риск летального исхода в 7,95 раза [14].
Фактор 9 объединил показатели сатурации смешанной крови (+0,896) и индекс оксигенации (+0,877), обозначен как «гипоксемия». Гипоксемия является одним из ключевых маркеров тяжести течения COVID-19 и служит независимым предиктором летального исхода, что подтверждают результаты исследований [15].
Остальные факторы имеют умеренные корреляционные связи (менее 0,7), собственные значения которых были менее 1,5 (рис.).
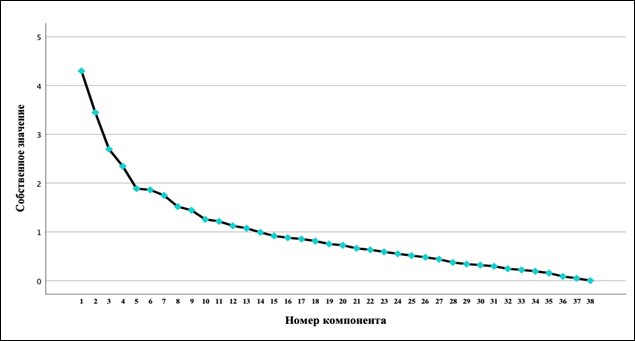
Диаграмма «scree plot»
Фактор 10 объединил ЛДГ с альбумином, и с учетом, что изменения их уровней наблюдаются при ишемии тканей, назван «генерализованная ишемия». Повышение ЛДГ как маркера ишемии тканей и снижение альбумина, отражающего тяжесть сепсиса, коррелируют при COVID-19 с летальным исходом [16].
Факторы 11 и 13 представлены отдельными показателями, которые не имели корреляционных связей с другими лабораторными и клиническими параметрами, – это гликированный гемоглобин и Д-димер соответственно.
Высокие значения Д-димера у пациентов с COVID-19, как правило, связаны с активацией коагуляции на фоне системного воспаления, являются маркером тяжелого течения и летального исхода [17].
Фактор 12 объединил общую креатинкиназу, общий билирубин и креатинкиназу МВ (СК-МВ), что, по мнению авторов, связано с повышенным повреждением клеток при COVID-19; он обозначен как «клеточное повреждение».
Вклад каждого из определенных 13 факторов варьировал от 8,2 до 3,4%, а общий суммарный вклад составил 68,8% (табл. 2).
Таблица 2
Характеристика факторов (компонент)
|
Фактор |
Собственные значения |
Удельный вклад в дисперсию, % |
|
|
Каждой компоненты, % |
Накопленный, % |
||
|
1 |
2,930 |
8,2 |
8,2 |
|
2 |
2,670 |
7,0 |
15,2 |
|
3 |
2,547 |
6,9 |
22,1 |
|
4 |
2,464 |
6,5 |
28,6 |
|
5 |
2,145 |
5,6 |
34,2 |
|
6 |
2,057 |
5,4 |
39,6 |
|
7 |
2,042 |
5,4 |
45,0 |
|
8 |
1,836 |
4,8 |
49,8 |
|
9 |
1,806 |
4,8 |
54,6 |
|
10 |
1,416 |
3,7 |
58,3 |
|
11 |
1,373 |
3,6 |
61,9 |
|
12 |
1,322 |
3,5 |
65,4 |
|
13 |
1,310 |
3,4 |
68,8 |
Оценка качества выполненного факторного анализа свидетельствует о его адекватности и результативности. Так, возможность применения факторного анализа к данной выборке подтверждается значением критерия Кайзера–Мейера–Олкина, который составил 0,630 и расценивается как удовлетворительная адекватность. Оценка распределения переменных с помощью критерия сферичности Бартлетта показала высокий уровень значимости – p<0,0001, что также свидетельствует о приемлемости данного факторного анализа.
Далее авторами описаны и сравнены характеристики 13 полученных факторов в группах с благоприятным и неблагоприятным исходами для определения среди них наиболее значимых. Для этого проведено сравнение средних значений каждого извлеченного фактора у выживших и умерших, рассчитанных ранее в факторном анализе. Напомним, что гликированный гемоглобин (11-й фактор) и Д-димер (13-й фактор) однокомпонентные, поэтому проанализированы как отдельные показатели. Статистически значимые различия (p<0,05) в группах «выжившие»/«умершие» имелись у объединенных факторов: почечная дисфункция (р=0,007), нейтрофильно-лимфоцитарная диссоциация (р=0,002), тяжесть состояния при поступлении (р<0,001), гипоксемия (р<0,001), генерализованная ишемия (р<0,001) – и однокомпонентного фактора – D-димера (р<0,001) (табл. 3).
Таблица 3
Сравнительный анализ факторов в группах «выжившие»/«умершие»
|
№ |
Фактор |
Выжившие, n=200 |
Умершие, n=391 |
p-value |
|
1 |
Почечная дисфункция, Me [IQR] |
-0,37 [-0,64;-0,12] |
-0,18 [-0,58;0,2] |
0,007* |
|
2 |
Лейкоцитарно-тромбоцитарная ассоциация, Me [IQR] |
0,14 [-0,45;0,66] |
-0,1 [-0,7;-0,55] |
0,090 |
|
3 |
Анемия, Me [IQR] |
-0,02 [-0,57;0,37] |
-0,01 [-0,55;-0,51] |
0,394 |
|
4 |
Нейтрофильно-лимфоцитарная диссоциация, Me [IQR] |
0,14 [-0,39;0,83] |
-0,23 [-0,59;0,48] |
0,002* |
|
5 |
Тяжесть состояния при поступлении, Me [IQR] |
-0,59 [-1,04;-0,13] |
-0,11 [-0,61;0,27] |
<0,001* |
|
6 |
Системное воспаление, M±SD |
-0,1±0,1 |
0,001±0,07 |
0,416 |
|
7 |
Печеночная дисфункция, Me [IQR] |
-0,29 [-0,61;0,27] |
-0,18 [-0,54;0,40] |
0,062 |
|
8 |
Ферритин и повреждение миокарда, Me [IQR] |
-0,17 [-0,47;0,21] |
-0,08 [-0,46;0,25] |
0,300 |
|
9 |
Гипоксемия, Me [IQR] |
0,66 [-0,25;0,99] |
0,07 [-0,68;0,66] |
<0,001* |
|
10 |
Генерализованная ишемия, Me [IQR] |
-0,34 [-0,67;0,17] |
0,01 [-0,41;0,54] |
<0,001* |
|
11 |
Гликированный гемоглобин, %, Me [IQR] |
6,5 [5,4;7,4] |
6,4 [5,6;7,3] |
0,924 |
|
12 |
Клеточное повреждение, Me [IQR] |
-0,28 [-0,55;0,12] |
-0,12 [-0,44;0,22] |
0,075 |
|
13 |
Д-Димер, мг/мл, Me [IQR] |
402 [240;782] |
581 [330;1042] |
<0,001* |
Примечание: p – value-уровень значимости, * – различия статистически значимы, Me – медиана, IQR – интерквартильный интервал, M – среднее, SD – стандартное отклонение.
Заключение
Таким образом, результаты факторного анализа клинико-лабораторных параметров у больных с тяжелой COVID-ассоциированной пневмонией показали, что основными факторами, ассоциированными с летальным исходом, являются дисфункция почек, дисбаланс иммунной системы, исходная тяжесть состояния больного при поступлении в ОАРИТ, тяжесть гипоксии и гиперкоагуляция.
Лабораторные данные и клинические параметры отражают патофизиологические процессы, происходящие в организме больного, а их правильная оценка и интерпретация позволяют объективно оценить тяжесть состояния больного, прогнозировать течение и исход болезни. Полученная информация может быть использована для обоснования тактики ведения больного, определения объема медицинской помощи, оценки эффективности и коррекции проводимой терапии, что в итоге будет способствовать увеличению числа положительных исходов лечения.
Библиографическая ссылка
Чулакова Н.А., Потапов А.Ф., Иванова А.А., Чулаков К.В. ОЦЕНКА ВЗАИМОСВЯЗИ КЛИНИКО-ЛАБОРАТОРНЫХ ПОКАЗАТЕЛЕЙ С ИСХОДОМ ЛЕЧЕНИЯ У ПАЦИЕНТОВ С ТЯЖЕЛОЙ COVID-19-АССОЦИИРОВАННОЙ ПНЕВМОНИЕЙ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33174 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33174



