Ожирение на сегодняшний день является важнейшей проблемой современной педиатрии [1], а также известным фактором риска сахарного диабета. Распространенность ожирения и сахарного диабета в популяции неуклонно растет [2]. Наиболее распространенным является конституционально-экзогенное ожирение (КЭО). Нарушение углеводного обмена у детей с КЭО напрямую связано с избыточным углеводистым питанием данной категории пациентов. Проведенные исследования [3] указывают на преобладание легкоусвояемых углеводов: частые (до 3-4 раз в день) перекусы с включением бутербродов, пирожков, булочек, хот-догов, гамбургеров, картофеля-фри, хлопьев, статистически достоверно более частое употребление в пищу по сравнению с детьми без ожирения высококалорийных продуктов из картофеля, мучных изделий, сладких кондитерских блюд. Как пример следует отметить, что дети с ожирением в 26,1% предпочитают употребление чая с добавлением на 1 чашку 3-4 чайных ложек сахара. В этой связи особый интерес вызывает изучение ожирения внутри семьи, влияние материнского ожирения в диаде «мать-дитя» [4]. Выявлено, что к 2-3 годам жизни дети, рожденные от матерей с ожирением, статистически значимо имеют повышенную массу тела в сравнении с контролем [5].
История развития и прогрессирования ожирения у подростков может проходить по двум основным патогенетическим вариантам: развитие гипертонической болезни или нарастание метаболических нарушений с формированием сахарного диабета 2-го типа (СД2) [6]. Нарушение углеводного обмена при метаболическом синдроме характеризуется гиперинсулинемией, инсулинорезистентностью, нарушенной толерантностью к углеводам, а также СД2 [7; 8].
Эпидемиологический анализ последних лет показывает, что ожирение увеличивает общий риск развития не только СД2, но и сахарного диабета первого типа (СД1), в основе которого лежит абсолютный дефицит инсулина на фоне аутоиммунного инсулита. Ю.Г. Самойлова и соавт. [9] при изучении распространённости ayтoaнтитeл y детей и подростков c ожирением, как предиктора нарушений углеводного обмена, выявили маркеры аутоиммунного поражения: ZnT8A (антитела к транспортepy цинкa-8), IA2 (антитела к тиpoзинфocфaтaзe), IAA (антитела к инсулину), GADA (антитела к глyтaмaтдeкapбoкcилaзe) и IСA (антитела к островковым клеткам поджелудочной железы) у 46,6-55% детей с ожирением (при первом и повторном иммунологическом обследовании). Наиболее часто (у 13,2-10,5% детей с ожирением) встречалась комбинация ZnT8A+IА2A. В Дании также обнаружили зависимость повышения индекса массы тела (ИМТ) у детей в возрасте 7-13 лет с риском развития СД1 [10]. Чрезмерно высокий ИМТ у здоровых в остальном подростков израильской когорты связан с повышенным риском развития сахарного диабета 1-го типа в раннем взрослом возрасте [11].
Исследование TrialNet (международная сеть ведущих академических институтов и медицинских коллективов, занимающаяся профилактикой СД1) выявило ассоциацию ожирения у подростков в возрасте от 13 до 20 лет с повышенным риском развития СД1 [12]. Другое исследование TrialNet группы детей до 12 лет установило связь ожирения и избыточной массы тела с более частым выявлением множественных положительных аутоантител, которые характерны для СД1 [13]. Отмечено, что имеются определенные гендерные особенности при возникновении коморбидной патологии у детей с КЭО: более частое возникновение артериальной гипертензии, повреждение печени у лиц мужского пола [14].
Таким образом, ожирение может быть одним из факторов, способствующих увеличению распространенности не только СД2, но и СД1, поэтому представляется интересным исследование углеводного обмена в данной группе пациентов.
Цель исследования: сравнить уровень глюкозы натощак, выявляемость нарушения гликемии натощак и характер сахарной кривой при нагрузочном тесте у детей с конституционально-экзогенным ожирением и с нормальной массой тела.
Материал иметоды исследования. Методом «копия-пара» проведен ретроспективный анализ уровня глюкозы в капиллярной крови глюкозооксидазным методом у 186 пациентов с избыточной массой тела (ИМТ) и конституционально-экзогенным ожирением (96 девочек и 90 мальчиков), а также 186 детей группы контроля (дети без ожирения, у которых исключена эндокринная патология). Проведен анализ метаболических показателей (общий холестерин и липиды крови, уровень мочевой кислоты в крови и моче, сахарная кривая, микроальбуминурия, мочевой осадок) у детей основной и контрольной групп. Медиана возраста всех детей с избыточной массой тела и конституционально-экзогенным ожирением составила 13 [min 3,9; max 17] лет. Группа с ИМТ составила 37 детей (медиана SDS ИМТ +1,5 [+1,1; +1,9]), с ожирением I степени – 57 (+2,3 [+2,0; +2,5] SDS), II степени – 49 (+2,75 [+2,6; +3,0] SDS), III степени – 31 (+3,4 [+3,1; +3,9] SDS), IV – 12 (+ 4,0 [+4,0; +4,5] SDS). Ни у одного ребенка в обследуемых группах на момент обследования не было сахарного диабета, а также типичных клинических симптомов заболевания. Медиана возраста детей без ожирения составила 14 [1,5; 17] лет.
Медиана ИМТ детей с КЭО равнялась 28,76 [19,63; 49,35] кг/м2, группы контроля - 17,8 [5,61; 23,67] кг/м2.
Средний показатель ИМТ детей с КЭО – 28,97±4,787 кг/м2, контроль – 17,69±3,002 кг/м2.
Медиана SDS индекса массы тела (SDS ИМТ) всех детей с КЭО составила +2,6 [min +1,1; max +4] SDS, контроль - –0,5 [min –3,0; max +1,0].
Средний показатель SDS ИМТ детей с КЭО +2,55±0,757, контрольной группы - –0,69±1,075.
Для определения достоверности различий применялся критерий Стьюдента (t-критерий). Различия считались значимыми при вероятности принятия гипотезы р < 0,01.
За нормогликемический диапазон были приняты: показатель глюкозы крови натощак 3,3-5,5 ммоль/л; нарушенная гликемия натощак - 5,6<6,3 ммоль/л; нарушение толерантности к глюкозе – натощак <6,3 и/или через 2 часа после нагрузки глюкозой при проведении стандартного (перорального) глюкозотолерантного теста ≥ 7,8 ммоль/л; диагноз сахарный диабет может быть поставлен при повторном значении глюкозы в капиллярной крови натощак ≥ 6,3 ммоль/л и/или через 2 часа после нагрузки глюкозой ≥ 11,1 ммоль/л, а также при наличии характерных симптомов в сочетании со случайным выявленным уровнем гликемии ≥ 11,1 ммоль/л. Нарушение толерантности к глюкозе и нарушенную гликемию натощак рассматривают как промежуточные стадии между нормальным углеводным обменом и сахарным диабетом (ISPAD, 2009; 2018).
Для нагрузки использовался эквивалент 75 г безводной глюкозы, растворенной в воде, или в дозе 1,75 г/кг массы тела до максимальной дозы 75 г (ISPAD, 2009).
Результаты исследования и их обсуждение
Анализ результатов глюкозы крови у детей с ожирением выявил, что из 186 детей плоская сахарная кривая регистрировалась у 26 детей (14,0%), нарушение гликемии натощак у 13 детей (7,0%); у детей без ожирения соответственно - 8 (4,3%) и 2 (1,1%), рис. 1.
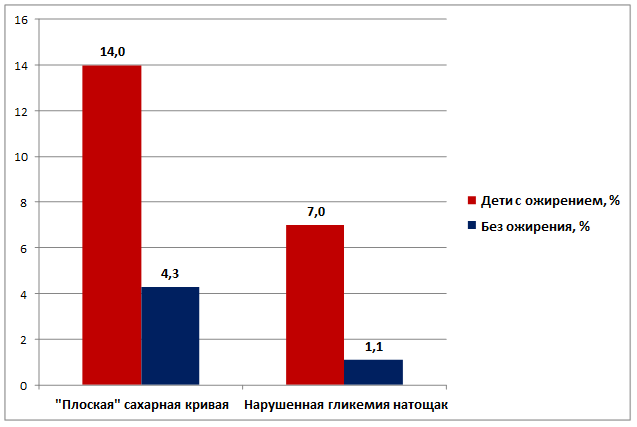
Рис. 1. Частота регистрации «плоской» сахарной кривой и нарушенной гликемии натощак у детей с ожирением и без ожирения
Дети с ожирением достоверно чаще, чем дети без ожирения, имели такие изменения, как плоская сахарная кривая (p=0.0012002237), НТГ (p=0.0037316266).
Плоская сахарная кривая (ОШ = 3,69 [95% ДИ 1,59-8,22]) и нарушение гликемии натощак (ОШ = 6,91 [95% ДИ 1,54-31,08]) достоверно ассоциируются с ожирением. Шансы развития указанных углеводных нарушений у детей с КЭО в 3,69-6,91 раза (соответственно) выше по сравнению с группой контроля (табл.).
Медиана показателя глюкозы крови натощак в группе детей с КЭО составляла 4,5 [min 2,59; max 6,9] ммоль/л, среднее значение - 4,5±1,0014 ммоль/л.
У детей контрольной группы медиана показателя глюкозы крови натощак - 4,3 [min 3,0; max 5,7], среднее значение - 4,2 ± 0,69 ммоль/л. Глюкоза крови натощак выше в основной группе, но достоверных различий в средних показателях гликемии натощак в двух исследуемых группах не выявлено (t=1,97; p=0.299033). Медиана показателя глюкозы крови через 2 часа после еды или нагрузки у детей с КЭО равнялась 5,0 [min 3,1; max 6,8] ммоль/л, среднее значение – 4,7±0,988 ммоль/л.
Нарушение углеводного обмена у детей с ожирением в сравнении с условно здоровыми детьми
|
|
Дети с ожирением, n=186 |
% |
Дети без ожирения, n=186 |
% |
F |
OR (ДИ) |
|
P |
|
«Плоская» сахарная кривая |
26 |
14,0 |
8 |
4,3 |
0.001835
|
3,62 (1,59-8,22) |
10,49 |
0.0012 |
|
Нарушенная гликемия натощак |
13 |
7,0 |
2 |
1,1 |
0.006307 |
6,91 (1,54-31,08) |
8.41 |
0.0037 |
У детей контрольной группы медиана показателя глюкозы крови через 2 часа после еды или нагрузки составляла – 4,4 [min 3,3; max 6,5] ммоль/л, среднее значение – 4,6±0,857 ммоль/л. Глюкоза крови через 2 часа после еды или нагрузки выше в группе КЭО (рис. 2), но достоверных различий в средних показателях гликемии в двух исследуемых группах не выявлено (t=1,97; p=0.298773).
Таким образом, в группе детей с конституционально-экзогенным ожирением шансы развития углеводных нарушений по типу плоская сахарная кривая и нарушение гликемии натощак, соответственно, в 3,69 и 6,91 раза выше, чем в контрольной группе. Плоская сахарная кривая (14,0%) и нарушение гликемии натощак (7,0%) достоверно чаще регистрировались в основной группе (p=0.0012; p=0.0037). Эти изменения могут быть как компонентом метаболического синдрома, так и повышать популяционный риск возникновения аутоиммунного сахарного диабета 1-го типа.
В группе детей с избыточной массой тела 24,3% имели изменения отдельных биохимических показателей, которые встречаются при метаболическом синдроме взрослых (общий холестерин и липиды крови, уровень мочевой кислоты в крови и моче, сахарная кривая, микроальбуминурия, мочевой осадок). В группе ожирения I степени такие изменения выявлены у 52,6%, II – 51,0%, III – 41,9%, IV (морбидное ожирение) – 75% детей. Три и более измененных лабораторных показателя имели 5,4% детей из группы ИМТ, 12,3% – из группы ожирения I степени, 2,04% – II, 6,45% – III, 50% – IV.
При сравнении количества детей, имеющих лабораторные метаболические «знаки» из группы ИМТ и группы морбидного ожирения, выявлена достоверная разница: в группе морбидного ожирения достоверно чаще регистрируются лабораторные метаболические изменения (F=0.004129; χ2=10.013; p=0.002). Число детей в группе морбидного ожирения, имеющих 3 и более лабораторных изменений у одного ребенка, по сравнению с группой избыточной массы достоверно выше (F=0.001430; χ2=13.970; p=0.000186). Более 4 лабораторных изменений у одного ребенка имели только дети из группы морбидного ожирения.
При сравнении группы морбидного ожирения и группы детей с ожирением I степени не выявлено достоверной разницы по частоте регистрации лабораторных метаболических изменений (F=0.207344; χ2=2.018; p=0.156). Число детей в группе морбидного ожирения, имеющих 3 и более лабораторных метаболических «знака» у одного ребенка, по сравнению с группой детей с ожирением I степени достоверно выше (F=0.007120; χ2=9.22; p=0.003).
При сравнении группы морбидного ожирения с группой детей с ожирением II степени не выявлено достоверной разницы по частоте регистрации лабораторных метаболических «знаков» (F=0.122220; χ2=2.64; p=0.1043). Число детей в группе морбидного ожирения, имеющих 3 и более лабораторных метаболических «знака» у одного ребенка, по сравнению с группой детей с ожирением II степени достоверно выше (F=0.000013; χ2=29.92; p=0.000000045).
При сравнении группы морбидного ожирения с группой детей с ожирением III степени не выявлено достоверной разницы по частоте регистрации лабораторных метаболических «знаков» (F=0.088339; χ2=3.79; p=0.052). Число детей в группе морбидного ожирения, имеющих 3 и более лабораторных метаболических «знака» у одного ребенка, по сравнению с группой детей с ожирением III степени достоверно выше (F=0.003135; χ2=10.83; p=0.00099).
Полученные в ходе настоящего исследования данные перекликаются с диссертационным исследованием Матюшевой Н.Б., в котором нарушения углеводного обмена у подростков с конституционально-экзогенным ожирением регистрируются в 19,0% по данным перорального глюкозотолерантного теста и в 17,2% по данным внутривенного глюкозотолерантного теста с сопоставимой частотой развития при всех степенях ожирения [15]. Автором установлено, что предикторами нарушений углеводного обмена у подростков с конституционально-экзогенным ожирением (по данным внутривенного глюкозотолерантного теста) являются: гликемия натощак >5,5 ммоль/л (р<0,033), мочевая кислота (р<0,021), липоматоз поджелудочной железы, что позволяет использовать полученный комплекс маркеров с целью своевременной коррекции ранних нарушений углеводного обмена.
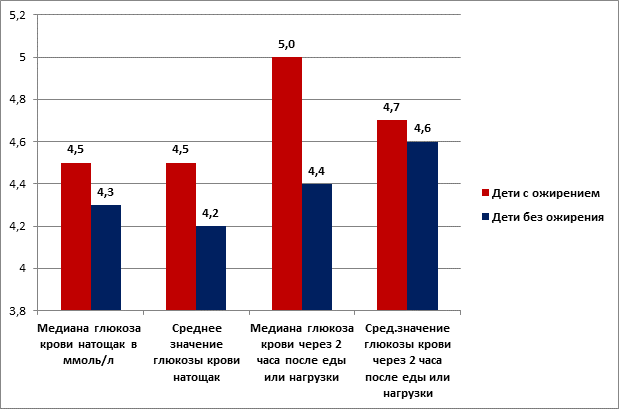
Рис. 2. Показатели уровней глюкозы натощак и через 2 часа после еды или нагрузки глюкозой в капиллярной крови у детей с ожирением и без ожирения
Заключение
Сахарный диабет относится к мультифакториальным заболеваниям. Одним из факторов риска диабета является конституционально-экзогенное ожирение. Проведенные исследования четко выявляют связь ожирения с нарушением углеводного обмена у детей. Вместе с тем только лишь наличия ожирения недостаточно для развития диабета. Имеют значение генетическая предрасположенность к диабету, стрессовые факторы риска, вредные привычки, неправильное питание и низкая физическая активность. Необходима дальнейшая детализация факторов риска сахарного диабета для развития прогностической модели развития заболевания у детей.
Библиографическая ссылка
Безрукова Д.А., Джумагазиев А.А., Отто Н.Ю., Сосиновская Е.В., Филипчук А.В. ОСОБЕННОСТИ УГЛЕВОДНОГО СТАТУСА У ДЕТЕЙ С ОЖИРЕНИЕМ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33172 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33172




 2
2