Андрогенетическая алопеция (АГА) является наиболее распространенной формой нерубцовых алопеций, поражающей 30–50% мужчин и около 30% женщин среднего возраста [1]. Точный патогенетический механизм, лежащий в основе АГА, изучен недостаточно. С учетом современных данных он складывается из двух основных компонентов: нарушений цикла волосяного фолликула (ВФ) и миниатюризации ВФ [1]. Нарушение цикла ВФ при АГА характеризуется преждевременным вступлением ВФ в стадию катагена и задержкой перехода из стадии телогена в стадию анагена, что ассоциировано с сокращением продолжительности стадии анагена [2, 3]. Наиболее ранним патогистологическим признаком АГА является очаговая базофильная дистрофия соединительнотканной оболочки нижней трети ВФ в стадии анагена, миниатюризацией ВФ, которая проявляется вариабельностью диаметров ВФ. На поздних стадиях заболевания ВФ исчезают, что сочетается с прогрессирующим перифолликулярным фиброзом [3, 4]. Наряду с уменьшением диаметров отдельных ВФ происходят относительное увеличение количества ВФ в стадии телогена, изменение соотношения анагеновых и телогеновых волос до 5:1 при норме 12:1; уменьшение размеров m. arrector pili. Количество сальных желез обычно уменьшается, оставшиеся сальные железы гиперплазированы, гипертрофированы, сочетаются с повышенной разветвленностью. Могут наблюдаться слабо выраженная периваскулярная инфильтрация лимфоцитами и тучными клетками, а также легкая вазодилатация [3, 4]. В Российской Федерации для лечения АГА одобрены миноксидил наружно, PRP терапия, мезотерапевтические препараты и хирургическое лечение [5]. Наличие противопоказаний, побочные эффекты, ограниченная эффективность и доступность существующих средств и методов лечения АГА определяют актуальность разработки новых способов лечения этого заболевания [6, 7].
Приоритетной является разработка высокоэффективных средств из доступного растительного сырья с минимальными побочными эффектами [1]. В связи с этим перспективной группой для разработки препаратов являются пентациклические тритерпеноиды, к которым относится милиацин- 3-β-метокси-Δ18-олеанен, получаемый из шелухи проса (Panicum miliaceum).
Цель исследования. Оценить влияние милиацина (3-β-метокси-Δ18-олеанена) на морфофункциональную реорганизацию кожи и ее придатков в модели АГА.
Материалы и методы исследования
Модельный эксперимент проводился на примере инбредной линии мышей C57BL/6. Выбор линии мышей обусловлен тем, что данные животные являются стандартизованной моделью для изучения ВФ со строгой синхронизацией цикла развития ВФ и возможностью путем депиляции инициировать синхронный анаген, неотличимый от спонтанного [8]. Для воспроизведения модели АГА в течение 28 дней проводился эксперимент на 30 самцах мышей линии C57BL/6 массой тела 17–18 г. Животные были доставлены из питомника «Столбовая» ФГБУН НЦБМТ ФМБА России. При проведении эксперимента все манипуляции, связанные с животными, выполнялись в соответствии с Директивой Европейского парламента и Совета Европейского Союза 2010/63/ЕС от 22 сентября 2010 г. по охране животных, используемых в научных целях; Федеральным законом от 27.12.2018 г. № 498-ФЗ «Об ответственном обращении с животными и о внесении изменений в отдельные законодательные акты Российской Федерации» (ред. от 27.12.2019). До начала эксперимента животные находились 14 дней в стандартных условиях вивария на карантине со свободным доступом к пище и воде, с 12-часовым чередованием цикла «день/ночь». С целью индукции синхронного анагена под эфирным наркозом была проведена депиляция стержней волос с межлопаточной области, паравертебрально, начиная от линии, соединяющей основания лопаток животных, коммерческими восковыми полосками. День индукции анагена считался нулевым днем эксперимента. Моделирование АГА проводилось путем ежедневного нанесения на депилированную кожу всем животным опытных групп 1%-ного геля тестостерона из расчета 5 мг/кг. Использовался препарат Андрогель® (производитель Besins-Healthcare), обеспечивающий непрерывную трансдермальную доставку тестостерона на протяжении 24 ч после однократного нанесения [9]. Для оценки влияния милиацина на цикл ВФ в модели АГА был приготовлен состав из двух компонентов: основы из полиоксиэтилированного (20) сорбитаноолеата, обеспечивающего трансдермальную доставку и проникновение активного соединения, представленного милиацином, полученным стандартным способом [10].
Животные были разделены на 5 групп по 6 особей в каждой группе. Контрольную группу составили интактные животные; I опытную группу – мыши, получавшие 1%-ный гель тестостерона 5 мг/кг наружно (модель АГА). Животным II, III, IV опытных групп через 60 минут после нанесения 1%-ного геля тестостерона на кожу области депиляции наносили: II опытной группе – 2%-ный раствор миноксидила (положительный контроль); III опытной группе – состав, содержащий милиацин, из расчета 30 мг/мл фармацевтически неактивной основы, представленной полиоксиэтилированным (20) сорбитаноолеатом; IV опытной группе – полиоксиэтилированный (20) сорбитаноолеат (плацебо). Животных выводили из эксперимента на 28-е сутки после индукции анагена под эфирным наркозом путем смещения шейных позвонков. Полученные образцы кожи области депиляции помещали в забуференный 10%-ный нейтральный формалин и фиксировали при комнатной температуре в течение суток. После стандартной гистологической проводки материал заливали в парафиновые блоки, полученные срезы толщиной 5 мкм окрашивали гематоксилином Майера и эозином. Стадии цикла ВФ определяли исходя из данных, представленных S. Müller-Röver et al. [8]. При этом к ВФ в стадии раннего анагена были отнесены ВФ в стадии анагена I и II; среднего анагена – IIIa, IIIb и IIIc; позднего анагена – IV, V, VI; раннего катагена – I, II, III; среднего катагена – IV, V; позднего катагена – VI, VII, VIII [11].
Морфологические признаки, свойственные каждой из стадий ВФ, были взяты из работы S. Müller-Röver et al. [8]. Морфометрический анализ изображений фрагментов кожи проводился с помощью программного обеспечения ImageJ. Диаметры наружных корневых влагалищ измеряли на поперечных срезах на уровне впадения сальной железы. Статистический анализ полученных данных выполняли с использованием таблиц Excel и программы Statistica 10.0. Количественные данные представлены в виде средней арифметической и стандартной ошибки среднего (М±m). Для сравнения показателей нескольких независимых групп использовали критерий Краскела–Уоллиса, попарные сравнения проводили с помощью критерия Манна–Уитни. Различия считались статистически значимыми при р≤0,05. Уровень изменчивости морфологических признаков оценивали с помощью коэффициента вариации (Cv). Принято считать, что если уровень вариации меньше 10%, то степень разброса данных незначительная, от 10 до 20% – средняя, больше 20% и меньше или равно 33% – значительная; если значение коэффициента вариации не превышает 33%, то совокупность считается однородной, если больше 33%, то неоднородной.
Результаты исследования и их обсуждение. На 28-е сутки после депиляции в коже животных контрольной группы ВФ были синхронизированы в стадии телогена (рис. 1). Об этом свидетельствовало наличие компактного дермального сосочка (ДС), примыкающего к наружному корневому влагалищу, и полностью кератинизированного депигментированного проксимального конца стержня волоса с расположением ВФ в дерме. Расчет плотности ВФ в коже мышей контрольной группы показал, что в среднем на единицу площади кожи приходилось 5,0±0,15 волосяных фолликулов. Средний диаметр наружных корневых влагалищ был равен 55,17±2,52 мкм. Вариабельность диаметров наружных корневых влагалищ (Cv) составила 26,2%. Относительная объемная плотность сальных желез кожи мышей контрольной группы была равна 3,44±0,46%.
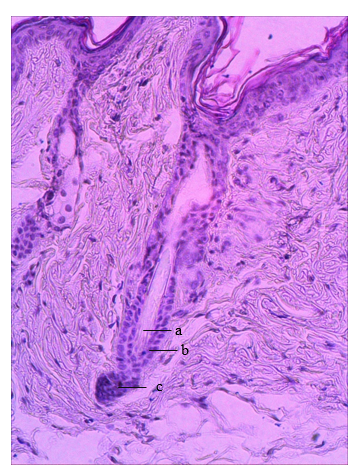
Рис. 1. Фрагмент кожи спины мыши. Контрольная группа. 28-е сутки после депиляции. Волосяной фолликул в стадии телогена (a – «щетковидный» проксимальный конец волоса, b – наружное корневое эпителиальное влагалище, c – дермальный сосочек). Окраска: гематоксилин Майера и эозин, ув. х300
В коже мышей I опытной группы на 28-е сутки после депиляции также содержались ВФ в стадии телогена. Однако в исследуемых участках кожи наблюдалась неравномерная плотность распределения ВФ при средней плотности 2,82±0,07 ВФ на единицу площади кожи. Средний диаметр наружных корневых влагалищ составил 52,58±2,56 мкм. Вариабельность диаметров наружных корневых влагалищ (Cv) оказалась равной 41,7%. Относительная объемная плотность сальных желез в коже мышей I опытной группы была равна 5,42±0,57%.
Морфофункциональная оценка кожи мышей II опытной группы выявила полиморфную картину стадий развития волосяных фолликулов. Из общего количества наблюдаемых ВФ 62,64±3,37% находились в стадии телогена, 37,36±3,37% – в стадии анагена. Соотношение числа анагеновых и телогеновых ВФ составило 0,61±0,09. Телогеновые ВФ имели описанные ранее морфологические признаки. Распределение ВФ в стадии анагена с учетом их морфологических особенностей показало, что преобладали ВФ в стадиях среднего анагена, удельный вес которых составил 66,22±10,3%. Волосяные фолликулы этих стадий локализовались на границе между дермой и подкожной жировой клетчаткой. Отличительной морфофункциональной чертой ВФ в стадиях среднего анагена являлось начало меланогенеза, что отражалось в появлении конуса кератиноцитов, формирующих внутреннее корневое влагалище с зоной меланогенеза. Дермальный сосочек ВФ в стадии среднего анагена выглядел удлиненным и рыхлым. В коже мышей II опытной группы в стадии раннего анагена (рис. 2) находилось 10,8±3,6% ВФ от общего количества ВФ в стадии анагена. Эти ВФ находились в дерме, их отличали удлинение и расширение пряди кератиноцитов между ДС и наружным корневым влагалищем. При этом ДС на 50% был окружен кератиноцитами развивающегося матрикса волоса, что позволило отнести описанные ВФ к стадии анагена II.
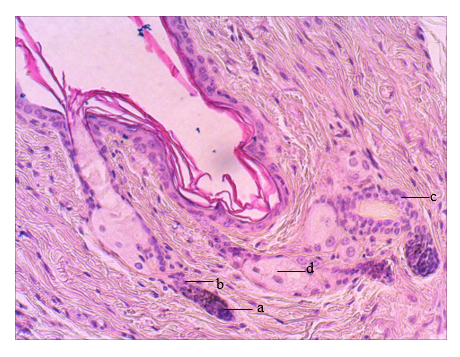

Рис. 2. Фрагмент кожи спины мыши. II опытная группа. 28-е сутки после депиляции. Волосяные фолликулы в стадии раннего анагена (a – дермальный сосочек, b – эпителиальная прядь из фолликулярных кератиноцитов, c – наружное корневое эпителиальное влагалище, d – сальная железа). Окраска: гематоксилин Майера и эозин, ув. х300
Также в коже мышей II опытной группы были выявлены ВФ в стадии позднего анагена – 22,9±9,05% волосяных фолликулов. Луковицы ВФ локализовались в подкожной жировой клетчатке, наблюдался узкий веретеновидный ДС, полностью окруженный кератиноцитами луковицы. При этом ширина ДС составляла менее трети ширины луковицы ВФ, наблюдалась меланогенная зона над дистальным полюсом ДС (рис. 3), что соответствовало морфологии анагена VI.
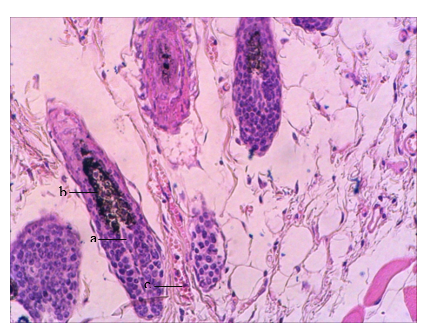
Отличительной особенностью структурно-функциональной организации кожи мышей II опытной группы являлась вазодилатация – как сосудов, оплетающих луковицы ВФ, в стадии анагена VI, так и сосудов подкожной жировой клетчатки, преимущественно располагавшихся на границе с m. panniculus carnosus, что подтверждает сосудорасширяющее действие миноксидила [12].
Средний диаметр наружных корневых влагалищ ВФ кожи мышей II опытной группы составил 50,01±3,98 мкм. Вариабельность диаметров наружных корневых влагалищ (Cv) была равна 35,6%. Относительная объемная плотность сальных желез составила 4,68±0,51%. Расчет плотности ВФ показал, что в среднем на единицу площади кожи мышей приходилось 5,17±0,17 ВФ.
Морфологический анализ кожи мышей III опытной группы показал, что из общего количества наблюдаемых ВФ в стадии телогена находились 21,72±2,57%; в различных стадиях анагена – 77,26±2,39%; 1,24±0,42% ВФ находились в стадии катагена. Из общего количества ВФ в стадиях анагена 26,13±6,24% находились в стадиях раннего анагена, 20,45±1,95% находились в стадиях среднего анагена и 53,42±6,47% – в стадиях позднего анагена. Морфологические признаки ВФ в стадиях телогена и анагена (раннего, среднего, позднего) не отличались от ранее описанных в коже мышей I и II опытных групп животных (рис. 4). В коже мышей III опытной группы наблюдались немногочисленные ВФ в стадии катагена (рис. 5), что является отличительной особенностью от других опытных групп животных. Общими морфологическими признаками ВФ в стадиях катагена являлись их локализация в дерме, наличие компактного ДС, формирующаяся вторичная зародышевая капсула из дистальной части наружного корневого влагалища, депигментированная проксимальная часть стержня волоса. Наблюдаемые в коже мышей III опытной группы ВФ имели булавовидный волос между зародышевой капсулой и ДС, сужение эпителиальной части регрессирующего ВФ. Наблюдалась регрессия внутреннего корневого влагалища с четкой зоной демаркации. Эпителиальная прядь была шире, чем диаметр дермального сосочка. Описанные морфологические признаки ВФ позволяют их отнести к ВФ стадии катагена V. Соотношение ВФ в стадиях анагена и телогена оказалось равным 3,8±0,52. Средний диаметр наружных корневых влагалищ составил 77,98±2,14 мкм. Вариабельность диаметров наружных корневых влагалищ (Cv) составила 24,5%. Морфометрический анализ показал, что относительная объемная плотность сальных желез в коже мышей III опытной группы была равна 5,1±0,66%. Из общего количества наблюдаемых ВФ их плотность составила 5,33±0,12 ВФ на единицу площади кожи.
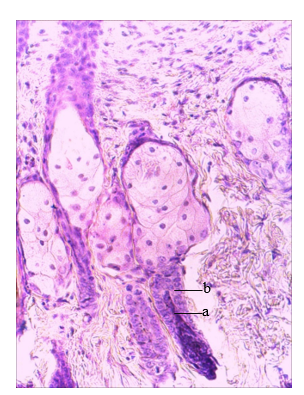
Рис. 4. Фрагмент кожи спины мыши. III опытная группа. 28-е сутки после депиляции. Волосяной фолликул в стадии среднего анагена (анаген III) (a – конус кератиноцитов внутреннего корневого влагалища, b – наружное корневое влагалище). Окраска: гематоксилин Майера и эозин, ув. х300
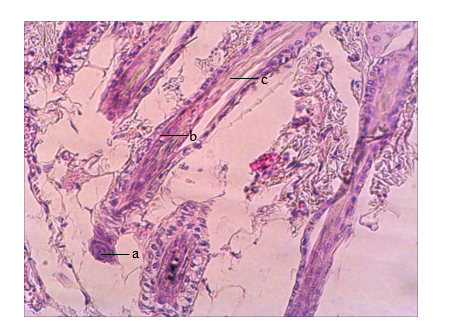
Рис. 5. Фрагмент кожи спины мыши. III опытная группа. 28-е сутки после депиляции. Волосяной фолликул в стадии катагена V (a – дермальный сосочек, b – вторичная зародышевая капсула, c – депигментированный стержень волоса). Окраска: гематоксилин Майера и эозин, ув. х300
Результаты проведенной количественной морфометрии кожи мышей IV опытной группы были сопоставимы с таковыми в коже мышей I опытной группы. Об этом свидетельствовало преобладание ВФ в стадии телогена, составивших 92,08±0,69%. Удельный вес ВФ в стадии раннего анагена был равен 7,92±0,69%. Соотношение числа анагеновых и телогеновых ВФ составило 0,09±0,01. Волосяные фолликулы в стадии раннего анагена имели округлый ДС, дистальнее которого располагалась эпителиальная прядь, по ширине не превышающая диаметр ДС, фолликулярные кератиноциты в виде полулуния окружали ДС, охватывая его верхний полюс, что соответствует телоген-анагеновой трансформации ВФ с морфологическими признаками анагена I. Плотность ВФ составила 2,65±0,06 ВФ на единицу площади кожи. Средний диаметр наружных корневых влагалищ был равен 58,38±2,13 мкм. Вариабельность диаметров наружных корневых влагалищ (Cv) оказалась равной 35,6%. Относительная объемная плотность сальных желез составила 5,29±0,46%.
Результаты проведенного исследования свидетельствуют о воспроизведении модели АГА в I опытной группе. Это подтверждается наблюдаемыми морфологическими признаками, включающими снижение плотности ВФ, которая составила 2,82±0,07 ВФ на единицу площади кожи, что было в 1,8 раза меньше по сравнению с таковой в контрольной группе, где этот показатель был равен 5,0±0,15 ВФ на единицу площади кожи (р<0,001), и наибольшим среди всех исследуемых групп коэффициентом вариации диаметров наружных корневых влагалищ, составившим 41,7%, что свидетельствовало о широкой вариабельности диаметров наружных корневых влагалищ и являлось отражением миниатюризации ВФ в модели АГА. Дополнительным доказательством сформированности модели АГА явилось отсутствие статистически значимых различий по количеству ВФ на единицу площади кожи мышей I опытной группы и животных IV опытной группы, получавших плацебо. Анализируемый показатель в этих группах составил 2,82±0,07 и 2,65±0,06 ВФ на единицу площади кожи соответственно (р=0,17). Кроме того, коэффициент вариации наружных корневых влагалищ в коже мышей IV опытной группы превышал 33%, отражая высокую вариабельность данного признака в коже животных этой группы. Влиянием тестостерона, вероятно, объясняется более высокая относительная объемная плотность сальных желез в коже мышей I и IV опытных групп, которая в 1,6 раза и в 1,5 раза соответственно превышала таковую в коже мышей контрольной группы (р=0,03 и р=0,02).
В коже мышей II опытной группы, животные которой получали миноксидил, в модели АГА наблюдались морфологические изменения, подтверждающие описанные ранее эффекты миноксидила [12]. Так, наблюдалось увеличение плотности ВФ в коже мышей II опытной группы, которая составила 5,17±0,17 ВФ на единицу площади кожи и в 1,9 раза превышала таковую в коже животных IV опытной группы, получавших плацебо (p<0,001). Вместе с тем, статистически значимых различий этого показателя с таковым в контрольной группе, где на единицу площади кожи приходилось 5,0±0,15 ВФ (р=0,71), не наблюдалось. Отличительным морфологическим признаком кожи животных II опытной группы, получавших миноксидил, являлась наблюдаемая вазодилатация – как сосудов, оплетающих луковицы ВФ, так и сосудов подкожной жировой клетчатки, преимущественно располагавшихся на границе с m. panniculus carnosus, что подтверждает известный сосудорасширяющий эффект миноксидила [12].
В коже мышей III опытной группы, животные которой получали милиацин, плотность ВФ на единицу площади кожи статистически значимо не отличалась от таковой как в коже животных контрольной группы (р=0,71), так и в коже мышей II опытной группы, получавших миноксидил (p=0,17). Эти факты могут свидетельствовать, с одной стороны, о возможном частичном нивелировании эффектов тестостерона на структуру и функции ВФ в модели АГА, с другой – о вероятном сходстве эффектов милиацина и миноксидила на структурную реорганизацию ВФ в исследуемой модели алопеции.
В коже животных I, II и IV опытных групп диаметры наружных корневых влагалищ, равные соответственно 52,58±2,56 мкм, 50,01±3,98 мкм и 58,38±2,13 мкм, при попарном их сравнении с аналогичным показателем в коже мышей контрольной группы, равным 55,17±2,52 мкм, не имели статистически значимых различий (р=0,12, р=0,23 и р=0,58 соответственно). При этом в коже мышей III опытной группы средний диаметр наружных корневых влагалищ в 1,4 раза и в 1,6 раза превышал таковой в коже мышей контрольной группе и II опытной группы соответственно (р<0,001 и р<0,001 соответственно).
Морфологическим отличием кожи мышей I, II и IV опытных групп явилась высокая вариабельность диаметров наружных корневых влагалищ. При этом в коже животных III опытной группы и контрольной группы коэффициент вариации диаметров наружных корневых влагалищ составил соответственно 24,5% и 26,2%, что свидетельствует об однородности данного показателя и позволяет предположить, что милиацин может модифицировать структурную организацию ВФ в условиях воздействия тестостерона.
Кардинальным отличием морфологической картины кожи мышей II, III и IV опытных групп явилось наличие ВФ в стадии анагена. При этом, если в коже мышей II и IV опытных групп удельный вес ВФ в стадии анагена составил соответственно 37,36±3,37% и 7,92±0,69%, то в коже животных III опытной группы, получавших милиацин, этот показатель был равен 77,26±2,39%. Количественный анализ стадий анагена в коже мышей III опытной группы свидетельствовал о преобладании ВФ в стадиях позднего анагена, удельный вес их составил 53,42±6,47% от общего количества ВФ в стадии анагена. Учитывая, что на 28-е сутки в коже мышей контрольной группы, II опытной группы и IV опытной группы 100,0%, 62,64±3,37% и 92,08±0,69% ВФ соответственно находились в стадии телогена, можно предположить, что топическое применение милиацина в модели АГА способствует удлинению стадии анагена. Кроме того, в коже мышей III опытной группы 26,13±6,24% от общего количества ВФ в стадии анагена приходилось на стадии раннего анагена, что может указывать на свойство милиацина приводить к трансформации ВФ из стадии телогена в стадию анагена.
Вывод. Топическое применение милиацина в модели АГА приводит к увеличению плотности ВФ на единицу площади кожи, увеличивает соотношение ВФ в стадии анагена и стадии телогена, удлиняет продолжительность стадии анагена, снижает вариабельность диметров наружных корневых влагалищ, препятствуя формированию морфологических признаков АГА.
Библиографическая ссылка
Башмалух Н.В., Николаева Т.В., Полякова В.С., Шарапова Н.В. ВЛИЯНИЕ МИЛИАЦИНА НА СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ХАРАКТЕРИСТИКИ ПРИДАТКОВ КОЖИ МЫШЕЙ ЛИНИИ C57BL/6 В ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ АНДРОГЕНЕТИЧЕСКОЙ АЛОПЕЦИИ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33160 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33160



