Первичные злокачественные опухоли костей составляют около 1% от всех диагностируемых онкологических заболеваний [1, 2]. Более того, метастатическое поражение в костных тканях обнаруживают в 35–40 раз чаще по сравнению с впервые обнаруженными опухолями, при этом метастазы в длинных трубчатых костях составляют 13–24% [3]. Осложнением лечения таких заболеваний являются патологические переломы в 5–30% случаев, что требует хирургического вмешательства у 9–12% пациентов [3]. В клинической практике используются такие подходы, которые состоят из радикальной резекции, что приводит к обширным постоперационным дефектам. Это обусловливает необходимость замещения изъяна и восстановления функции органов, которые были нарушены, а также обеспечения комфортной жизни пациента [4, 5].
Поиск и изучение альтернативного материала для замещения костных дефектов, который обладал бы высокой биологической совместимостью с костной тканью, продолжаются. На данный момент к перспективным имплантатам можно отнести наноструктурные углеродные композиции, а именно наноструктурные покрытия на основе аморфного углерода (углеродный наноструктурный имплантант (УНИ)). Они обладают достаточной прочностью, химически инертны, не растворяются в органических и неорганических растворителях, не взаимодействуют со щелочами, кислотами, солями, органическими и биологически активными соединениями и устойчивы к коррозии [6, 7]. Такой материал обладает хорошей пористостью, что дает возможность костным клеткам мигрировать в его структуру, улучшать механическое сцепление, обеспечивая его стабильность. Традиционные методы изучения регенерации кости предполагают выполнение исследований на иммунокомпетентных животных, однако недостаточно информации об исследованиях подобного рода на иммунодефицитных лабораторных грызунах, которые, как известно, являются важной исследовательской платформой для моделирования онкологических заболеваний и создания ксеногенных моделей опухолей костей [8, 9, 10].
Цель исследования – изучение регенерации костной ткани иммунодефицитных мышей после механического повреждения с использованием углеродного наноструктурного имплантата в условиях эксперимента.
Материал и методы исследования
Животные. Работа была выполнена на 26 иммунодефицитных мышах самках линии Balb/c Nude. Возраст мышей составил 4–5 недель, средняя масса тела составила 25–27 г. Мыши содержались в SPF-виварии ФГБУ «НМИЦ онкологии» Минздрава России в индивидуально вентилируемых клетках при температуре 21–23°С, в условиях естественной смены освещенности и свободного доступа к корму и воде. Проводимые манипуляции с животными соответствовали правилам Европейской конвенции о защите позвоночных животных, используемых для исследовательских и других научных целей (Страсбург, 1986), и одобрены биотической комиссией ФГБУ «НМИЦ онкологии» Минздрава России (Регистрационный № 11/210).
Было сформировано 3 группы животных:
1-я группа (n=6) – контрольная, без каких-либо воздействий на животных; в 1-й день эксперимента была выполнена микро-КТ с последующей эвтаназией для забора кости. Контрольная группа необходима для сравнения гистологических препаратов и 3D-модели, полученных при помощи микро-КТ условно здоровой костной ткани животных с экспериментальными группами;
2-я группа (n=10) – проводилось повреждение бедренной кости; на 4-е и 28-е сутки эксперимента было выполнено микро-КТ с последующей эвтаназией для забора кости;
3-я группа (n=10) – проводились повреждение бедренной кости и имплантация УНИ; на 4-е и 28-е сутки эксперимента было выполнено микро-КТ с последующей эвтаназией для забора кости.
Манипуляции, проводимые в эксперименте, представлены в таблице 1.
Таблица 1
Характеристика проводимых в эксперименте манипуляций
|
Манипуляции |
Группа 1 (n=6) |
Группа 2 (n=10) |
Группа 3 (n=10) |
|
Повреждение костной ткани |
– |
+ |
+ |
|
Имплантацией УНИ |
– |
– |
+ |
|
Микро-КТ исследование |
+ |
+ |
+ |
|
Гистология |
+ |
+ |
+ |
Повреждение тела бедренной кости и имплантация УНИ
Мышам 2-й и 3-й групп была выполнена процедура повреждения тела (диафиза) бедренной кости на расстоянии ≈3 мм и ≈1 мм глубиной. Хирургические вмешательства у животных были проведены под общим наркозом ветеринарными препаратами «Ксила» в дозе 20 мг/кг, «Золелил-100» в дозе 50 мг/кг. После послойного рассечения кожи и мышц бедра параллельно тазобедренной кости при помощи высокоскоростной дрели Medtronic (США) нарушали целостность надкостницы диафиза бедренной кости длиной 3 мм и глубиной 1 мм, обрабатывали декаметоксином. После этого хирургическую рану у животных контрольной группы ушивали послойно непрерывным обвивным швом, затем обрабатывали 10%-ным раствором бетадина. Мышам 3-й группы накладывали углеродный имплантат размером 10 мм и закрепляли одним узлом лигатуры и также послойно ушивали.
Характеристика углеродного наноструктурного имплантата
Для замещения костного дефекта был использован имплантат из аморфного наноструктурного углеродного материала, фрагменты которого достигали длины 10 мм (ООО «НаноТехМед плюс») (Россия). Открытая пористость составляет не менее 5%, что дает возможность прорастания костным клеткам. Предел прочности при сжатии не менее 30 МПа и при изгибе не менее 20 МПа, нанотвердость не менее 1,5 ГПа. Примеси металлов и других неметаллов в структуре отсутствовали [11].
Микрокомпьютерная томография
Визуализация животных in vivo выполнялась на 4-е и 28-е сутки после повреждения бедренной кости на устройстве Quantum GX2 microCT (Perkin Elmer, США) со следующими параметрами сканирования: напряжение трубки – 90 кВ, ток трубки – 80 мкА, поле зрения – 45 мм, размер пикселя – 90 мкм, время сканирования – 4 мин, угол поворота – 360°, общее количество проекционных изображений – 512, режим сканирования – высокое разрешение. Перед каждым сканированием мышей анестезировали с использованием специальной системы ингаляционного наркоза RAS-4 (Perkin Elmer, США) с 2%-ным раствором изофлурана. После сбора данных изображения в формате DICOM были реконструированы в 3D-модели с использованием программного обеспечения для просмотра проекций и трехмерной реконструкции Quantum GX2 4.0.
Гистологический исследование
Выделенные бедренные кости мыши с имплантатом и без него фиксировали в 10%-ном формалине. Перед проведением анализа имплантат удаляли, а кости отправляли на последующие этапы. Затем проводили удаление солей кальция из образцов для их размягчения декальцинирующим раствором и проводку в вакуумном гистологическом процессоре Leica ASP6025 S (Германия). Далее проводили заливку образца в модульной системе (Tes 99 Medite (Германия)) в парафин. Следующим этапом проводили резку при помощи ротационного микротома Leica RM 2255 (Германия) толщиной примерно 4 мкм. Последним этапом образцы окрашивали гематоксилином и эозином (Tissue-Tek Film Automated Coverslipper). Полученный гистологический препарат тщательно исследовали под микроскопом и фотографировали области, включающие зоны интереса.
Результаты исследования и их обсуждение
При микро-КТ исследовании на 3D-модели, полученной в результате сканирования интактного животного, представлено детальное изображение костей нижних конечностей мыши, среди которых основной интерес представляет бедренная кость (рис. 1А). На гистологическом препарате контрольной бедренной кости виден участок неповрежденной кортикальной кости, состоящей из компактного вещества, представляющего собой плотную наружную поверхность кости, образующую защитный слой вокруг внутренней полости (рис. 1Б). Кроме того, на гистологическом препарате можно наблюдать неповрежденный костный мозг, в костном мозге можно наблюдать достаточно большое количество костных балок (трабекул).
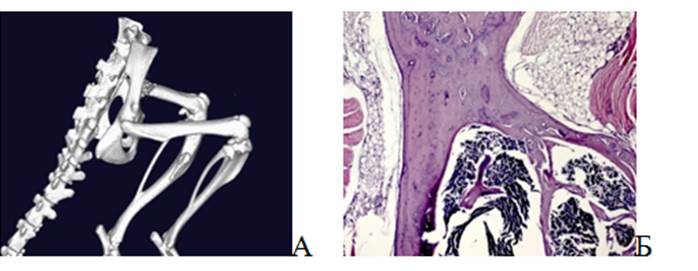
Рис. 1. Контроль. Кость мыши линии Balb/c Nude без повреждения: А – 3D-модель, полученная при помощи микро-КТ; Б – Гистологический снимок. Окраска гематоксилином и эозином. Об. – 2,5, ок. – 10
На 4-е сутки после проведенных хирургических манипуляций на 3D-модели животного с механическим повреждением тела бедренной кости четко виден дефект костной ткани (рис. 2А). На гистологическом препарате видны явные нарушения в архитектонике костной ткани, присутствуют участки повреждения в виде деструкции костных балок (рис. 2Б). Также в костном мозге видны фрагменты раздробленной в результате механического повреждения кортикальной части кости. В некоторых полях зрения заметно увеличение количества остеобластов, которые расположены хаотично, а не зонально, по сравнению с гистологическим препаратом кости интактного животного.
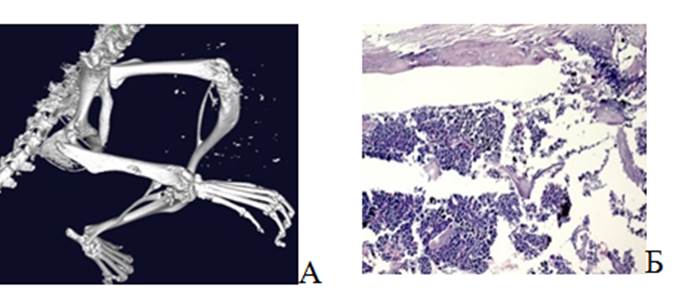
Рис. 2. Дефект бедренной кости на 4-е сутки после повреждения. А – 3D-модель, полученная при помощи микро-КТ; Б – Гистологический снимок. Окраска гематоксилином и эозином. Об. – 2,5, ок. – 10
Далее, на 3D-модели, полученной на 28-е сутки после механического повреждения тела бедренной кости, была продемонстрирована морфология, сходная с костью до полученного дефекта, видна восстановившая целостность бедренной кости мыши без видимых признаков нарушения (рис. 3А).
На гистологическом препарате бедренной кости мыши на 28-е сутки после повреждения, так же как и на 3D-модели, отмечается целостность кортикальной кости, что можно расценивать как свидетельство завершения регенерации костной ткани (рис. 3Б). Помимо этого, на препарате виден костный мозг без признаков повреждения и травм, с расположенными в нем костными трабекулами. В целом, как 3D-модель, так и гистологический препарат кости мыши на 28-е сутки после повреждения демонстрируют значительное сходство с 3D-моделью и гистологическим препаратом бедренной кости интактной мыши.
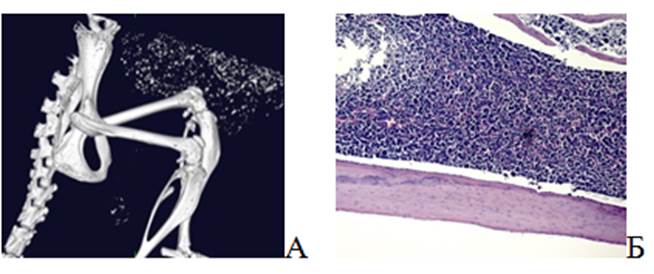
Рис. 3. Дефект бедренной кости на 28-е сутки после повреждения. А – 3D-модель, полученная при помощи микро-КТ; Б – Гистологический снимок. Окраска гематоксилином и эозином. Об. – 2,5, ок. – 10
Также во 2-й группе на 28-е сутки после операции были обнаружены животные с образованием костной мозоли в области механического повреждения (рис. 4). На 3D-модели отчетливо видно образование в виде наружного нароста костной ткани.
На гистологическом снимке видны клетки надкостницы, состоящей из гиалинового хряща и костных клеток, на внешних краях мозоли обнаружено высокое количество остеокластов, которые и образуют наружную костную мозоль.
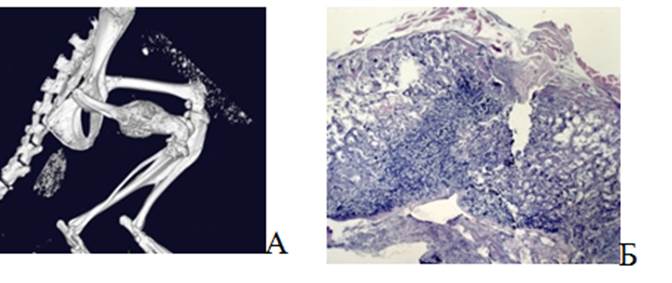
Рис. 4. Дефект бедренной кости на 28-е сутки с формированием костной мозоли после повреждения. А – 3D-модель, полученная при помощи микро-КТ; Б – Гистологический снимок. Окраска гематоксилином и эозином. Об. – 2,5, ок. – 10
На рисунке 5 представлена 3D-модель, полученная на 28-е сутки после хирургической манипуляции и имплантации УНИ. Видимых костных повреждений, отторжения не обнаружено.
На гистологическом снимке можно наблюдать архитектонику новой костной ткани, схожую с архитектоникой интактной кости мыши. Видно большое количество костного мозга с костными балками.
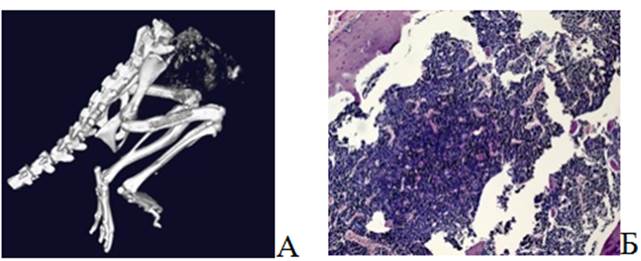
Рис. 5. Кость мыши линии Balb/c Nude на 28-е сутки после повреждения тела бедренной кости с имплантацией УНИ: А – 3D-модель, полученная при помощи микро-КТ; Б – Гистологический снимок. Окраска гематоксилином и эозином. Об. – 2,5, ок. – 10
После вскрытия 3-й группы на 28-е сутки форма имплантата оставалась прежней, а также не было замечено процессов инфицирования, миграции и отторжения имплантата.
Заключение
В нашей работе были описаны результаты моделирования дефекта костной ткани in vivo. Такие модели демонстрируют регенеративную способность как при использовании УНИ, так и без него после повреждения кости. При этом в группах с использованием углеродного имплантата не было обнаружено нарушения роста клеток с образованием костной мозоли, а также его отторжения и воспалительных реакций на инородное тело. В целом, это исследование демонстрирует высокий потенциал моделирования дефекта костной ткани с использованием иммунодефицитных мышей для последующих экспериментов в области онкоортопедии.
Библиографическая ссылка
Росторгуев В.Э., Галина А.В., Гончарова А.С., Дурицкий М.Н., Максимов А.Ю., Голубев Г.Ш. ИЗУЧЕНИЕ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ ПОСЛЕ МЕХАНИЧЕСКОГО ПОВРЕЖДЕНИЯ С ИСПОЛЬЗОВАНИЕМ УГЛЕРОДНОГО НАНОСТРУКТУРНОГО ИМПЛАНТАТА В УСЛОВИЯХ ЭКСПЕРИМЕНТА НА ИММУНОДЕФИЦИТНЫХ МЫШАХ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33135 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33135



