Проблема лечения больших и гигантских послеоперационных вентральных грыж остается актуальной и дискутабельной [1; 2]. Большинство ведущих герниологов придерживаются мнения о высокой эффективности оперативного лечения больших и гигантских послеоперационных вентральных грыж с использованием синтетических сетчатых имплантов [3]. В настоящее время достаточно хорошо изучен и подкреплен клиническими результатами тезис о значительном снижении частоты рецидивов грыж при сепарационной пластике синтетическими сетками [4; 5]. Тем не менее синтетическая сетка подвержена инфицированию с развитием перипротезной инфекции и инфекции мягких тканей передней брюшной стенки, что приводит к необходимости дополнительных мероприятий по эксплантации инфицированного синтетического импланта, длительным санирующим и дренирующим процедурам и ушиванию уже более крупного грыжевого дефекта передней брюшной стенки [6]. По мнению J. Kanitra et al., частота инфекционных осложнений после герниопластики синтетическими сетками достигает 10% [7]. Все это обусловливает дополнительные расходы и значительно пролонгированный послеоперационный период в круглосуточном стационаре [8]. Остается нерешенной проблема выбора способа лечения перипротезной инфекции, не разработаны четкие критерии к эксплантации сетчатого импланта [9]. Все больший интерес в лечении пациентов с инфекцией в области хирургического вмешательства и абдоминальной инфекцией приобретает применение локального отрицательного давления или вакуум-терапия [10].
Анамнез
Пациентка Л., 66 лет, поступила в КГБУЗ «Краевая клиническая больница» в 2022 году для планового оперативного лечения. Из анамнеза известно, что впервые оперирована по поводу перекрута кисты яичника с кровотечением в 1997 году, в 1998 году оперирована по поводу острого аппендицита, перитонита, через 1 сутки - по поводу кишечной непроходимости. Через два года, в 2000 году после операции отметила появление грыжевого выпячивания. В последнее время стала отмечать невправимость грыжи, значительное увеличение ее в размерах и выраженные тянущие боли в области выпячивания. Пациентка была обследована на амбулаторном этапе по протоколу предоперационной подготовки и направлена в стационар для планового оперативного лечения.
При госпитализации отмечено также наличие гипертонической болезни II ст., риск 3. В анамнезе имела место аллергическая реакция на ацетилцистеин в виде отека Квинке.
При объективном осмотре диагностировано ожирение 1 степени по ВОЗ (ИМТ 30,1).
Локальный статус при госпитализации
На передней брюшной стенке имеется грубый послеоперационный рубец от мечевидного отростка до лонного сочленения с расширенным до 2,0 см пупочным кольцом, наличием частично вправимой в области мезогастрия многокамерной грыжи и имеющимся пальпируемым грыжевым дефектом 15-20 см в поперечнике (локализация - М2-М4 по EHS); размер выпячивания - 25-35 см.
Результаты лабораторных и инструментальных методов исследования в предоперационном периоде
При МСКТ брюшной полости (нативное исследование с пробой Вальсальвы) описаны вентральные грыжи передней брюшной стенки с размерами грыжевых ворот от 10 до 18 см. Общий размер грыжевого мешка до 20 см. Содержимое грыжевого мешка - абдоминальная клетчатка и петли тонкой кишки (рис. 1).
На основании вышеперечисленных данных выставлен клинический диагноз: «невправимая послеоперационная вентральная грыжа R0 M2-4 W3 (по EHS)».
Сопутствующая патология: гипертоническая болезнь II ст. Риск 3. Аллергическая реакция на ацетилцистеин в виде отека Квинке.
Спирография с пробой Вальсальвы: объемные и скоростные показатели внешнего дыхания в пределах нормы. С утягиванием - снижение ЖЕЛ на 5%.
Лечение
Предоперационная антибиотикопрофилактика (условно чистая операция) включала цефалозин 2,0 (из расчета по массе тела) внутривенно болюсно за 30 минут до операции. Профилактика вторичных тромбэмболических осложнений проводилась на основании шкалы Каприни (умеренный риск), был назначен фраксипарин 0,4 подкожно 1 раз в сутки.
На 2-е сутки пребывания в стационаре выполнена плановая операция - герниолапаротомия с иссечением пупка, тотальный адгезиолизис, комбинированная переднезадняя сепарационная пластика с использованием Bridge-техники, липодермэктомия, дренирование надапоневротического пространства и подкожножировой клетчатки.
Продолжительность операции - 210 минут.
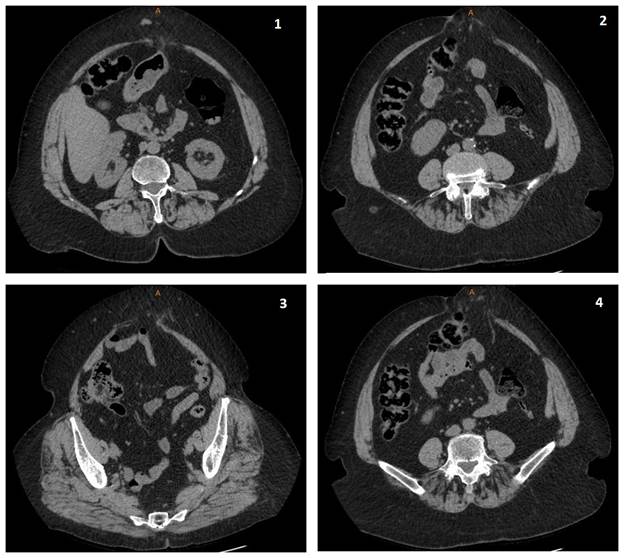
Рис. 1. МСКТ органов брюшной полости (натив) при госпитализации
Интраоперационно отмечался массивный спаечный процесс с вовлечением петель тонкой кишки, спаянных между собой и фиксированных к париетальной брюшине в малом тазу, а также выраженное истончение заднего листка апоневроза. Проведены тотальный адгезиолизис и комбинированная сепарация. Без натяжения задний листок ушит нитью Maxon до средней трети, дефект в апоневрозе полностью не ушит ввиду натяжения и истончения листка апоневроза, принято решение об установке антиадгезивной сетки с покрытием Reperen, которая по периметру фиксирована нитью Prolen, учитывая размеры дефекта и истонченный задний листок, на всем протяжении сепарации поверх заднего листка апоневроза и брюшины был установлен сетчатый эндопротез Reperen, который фиксирован к апоневрозу герниостеплером. Произведено дренирование надапоневротического пространства активным дренажом. Верхний листок апоневроза ушит без натяжения. Учитывая свободный лоскут и излишнее количество жировой ткани, после проведенной сепарации передней брюшной стенки выполнена липодермэктомия.
В раннем послеоперационном периоде пациентка находилась в отделении реанимации и интенсивной терапии, где наблюдалась по поводу дыхательной недостаточности в течение 5 суток. Для исключения ТЭЛА выполнена МСКТ-ангиопульмонография. Для исключения абдоминального компартмент-синдрома контролировался уровень внутрибрюшного давления по классической методике, он варьировал в пределах 12-14 мм рт. ст. Проводилась комбинированная анальгезия: внутримышечное введение наркотических анальгетиков (промедол) и эпидуральный блок (ропивакаин), НПВС (кетопрофен, парацетамол); а также профилактика тромбоэмболических осложнений НМГ (фраксипарин 0,4 подкожно 1 раз в сутки).
Дебит серозно-геморрагического отделяемого по дренажу составлял до 100-150 мл/сутки в течение первых трех суток. На 4-е сутки после операции дренаж выпал.
После удаления дренажа при ультразвуковом сканировании мягкие ткани передней брюшной стенки в области послеоперационных швов с умеренно выраженными отечно-инфильтративными изменениями, жидкостные скопления не выявлены.
На 5-е сутки после операции на фоне положительной динамики пациентка переведена в отделение хирургии для дальнейшего лечения, где получала терапию в прежних объемах, начата ее активизация в пределах палаты, ежедневно проводились перевязки.
На 8-е сутки после операции в области послеоперационных швов отека и гиперемии нет. Из межшовного пространства отмечается мутное серозное отделяемое (взят бактериологический посев отделяемого), рана разведена, определяется расхождение верхнего листка апоневроза, в дне раны сетчатый эндопротез, проведена санация раны.
На 9-е сутки пациентка консультирована гнойным хирургом. Рана была разведена в проксимальном направлении на 6 см, общий дефект составляет 10,0 х 6,0 см. Рана повторно санирована, наложена повязка с левомеколем.
По результатам бактериологического посева со среды обогащения выделена Klebsiella pneumoniae, панрезистентная к антибактериальным препаратам. Результаты посева говорят о внутрибольничной флоре. По результатам исследования совместно с клиническим фармакологом был назначен фосфомицин, а в последующем добавлен гентамицин.
Состояние расценено как инфекция области хирургического вмешательства (инфицирование послеоперационных швов с инфицированием установленного эндопротеза или перипротезная инфекция). Принято решение о начале вакуум-терапии.
На 20-е сутки после герниопластики пациентке проведена повторная операция - вторичная хирургическая обработка, наложение вакуум-ассистированной повязки. Вакуум-терапия проводилась в переменном режиме вакуумирования (90/125 мм рт. ст.). Технология заключалась в следующем: в рану укладывалась дренажная одноразовая губка VivanoMedFoam (предварительно смоделированная из заводской заготовки по контуру раны с учетом всех карманов и затеков), далее устанавливался соединительный дренажный порт VivanoTecPort для подключения к VAC-аппарату, и поверх губки и порта устанавливалась пленка Hydrofilm для создания герметизма в ране.
На 25-е сутки после герниопластики, после первого цикла вакуум-терапии после снятия повязки при ревизии размеры раны 30,0 х 20,0 см, дном раны является апоневроз прямых мышц живота, с дефектом в поперечнике 6 см, в центре дефекта определяются сетчатые эндопротезы. Определяются рыхлые наложения фибрина, мутный серозный экссудат (рис. 2). Из раны был взят повторный бактериологический посев. Принято решение о дальнейшем ведении пациентки с использованием вакуум-терапии.
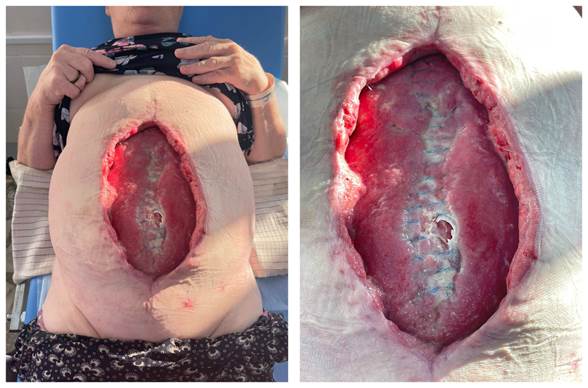
Рис. 2. Общий вид раны после первого цикла вакуум-терапии
На 28-е сутки после первичной герниопластики выполнена вторая операция - вторичная хирургическая обработка раны ультразвуковым деструктором Sonoca-300 с наложение вакуум-ассистированной повязки. В условиях операционной рана была санирована водным раствором хлоргексидина и перекисью водорода. Проведена обработка раны и сетчатого эндопротеза ультразвуковым деструктором Sonoca-300. Установлена вакуум-ассистированная повязка по классической методике. Подключен аппарат отрицательного давления в переменном режиме вакуумирования (90/125 мм рт. ст.).
По результатам повторного бактериологического исследования раневого отделяемого выделены: Corynebacterium spp 1.00*104 КОЕ/мл и Klebsiella pneumoniae 1.00*104 КОЕ/мл. Антибиотикограмма показала результаты, аналогичные предыдущему исследованию – панрезистентный штамм клебсиеллы. Проведена смена антибактериальной терапии, согласованная с клиническим фармакологом. Гентамицин был отменен, продолжен фосфомицин, добавлен полимиксин В.
На 32-е сутки после первичной операции была снята вакуум-ассистированная повязка. При ревизии рана прежних размеров, дно раны покрыто мелкими грануляциями. Остаются участки сетчатого трансплантата без грануляций – сетчатый трансплантат частично иссечен в центре раны, при этом вскрыта серома объемом 30 мл с прозрачным соломенного цвета содержимым, карманы очистились, адгезировались (рис. 3).
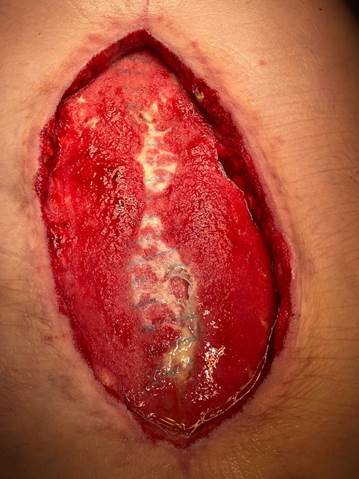
Рис. 3. Общий вид раны после второго цикла вакуум-терапии
Учитывая положительную клиническую динамику, решено продолжить терапию до полного очищения раны. Был проведена третья операция - вторичная хирургическая обработка раны ультразвуковым деструктором Sonoca-300 с наложением вакуум-ассистированной повязки.
Оценивая лабораторную динамику за период госпитализации, стоит отметить, что клинически значимого повышения уровня лейкоцитов крови за весь период не наблюдалось, уровень лейкоцитов оставался в пределах 10 х 109/л, показатели гемоглобина, эритроцитов и тромбоцитов были стабильны в пределах нормальных значений, биохимические показатели крови также были в пределах референсных значений.
Динамика СРБ была более показательна, на 2-е сутки (но на рис. 4 вторых суток нет) после герниопластики отмечалось нарастание уровня С-реактивного белка более 130 мг/л, что связано с операционной травмой, в последующем показатель был выше 90 мг/л на 5-е сутки и постепенно снижался до 20 мг/л к 40-м суткам после первой операции. Такая динамика, вероятно, была обусловлена наличием бактериального инфекционного агента (перипротезная инфекция), поэтапным очищением раны и купированием инфекционного воспаления к моменту выписки из стационара. Динамика С-реактивного белка и уровня лейкоцитов за весь период госпитализации представлена на рисунке 4.
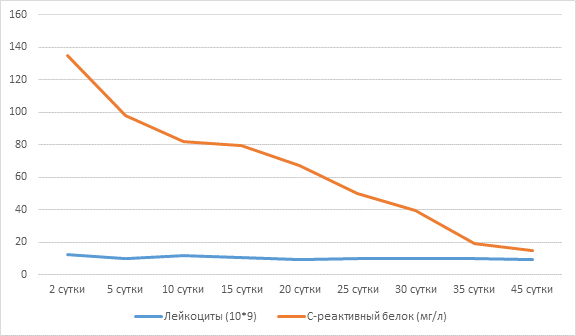
Рис. 4. Динамика С-реактивного белка и уровня лейкоцитов больной Л.
На 40-е сутки при осмотре раны после снятия вакуум-ассистированной повязки: дно послеоперационной раны на всем протяжении покрыто мелкими грануляциями. В средней трети раны имеется часть свободно лежащего сетчатого трансплантата. Учитывая положительную динамику, дальнейшее проведение вакуум-терапии нецелесообразно.
Выполнена четвертая операция - вторичная хирургическая обработка гранулирующей раны, наложение вторичных швов, дренирование надапоневротического пространства системой Редона. Принято решение свободнолежащую часть сетчатого имплантата иссечь. Повторно взято раневое отделяемое на бактериологическое исследование. С целью восстановления анатомичности передней брюшной стенки края апоневроза вместе с сетчатым имплантатом ушиты. Наложены отдельные швы на кожу. Надапоневротическое пространство дренировано системой Редона. Состояние раны и результат наложения вторичных швов представлены на рисунке 5.
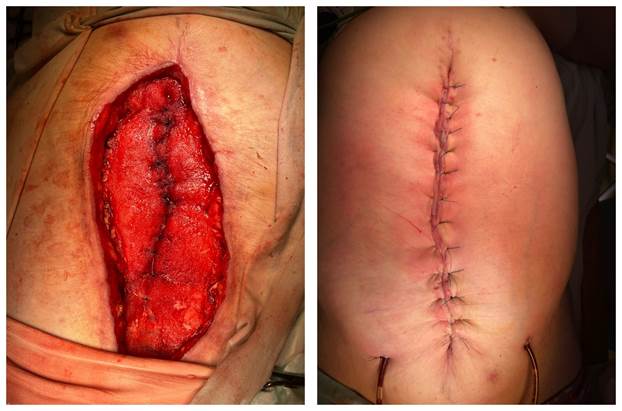
Рис. 5. Общий вид раны после третьего цикла вакуум-терапии с последующим наложением вторичных швов
В послеоперационном периоде пациентка продолжила лечение в условиях хирургического отделения. По результатам последнего бактериологического исследования отделяемого из раны роста Corynebacterium spp и Klebsiella pneumoniae не выявлено. В контрольных анализах крови нормализовался уровень СРБ менее 20 мг/л, гипертермии за весь период госпитализации не наблюдалось, лейкоциты были в пределах референсных значений. Пациентка была выписана из стационара на 47-е сутки после первичной операции (герниопластики) в удовлетворительном состоянии.
Стоит отметить, что выбранный сетчатый имплант имеет действующее регистрационное удостоверение, материал – полипропилен. Клинические рекомендации советуют использование вакуум-терапии при возникновении перипротезной инфекции полипропиленовых сетчатых имплантатов.
В данном конкретном случае о наиболее вероятной причине перипротезной инфекции высказаться определенно не представляется возможным, можно предположить, что имело место неадекватное или непродолжительное дренирование (пациентка удалила дренаж на третьи сутки после операции) на фоне существующего ожирения.
Заключение
Применение вакуум-терапии при перипротезной инфекции после пластики больших и гигантских послеоперационных вентральных грыж в некоторых случаях позволяет избежать эксплантации сетчатого импланта и всех вытекающих отсюда последствий для пациента. Однако выбранная тактика у данного пациента потребовала длительного пребывания в стационаре, значительных финансовых затрат на лечение. Применение вакуум-терапии требует дальнейшего изучения и оценки эффективности лечения при инфекционных осложнениях у данной категории пациентов.
Библиографическая ссылка
Черданцев Д.В., Носков И.Г., Гилаева Д.И., Трофимович Ю.Г., Соломенников В.А., Козлов Е.В. ВАКУУМ-ТЕРАПИЯ ПЕРИПРОТЕЗНОЙ ИНФЕКЦИИ ПОСЛЕ СЕПАРАЦИОННОЙ ПЛАСТИКИ СЕТЧАТЫМ ИМПЛАНТОМ БОЛЬШОЙ ПОСЛЕОПЕРАЦИОННОЙ ВЕНТРАЛЬНОЙ ГРЫЖИ (СЛУЧАЙ ИЗ ПРАКТИКИ) // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33132 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33132



