Нарушения сердечного ритма занимают одну из лидирующих позиций среди кардиоваскулярной патологии во всем мире. Так, экстрасистолия (ЭС) в популяции встречается очень широко, являясь самой распространенной аритмией, и регистрируется, по различным данным, до 95% индивидуумов, имеет не только органическую, но и функциональную природу происхождения [1–3]. В том случае, если число зарегистрированных в сутки ЭС невелико, они являются единичными, монотопными, пациенту медикаментозная терапия по коррекции нарушений ритма не назначается, и под наблюдение кардиолога такой пациент не попадает. ЭС высоких градаций считается более опасной и может привести к развитию других, более серьезных аритмий, в связи с чем подлежит медикаментозной коррекции. Однако при оценке риска развития возможных осложнений даже при высоких градациях ЭС среди них не указывается возможная роль данного нарушения ритма в развитии артериальных сосудистых событий (атеротромботических, тромбоэмболических осложнений), таких как ишемический инсульт (ИИ), инфаркт миокарда (ИМ), дистальных тромбозов и эмболий в других артериальных бассейнах. В ряде работ ранее упоминалась более частая встречаемость ИИ у пациентов с частой ЭС, однако механизм остался неизученным и необъясненным [4, 5]. Впервые о значении ЭС в развитии данной категории сосудистых осложнений авторы данной статьи упоминали в ранее опубликованных работах [6, 7].
Второе по частоте встречаемости нарушение ритма – фибрилляция предсердий (ФП) – является доказанной причиной кардиоэмболических осложнений, чаще всего ИИ [8–12]. Однако практически работающему кардиологу и неврологу известно немало случаев развития ИИ у пациента с ФП даже при отсутствии внутрисердечных тромбов и находящегося на постоянной терапии антикоагулянтами. При этом до сих пор до 45% всех подтвержденных случаев ИИ имеют неустановленную природу [13]. Возможно ли существование других механизмов развития сосудистых осложнений у данной категории пациентов?
Цель исследования: установить взаимосвязь нарушений сердечного ритма и развития артериальных сосудистых событий в различных артериальных бассейнах (ИИ, ИМ, дистальных тромбозов и эмболий), а также объяснить возможные механизмы их развития.
Материал и методы исследования. Проводилось одноцентровое проспективное исследование на базе Самарского государственного медицинского университета. В нем приняли участие 886 пациентов от 42 до 79 лет, среди них 432 женщины и 454 мужчины. В зависимости от выявленного нарушения ритма пациенты были разделены на подгруппы. 1А подгруппу (192 человека) составили пациенты с ЭС 700 и более в сутки; при этом момент возникновения систолы желудочков ЭС возникал до пика трансмитрального кровотока в кардиоцикле (пик Е по данным переменно-волнового допплера на ЭхоКГ). 1Б подгруппа (442 человека) – пациенты с ЭС 700 и более в сутки; при этом момент возникновения систолы желудочков ЭС возникал после пика трансмитрального кровотока в кардиоцикле. В подгруппу 2А вошли 74 пациента с постоянной формой ФП; при этом максимальные RR интервалы не превышали 1,5 секунды. 2Б подгруппу составили 72 пациента с постоянной формой ФП с максимальной продолжительностью RR интервалов 1,5 и более секунды. Группа контроля – 106 человек, у которых не было ФП и количество ЭС в сутки не превышало 700. Разделение на 1А и 1Б подгруппы с ЭС осуществлялась независимо от эктопии, но по принципу биомеханики, а именно момента систолы желудочков ЭС в кардиоцикле. Группа 1Б была несколько больше, чем 1А, поскольку данный вариант ЭС встречался чаще. На этапе отбора пациентов авторы постарались свести к минимуму возможное влияние традиционных факторов риска артериальных сосудистых событий. Так, в числе критериев исключения были: устойчивая артериальная гипертензия (более 160 и 100 мм рт. ст.); верифицированный внутрисердечный тромбоз; аневризмы левого желудочка или аорты; тяжелая сердечная недостаточность (NYHAIII и более) и ХБП (3-й стадии и более); выявленные гемодинамически значимые стенозы любых локализаций; гематологические заболевания, протезированные клапаны сердца; клапанная форма ФП; ИМ, ИИ или другие сосудистые осложнения давностью менее 1 года; кардиомиопатии; длительный стаж курения; ХОБЛ более чем легкой степени тяжести и др.
В числе инструментальных методов исследования были выполнены трансторакальная или чреспищеводная эхокардиография (ЭхоКГ); суточное мониторирование ЭКГ по Холтеру; стресс-ЭхоКГ с физической нагрузкой; цифровая апекскардиография (АКГ) и сфигмография (СГ) общей сонной, задней артерии голени; ультразвуковое дуплексное сканирование брахиоцефальных артерий (УЗДГ БЦС), брюшного отдела аорты и ее ветвей, артерий нижних конечностей (АНК); коронарная ангиография. При суточном мониторировании ЭКГ анализировали выявленные нарушения ритма, на основе чего осуществлялось распределение пациентов по вышеописанным группам. При УЗДГ БЦС определялись наличие и выраженность атеросклеротического поражения; в случае выявления атером при анализе процента стеноза по диаметру применялись международные шкалы ECST, NASCET и St. Mary’s ratio. При градации бляшек применялась классификация Gray–Weale–Nikolaides. Во время выполнения ЭхоКГ особое внимание обращали на отсутствие внутрисердечных тромбов любой локализации, а также в случае ЭС определяли момент систолы желудочков ЭС в кардиоцикле относительно пика Е на ЭхоКГ при оценке трансмитрального кровотока. При анализе цифровых АКГ и СГ рассчитывали скорость, ускорение, мощность, работу как наиболее значимые параметры сердечной биомеханики и артериальной кинетики. Выполнялись также лабораторные методы исследования, которые в обязательном порядке включали определение гемостазиограммы и развернутой липидограммы. Все пациенты находились на стандартной терапии, рекомендованной Российским обществом кардиологов. Так, пациенты 2А и 2Б подгрупп с ФП принимали пероральные антикоагулянты (ривароксабан, или апиксабан, или дабигатран) в соответствующих дозировках.
Проспективное наблюдение проводилось в течение 1 года от начала исследования. Контрольные комбинированные конечные точки – развитие артериальных сосудистых событий в различных артериальных бассейнах (ИИ, ИМ, тромбозы и эмболии в других сосудистых регионах).
При статистической обработке данных каждый анализируемый параметр оценивался на нормальность распределения. При нормальном распределении признака в группах применялись методы параметрической статистики: характеристика количественных переменных производилась в виде среднего значения и стандартного отклонения, а межгрупповые сравнения проводились при помощи однофакторного дисперсионного анализа с указанием значений критерия F, степеней свободы (df) и статистической значимости модели (p). При нарушении нормальности распределения количественные показатели характеризовались медианами и квартилями 1 и 3 (Q1 и Q3), а межгрупповые сравнения проводились методом Краскела–Уоллиса с указанием значения статистики H и значения p. Категориальные переменные характеризовались путем указания частот и процентов. Распределение категориальных параметров между анализируемыми группами оценивалось путем создания таблиц сопряженности частот и последующей их оценки с помощью критерия Фишера или χ2-теста для случаев, когда частота в любой из ячеек таблицы превышала 5. Статистически достоверными считали различия между параметрами групп при р≤0,05.
Результаты исследования и их обсуждение. При анализе клинических, лабораторных и инструментальных данных исходно пациенты выделенных групп были равнозначны (табл. 1, 2, рис. 1).
Таблица 1
Клиническая характеристика пациентов 1А, 1Б подгрупп и контрольной группы
|
Показатель |
Категория |
Группа |
Статистика |
||
|
1А N=192 |
1Б N=442 |
Контроль N=106 |
|||
|
Возраст, лет, медиана, (Q1, Q3)1 |
|
64 (59; 69) |
64 (58; 68) |
62 (55; 67) |
H=5,755, p=0,056 |
|
Пол, n (%)2 |
ж |
94 (49,0) |
216 (48,9) |
52 (49,1) |
χ2=0,001, df=2, p=0,999 |
|
м |
98 (51,0) |
226 (51,1) |
54 (50,9) |
||
|
Курение, n (%)2 |
Да |
39 (20,3) |
97 (22,0) |
22 (20,8) |
χ2=0,239, df=2, p=0,887 |
|
Артериальная гипертензия, n (%)2 |
1-й степени |
78 (40,6) |
174 (39,4) |
44 (41,5) |
χ2=1,358, df=4, p=0,852 |
|
2-й степени |
98 (51,0) |
224 (50,7) |
55 (51,9) |
||
|
Нет |
16 (8,3) |
44 (10,0) |
7 (6,6) |
||
|
ИМТ, медиана, (Q1, Q3) 1 |
|
27 (24,0; 31,0) |
27 (23,0; 31,0) |
27 (23,0; 30,0) |
H=0,033, p=0,983 |
|
ХОБЛ, n (%)2 |
Да |
36 (18,8) |
88 (19,9) |
17 (16,0) |
χ2=0,847, df=2, p=0,655 |
|
СД 2 типа, n (%)2 |
Да |
20 (10,4) |
48 (10,9) |
18 (17,0) |
χ2=3,486, df=2, p=0,175 |
|
ХБП, n (%)2 |
1-й стадии |
26 (13,5) |
57 (12,9) |
15 (14,2) |
χ2=0,192, df=4, p=0,996 |
|
2-й стадии |
17 (8,9) |
41 (9,3) |
9 (8,5) |
||
|
Нет |
149 (77,6) |
344 (77,8) |
82 (77,4) |
||
|
ХСН: NYHAI, n (%)2 |
Да |
115 (59,9) |
238 (53,9) |
61 (57,6) |
χ2=2,116, df=2, p=0,347 |
|
ХСН: NYHAII, n (%)2 |
Да |
77 (40,1) |
204 (46,2) |
45 (42,5) |
χ2=2,116, df=2, p=0,348 |
|
Стабильная стенокардия напряжения, n (%)2 |
I ФК |
95 (49,5) |
220 (49,8) |
54 (50,9) |
χ2=0,452, df=4, p=0,978 |
|
II ФК |
65 (33,9) |
154 (34,8) |
34 (32,1) |
||
|
Нет |
32 (16,7) |
68 (15,4) |
18 (17,0) |
||
|
ИМ в анамнезе, n (%)2 |
Да |
38 (19,8) |
87 (19,7) |
21 (19,8) |
χ2=0,676, df=4, p=0,954 |
|
ОНМК, ТИА в анамнезе, n (%)2 |
Да |
13 (6,8) |
34 (7,7) |
7 (6,6) |
χ2=0,256, df=2, p=0,880 |
|
Дистальные эмболии в анамнезе, n (%)2 |
Да |
1 (0,5) |
3 (0,7) |
1 (0,9) |
χ2=0,182, df=2, p=0,913 |
|
Гипокинезия локальной сократимости ЛЖ, n (%) |
Да |
48 (25,0) |
131 (29,6) |
20 (18,9) |
χ2=5,516, df=2,000, p=0,063 |
|
Любые стенозы по данным КАГ, n (%) |
Да |
160 (83,3) |
374 (84,6) |
88 (83,0) |
χ2=0,263, df=2,000, p=0,877 |
|
УЗДГ БЦС: Гемодинамически не значимый стеноз, n (%) |
Да |
67 (34,9) |
156 (35,3) |
38 (35,9) |
χ2=0,027, df=2,000, p=0,986 |
|
УЗДГ БЦС: Бляшка III Б, n (%) |
Да |
31 (16,2) |
69 (15,6) |
16 (15,1) |
χ2=0,061, df=2,000, p=0,970 |
|
УЗДГ АНК: Гемодинамически не значимый стеноз, n (%) |
Да |
21 (10,9) |
53 (12,0) |
13 (12,3) |
χ2=0,174, df=2,000, p=0,917 |
1 Критерий Краскела–Уоллиса; 2 χ2-тест Пирсона
Таблица 2
Клиническая характеристика пациентов 2А, 2Б подгрупп и контрольной группы
|
Показатель |
Катего-рия |
Группа |
Статистика |
||
|
2А N=74 |
2Б N=72 |
Контроль N=106 |
|||
|
Возраст, годы, среднее (ст. откл.)1 |
63,6 (7,2) |
63,9 (7,4) |
61,7 (8,1) |
F=2,302, p=0,102 |
|
|
Пол, n (%)2 |
ж |
36 (48,7) |
34 (47,2) |
52 (49,1) |
χ2=0,060, df=2,000, p=0,970 |
|
м |
38 (51,4) |
38 (52,8) |
54 (50,9) |
||
|
Курение, n (%)2 |
Да |
15 (20,3) |
15 (20,8) |
22 (20,8) |
χ2=0,009, df=2,000, p=0,996 |
|
Артериальная гипертензия, n (%)2 |
1-й степени |
31 (41,9) |
29 (40,3) |
44 (41,5) |
χ2=0,507, df=4,000, p=0,973 |
|
2-й степени |
39 (52,7) |
37 (51,4) |
55 (51,9) |
||
|
Нет |
4 (5,4) |
6 (8,3) |
7 (6,6) |
||
|
ИМТ, медиана (Q1, Q3)3 |
28,0 (23,3, 31,0) |
28,0 (25,0, 31,3) |
27,0 (23,3, 30,0) |
H=1,789, p=0,409 |
|
|
ХОБЛ, n (%)2 |
Да |
15 (20,3) |
14 (19,4) |
17 (16,0) |
χ2=0,619, df=2,000, p=0,734 |
|
СД 2-го типа, n (%)2 |
Да |
8 (10,8) |
8 (11,1) |
18 (17,0) |
χ2=1,911, df=2,000, p=0,385 |
|
ХБП, n (%)2 |
Нет |
56 (75,7) |
57 (79,2) |
82 (77,4) |
χ2=0,471, df=4,000, p=0,976 |
|
1-й стадии |
10 (13,5) |
9 (12,5) |
15 (14,2) |
||
|
2-й стадии |
8 (10,8) |
6 (8,3) |
9 (8,5) |
||
|
ХСН: NYHAI, n (%)2 |
Да |
43 (58,1) |
39 (54,2) |
61 (57,6) |
χ2=0,279, df=2,000, p=0,870 |
|
ХСН: NYHAII, n (%)2 |
Да |
31 (41,9) |
33 (45,8) |
45 (42,5) |
|
|
Стабильная стенокардия напряжения, n (%)2 |
Нет |
12 (16,2) |
10 (13,9) |
18 (17,0) |
χ2=1,041, df=4,000, p=0,904 |
|
I ФК |
35 (47,3) |
34 (47,2) |
54 (50,9) |
||
|
II ФК |
27 (36,5) |
28 (38,9) |
34 (32,1) |
||
|
ИМ в анамнезе, n (%)2 |
Да |
15 (20,3) |
14 (19,4) |
21 (19,8) |
χ2=0,016, df=2,000, p=0,992 |
|
ОНМК, ТИА в анамнезе, n (%)2 |
Да |
5 (6,8) |
4 (5,6) |
7 (6,6) |
χ2=0,108, df=2,000, p=0,947 |
|
Дистальные эмболии в анамнезе, n (%)2 |
Да |
1 (1,4) |
0 (0,0) |
1 (0,9) |
χ2=0,899, df=2,000, p=0,638 |
|
Гипокинезия локальной сократимости ЛЖ, n (%) |
Да |
16 (21,6) |
18 (25,0) |
20 (18,9) |
χ2=0,960, df=2,000, p=0,619 |
|
Стенозы по данным КАГ, n (%) |
Да |
62 (83,8) |
62 (86,1) |
88 (83,0) |
χ2=0,316, df=2,000, p=0,854 |
|
УЗДГ БЦС: Гемодинамически не значимый стеноз, n (%) |
Да |
26 (35,1) |
24 (33,3) |
38 (35,9) |
χ2=0,122, df=2,000, p=0,941 |
|
УЗДГ БЦС: Бляшка IIIБ, n (%) |
Да |
11 (14,9) |
12 (16,7) |
16 (15,1) |
χ2=0,111, df=2,000, p=0,946 |
|
УЗДГ АНК: Гемодинамически не значимый стеноз, n (%) |
Да |
8 (10,8) |
8 (11,1) |
13 (12,3) |
χ2=0,106, df=2,000, p=0,948 |
1 1-факторная ANOVA; 2 χ2-тест Пирсона; 3 Критерий Краскела–Уоллиса
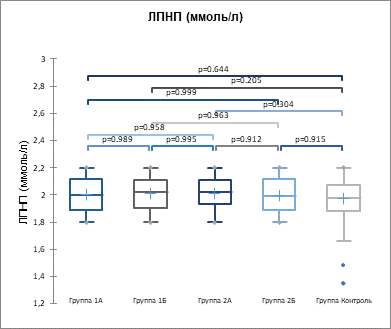
Рис. 1. Показатели ЛПНП (ммоль/л) у пациентов подгрупп 1А, 1Б, 2А, 2Б (p>0,05)
При анализе контрольной комбинированной конечной точки в течение 1 года у пациентов с ЭС 700 и более в сутки зарегистрирована достоверно большая частота встречаемости артериальных осложнений в сравнении с группой контроля, особенно в подгруппе 1А – при ЭС, с систолой желудочков ЭС до пика Е на ЭхоКГ (табл. 3).
Таблица 3
Отдаленные осложнения в течение 1 года в подгруппах 1А и 1Б и группе контроля
|
Осложнение
|
Группа |
p, точный критерий Фишера |
|||
|
1А N=192 |
1Б N=442 |
Контроль N=106 |
|||
|
ИМ в течение 1 года, n (%) |
Есть |
11 (5,7) |
12 (2,7) |
2 (1,9) |
0,131 |
|
Нет |
181 (94,3) |
430 (97,3) |
104 (98,1) |
||
|
ОНМК в течение 1 года, n (%) |
Есть |
18 (9,4) |
17 (3,9) |
1 (0,9) |
0,002 |
|
Нет |
174 (90,6) |
425 (96,2) |
105 (99,1) |
||
|
Дистальные эмболии в течение 1 года, n (%) |
Есть |
7 (3,7) |
1 (0,2) |
0 (0,0) |
0,001 |
|
Нет |
185 (96,4) |
441 (99,8) |
106 (100,0) |
||
|
Любое осложнение в течение 1 года, n (%) |
Есть |
36 (18,8) |
30 (6,8) |
3 (2,8) |
0,000 |
|
Нет |
156 (81,3) |
412 (93,2) |
103 (97,2) |
||
Так, у пациентов с «ранней» ЭС с систолой желудочков ЭС до пика ТК в кардиоцикле в количестве от 700 и более в сутки ОШ=7,923 (2,377, 26,406), z=3,370, p<0,001, в то же время у пациентов «поздней» ЭС с систолой желудочков ЭС после пика ТК в кардиоцикле в количестве от 700 и более в сутки – ОШ=2,500 (0,748, 8,353), z=1,489, p=0,137. Следует отметить, что наличие любой ЭС в количестве 700 в сутки общее характеризовалось ОШ=3,989 (1,231, 12,930), z=2,306, p=0,021. Следовательно, для развития артериальных сосудистых событий имело значение не только количество ЭС более 700 в сутки, но также и их качество, а именно – в какую фазу кардиоцикла они возникали.
При анализе контрольной конечной точки в течение 1 года у пациентов с постоянной формой ФП зарегистрирована статистически достоверно большая частота встречаемости артериальных сосудистых осложнений в подгруппе 2Б в сравнении с подгруппой 2А и группой контроля (табл. 4).
Таблица 4
Отдаленные осложнения в течение 1 года в подгруппах 1А и 1Б и группе контроля
|
Осложнение
|
Группа |
p, точный критерий Фишера |
|||
|
2А N=74 |
2Б N=72 |
Контроль N=106 |
|||
|
ИМ в течение 1 года, n (%) |
Есть |
2 (2,7) |
4 (5,6) |
2 (1,9) |
0,348 |
|
Нет |
72 (97,3) |
68 (94,4) |
104 (98,1) |
||
|
ОНМК в течение 1 года, n (%) |
Есть |
2 (2,7) |
8 (11,1) |
1 (0,9) |
0,005 |
|
Нет |
72 (97,3) |
64 (88,9) |
105 (99,1) |
||
|
Дистальные эмболии в течение 1 года, n (%) |
Есть |
1 (1,4) |
2 (2,8) |
0 (0) |
0,119 |
|
Нет |
73 (98,7) |
70 (97,2) |
106 (100) |
||
|
Любое осложнение в течение 1 года, n (%) |
Есть |
5 (6,8) |
14 (19,4) |
3 (2,8) |
<0,001 |
|
Нет |
69 (93,2) |
58 (80,6) |
103 (97,2) |
||
Иными словами, имеет значение, по нашему мнению, максимальная продолжительность интервалов RR при ФП для прогноза отдаленных осложнений, и, с этой точки зрения, паузы между сокращением желудочков ≥1,5 секунды являются наиболее неблагоприятными. Такие паузы могут регистрироваться не только при брадисистолической, но и при нормосистолической форме ФП.
Для объяснения полученных закономерностей были проанализированы гемодинамические и кинетические параметры, характеризующие каждый вариант аритмии в выделенных нами подгруппах. Основными параметрами были: линейная скорость кровотока (ЛСК) и объемный кровоток на общей сонной и задней артерии голени по данным УЗДГ БЦС; скорость, ускорение, мощность, работа на общей сонной и задней артерии голени по данным цифровых АКГ и СГ. Для пациентов 1А и 1Б подгрупп данные параметры вычисляли для регулярного, ЭС и первого постэкстрасистолического (1ПЭС) кардиоцикла; а для пациентов 2А и 2Б подгрупп – для кардиоцикла, следующего после максимального RR интервала.
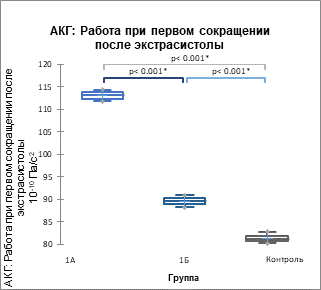
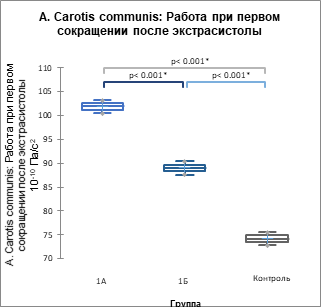
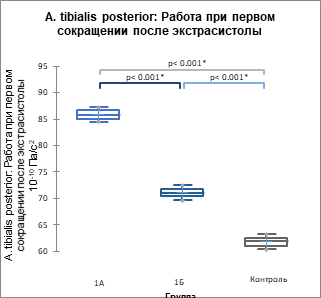
Основные данные гемодинамики представлены в таблицах 5, 6 а основной интегральный параметр (работа) сердечной биомеханики и артериальной кинетики – на рисунках 2, 3.
Таблица 5
ЛСК, объемный кровоток, в 1ПЭС в 1А и 1Б подгруппах и группе контроля
|
Параметр / группа |
Артерия |
1А N=192 |
1Б N=442 |
Контрольная группа N=106 |
p |
|
ЛСК, см/с, медиана (Q1; Q3)1 |
Общая сонная артерия |
82,8 (108,0, 126,0) |
75,0 (89,0, 102,0) |
52,3 (61,0, 74,8) |
H=239,380, p=0,000 |
|
Задняя артерия голени |
52,0 (63,0, 70,3) |
46,0 (54,0, 63,0) |
30,0 (39,5, 48,8) |
H=187,833, p=0,000 |
|
|
Объемный кровоток, мл/мин, медиана (Q1; Q3)1 |
Общая сонная артерия |
489,0 (507,5, 522,3) |
408,3 (420,0, 432,0) |
306,3 (318,5, 335,0) |
H=566,521, p=0,000 |
|
Задняя артерия голени |
38,0 (45,0, 52,0) |
31,0 (37,0, 42,0) |
24,0 (29,0, 34,0) |
H=239,191, p=0,000 |
Примечание: каждый параметр различается попарно между группами при p<0,001
1 Критерий Краскела–Уоллиса
Таблица 6
ЛСК, объемный кровоток при распространении пульсовой волны после максимальной продолжительности RR интервала в 2А и 2Б подгруппах и группе контроля
|
Параметр / группа |
Артерия |
2A N=74 |
2Б N=72 |
Контроль N=106 |
Статистика |
|
ЛСК, см/с, медиана (Q1; Q3)1 |
Общая сонная артерия |
70,8 (82,0, 93,0) |
81,5 (100,5, 118,0) |
52,3 (61,0, 74,8) |
H=118,586, p=0,000 |
|
Задняя артерия голени |
40,0 (43,0, 48,0) |
47,0 (63,5, 72,3) |
30,0 (39,5, 48,8) |
H=91,797, p=0,000 |
|
|
Объемный кровоток, мл/мин., медиана (Q1; Q3)1 |
Общая сонная артерия |
385,0 (391,0, 402,8) |
482,5 (491,0, 505,0) |
306,3 (318,5, 335,0) |
H=220,141, p=0,000 |
|
Задняя артерия голени |
30,0 (35,0, 40,0) |
41,8 (46,0, 51,0) |
24,0 (29,0, 34,0) |
H=128,466, p=0,000 |
Примечание: каждый параметр различается попарно между группами при p<0,001
1 Критерий Краскела–Уоллиса
 А
А
 Б
Б
 В
В
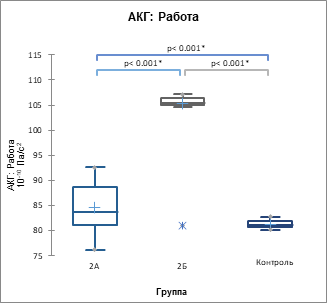
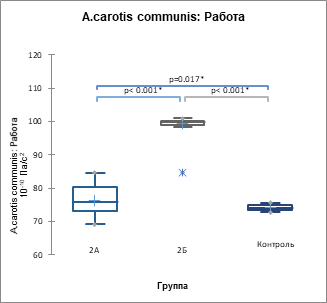
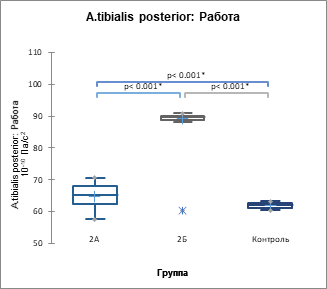
Рис. 2. Показатель суммарной работы по данным цифровых АКГ (А), СГ ОСА (Б) и СГ задней артерии голени (В) (р<0,001) у пациентов 1А, 1Б подгрупп и контрольной группы, 10-10 Па/с2
 А
А
 Б
Б
 В
В
Рис. 4. Показатель суммарной работы по данным цифровых АКГ (А), СГ ОСА (Б) и СГ задней артерии голени (В) (р<0,001) у пациентов 2А, 2Б подгрупп и контрольной группы, 10-10 Па/с2
В 1ПЭС происходит возрастание всех проанализированных параметров гемодинамики, сердечной биомеханики и артериальной кинетики, причем максимальный прирост наблюдается при ЭС с систолой желудочков до пика трансмитрального кровотока Е на ЭхоКГ в кардиоцикле. Иными словами, момент систолы желудочков ЭС в кардиоцикле имеет предопределяющее значение для параметров гемодинамики, биомеханики и кинетики 1ПЭС, следующего за данной ЭС.
Возросшие гемодинамические и кинетические параметры волны 1ПЭС или после длительного RR интервала при ФП сопровождаются, по нашему мнению, появлением так называемого феномена гидравлического удара. Под данным термином подразумевается дополнительное воздействие на стенку артериальных сосудов, возникающее вследствие увеличения ЛСК и возрастания внутрисосудистого давления при прохождении волны 1ПЭС или пульсовой волны после длительного RR интервала ЭКГ при ФП. На фоне мультифокального атеросклероза многократное влияние «гидравлического удара» при частой ЭС, ФП с максимальными интервалами RR 1,5 и более секунд приводит к хронической травматизации уже имеющихся атером магистральных артерий. В итоге это может представлять опасность для развития отдаленных осложнений даже в случае наличия гемодинамически не значимых бляшек. Так, если они имеют признаки нестабильности (неровный контур, гетерогенность с включением кальция и др.), то повторяющийся механический эффект феномена «гидравлического удара» способен стать своеобразным триггерным механизмом для сосудистых осложнений, приводя к развитию тромбозов на бляшке, надрывам, а также эмболии части атеромы по ходу артериального сосуда. Данный механизм может стать ключевым в объяснении возможных причин развития части криптогенных ИИ, когда кардиоэмболические причины были исключены.
Существование феномена «гидравлического удара» также было подтверждено нами ранее в эксперименте с применением разработанного нами «Устройства для моделирования артериального кровообращения» (патент № 202780), а также была показана его роль в формировании осложненной атеромы.
Выводы
1. При нарушениях сердечного ритма в артериальной сосудистой системе формируется феномен «гидравлического удара» – явление дополнительного механического воздействия на стенку артериальных сосудов, возникающее вследствие увеличения ЛСК и возрастания внутрисосудистого давления при прохождении волны 1ПЭС или пульсовой волны после длительного RR интервала ЭКГ при ФП.
2. ЭС – дополнительный фактор риска артериальных сосудистых осложнений в различных артериальных бассейнах. Риск осложнений повышается при ЭС 700 и более в сутки, а также при наличии ЭС с систолой желудочков до пика трансмитрального кровотока в кардиоцикле, независимо от эктопии (пика Е на ЭхоКГ).
3. При постоянной форме ФП с максимальной продолжительностью RR интервала 1,5 и более секунд риск развития артериальных сосудистых осложнений повышается. В связи с этим в терапии таких пациентов может быть рекомендована коррекция ЧСС для избегания длительных пауз между кардиоциклами.
Библиографическая ссылка
Германова О.А., Щукин Ю.В. НАРУШЕНИЯ СЕРДЕЧНОГО РИТМА КАК ФАКТОР РИСКА АРТЕРИАЛЬНЫХ СОСУДИСТЫХ ОСЛОЖНЕНИЙ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33131 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33131



