Взаимодействие иммунной и нервной систем играет важную роль в обеспечении гомеостаза организма. Секретируемые клетками иммунной системы молекулы – цитокины, хемокины, пептиды тимуса – не только участвуют в регуляции состояния иммунной системы, но могут влиять на функциональную активность нервной системы. К классу регуляторных молекул иммунной системы относятся пептиды костного мозга – миелопептиды, структура и функции в иммунной системе которых довольно полно изучены [1]. Было также показано, что иммуномодулирующий препарат Миелопид, содержащий миелопептиды, влияет на поведение и болевую чувствительность животных, что позволило высказать предположение о том, что миелопептиды являются «коммуникаторами», обеспечивающими взаимодействие иммунной и нервной систем [2]. К сожалению, работы в этой области не имели продолжения. Изучая действие иммуномодуляторов на развитие хронической зависимости от морфина у животных, мы показали, что Миелопид тормозил развитие зависимости и поддерживал нормальное состояние иммунной системы, нарушенное потреблением морфина животными [3; 4]. В экспериментах in vitro на нейробластоме мыши была обнаружена способность входящих в состав Миелопида миелопептидов вызывать дифференцировку нейробластов и их нейропротекторные свойства при токсическом действии морфина, а также при депривации кислорода и глюкозы [5]. Миелопептиды замедляли развитие толерантности к морфину, влияя на анальгетические свойства морфина на уровне спинального рефлекса и центральных механизмов восприятия боли [6]. Эти данные подтверждают гипотезу о том, что спектр биологической активности миелопептидов может быть шире, чем регуляция активности иммунной системы, делая изучение их эффектов в нервной системе актуальным. Целью представленной работы являлось изучение действия миелопептидов на синаптическую пластичность гиппокампа интактных мышей и животных со сформированной хронической зависимостью от морфина. Полученные данные позволят получить экспериментальное подтверждение того, что пептиды костного мозга являются не только иммунорегуляторами, но могут влиять на функциональную активность нервной системы.
Методы и материалы исследования
В работе использовали самцов мышей линии C57BL/6 в возрасте 2-3 месяцев, полученных из вивария конвенциональных животных ФИЦ ИЦиГ СО РАН. Животных содержали при световом режиме 12 часов день/ночь, температуре +22 °С и свободном доступе к воде и пище. Опыты были проведены на 39 животных, из мозга которых были получены по 2-4 среза гиппокампа. До начала экспериментов мыши проходили двухнедельную адаптацию к условиям лабораторного вивария. Хроническую зависимость от морфина вызывали у животных, используя протокол [6], кратко, морфин гидрохлорид (10 мг/кг массы) вводили животным внутрибрюшинно дважды в течение 5 дней и однократно на 6-й день, после чего через 2 часа животных использовали для электрофизиологических экспериментов. Все процедуры проводили в соответствии с законодательством Российской Федерации, Европейскими правилами обращения с лабораторными животными (Directive 2010/63/EU от 22 сентября 2010 года) и протоколом эксперимента, утвержденным Комитетом по биомедицинской этике ФИЦ ФТМ.
Препараты: морфина гидрохлорид (Московский эндокринный завод); миелопептиды: МП1 – Phe-Leu-Gly-Phe-Pro-Thr; МП2 – Leu-Val-Val-Tyr-Pro-Trp; МП3 – Leu-Val- Cys-Tyr-Pro-Gln; МП4 – Phe-Arg-Pro-Arg-Ile-Met-Trp-Pro; МП5 – Val-Val-Tyr-Pro-Asp; МП6 – Val-Asp-Pro-Pro синтезированы в ИБХ РАН и любезно предоставлены д.б.н. А.М. Сапожниковым.
Мышей забивали цервикальной дислокацией, мозг животного быстро извлекали и на 1 минуту помещали в максимально охлажденный (температура не выше 4 °C), предварительно газированный карбогеном (газовая смесь 95% O2 и 5% CO2) раствор для приготовления срезов. Поперечные срезы толщиной 400 мкм получали при помощи виброслайсера NVSL (World Precision Instruments, США). Состав раствора для приготовления срезов в мM: 124 NaCl, 4.4 KCl, 1 NaH2PO4, 1.3 MgSO4, 26 NaHCO3, 10 D-глюкоза, pH 7,4. После часового адаптационного периода в аэрируемой карбогеном среде (124 NaCl, 4.4 KCl, 26 NaHCO3, 1 NaH2PO4, 2.5 CaCl2, 1.3 MgSO4, 10 D-глюкоза, pH 7.4) срезы переносили в экспериментальную камеру со средой того же состава. Все эксперименты в дальнейшем проводили при комнатной температуре.
Внеклеточную регистрацию суммарных возбуждающих постсинаптических потенциалов (ВПСП) в системе синаптических связей «коллатерали Шаффера – пирамидные нейроны области СА1» вели при помощи стеклянных микроэлектродов, изготовленных из боросиликатного стекла диаметром 1,5 мм, заполненных той же средой и имевших сопротивление 2–5 МОм, размещенных в области stratum radiatum СА1. Стимуляцию проводили биполярным концентрическим металлическим электродом (World Precision Instruments), размещенным в области коллатералей Шаффера. Стимулы (прямоугольные импульсы постоянного тока длительностью 100 мкс и амплитудой 30–150 мкА) наносились при помощи стимулятора A310 Accupulser (World Precision Instruments, США) и изолирующего устройства A 360 (WPI). Для выбора интенсивности стимуляции использовали метод парной фасилитации (два стимула одинаковой амплитуды и длительности с интервалом 50 мсек), в последующем для тетанизации применяли амплитуду стимула, при которой поп-спайк появлялся в ответе только на второй стимул [7]. Выбранная таким образом амплитуда обычно составляла 30-50% от амплитуды стимула, вызывающего максимальный ответ.
В дальнейшем возбуждающие постсинаптические потенциалы (ВПСП) регистрировали с интервалом 2 или 4 минуты. Высокочастотную стимуляцию (3 пачки импульсов длительностью 1 сек., частотой 100 Гц, интервал между пачками 10 сек.) проводили дважды с интервалом 10 мин. и использовали для индукции длительной посттетанической потенциации (ДПТП). Электрический сигнал оцифровывали при помощи Digidata 1200 (Axon Instruments) с частотой 10 кГц и анализировали pCLAMP software (Axon Instruments, Molecular Devices, USA). Амплитуда ВПСП была нормализована по отношению к 10-минутному контрольному периоду (базовая линия) перед тетанизацией. Ответы регистрировали в течение 1 часа после тетанизации и представляли как амплитуду ВПСП, нормализованную по отношению к базовой линии.
Миелопептиды предварительно растворяли во внешнем физиологическом растворе и вносили в экспериментальную камеру в конечной концентрации 0,01 мкг/мл. Стандартная схема эксперимента состояла в следующем: срез гиппокампа помещали в экспериментальную камеру и после размещения электродов вызывали парную фасилитацию, что позволяло определить величину тестового стимула для последующего эксперимента. Срезы, в которых не удавалось получить парной фасилитации, в дальнейшем не использовали. Далее в течение 10 мин. регистрировали ответы на тестовый стимул для определения базовых характеристик ВПСП (Baseline). В экспериментах, в которых не использовали анализируемые вещества (контроль), тетанизацию проводили в момент времени t = 10 мин. При анализе действия каждого из веществ (МП1 – МП6), его добавляли в экспериментальную камеру в момент времени t = 10 мин., в течение 20 мин. регистрировали базовые параметры ВПСП в ответ на тестовый стимул и проводили тетанизацию в момент времени t = 30 мин. Миелопептиды оставались в экспериментальном растворе до конца эксперимента. Регистрацию ответов после тетанизации вели в течение 60 мин.
Статистическую обработку результатов проводили с использованием программы Microcal Origin (OriginLab, USA). Достоверность различий оценивали после проверки нормальности распределения данных. При нормальном распределении данных достоверность различий оценивали с помощью параметрического t-критерия Стьюдента. При ненормальном распределении для оценки достоверности различий использовали дисперсионный анализ. С его помощью выделяли факторы, оказывающие достоверное влияние на выявленные различия, затем группы сравнивали попарно с использованием непараметрических критериев Манна-Уитни в случае сравнения зависимых совокупностей или критерия Вилкоксона при сравнении независимых групп.
Результаты исследования и их обсуждение
Влияние миелопептидов на синаптическую пластичность гиппокампа изучали на модели длительной посттетанической потенциации (ДПТП), представляющей собой долговременное повышение эффективности синаптической передачи после кратковременной высокочастотной стимуляции (тетанизации). ДПТП является наиболее изученной моделью синаптической пластичности, с использованием этой модели исследовали молекулярные и клеточные механизмы пластичности [8-10]. Обычно при формировании ДПТП могут быть выделены следующие фазы: индукция потенциации, длящаяся несколько минут, кратковременная потенциация (до 30 минут), затем развитие и поддержание ДПТП; каждая из этих стадий обеспечивается конкретными молекулярными механизмами [9; 10].
Данные, полученные в электрофизиологических экспериментах, представлены на рисунках 1-3 и позволяют оценить влияние миелопептидов на базовую синаптическую эффективность и формирование кратковременной и долговременной посттетанической потенциации. Обычно при проведении эксперимента 1-2 среза гиппокампа каждой мыши использовали без инкубации с миелопептидами, таким образом, контрольная группа состояла из большого числа срезов от разных животных.
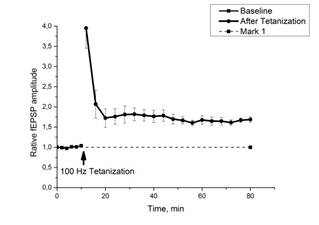
В контроле тетанизация приводила к значительному росту относительной амплитуды ВПСП (примерно в 1,7 раза), и это увеличение сохранялось в течение часа, что свидетельствует о формировании ДПТП (рис. 1 a, b).
a b
c d
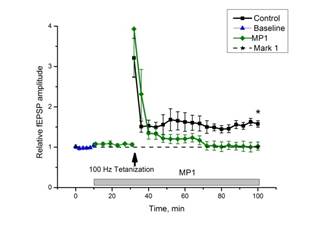
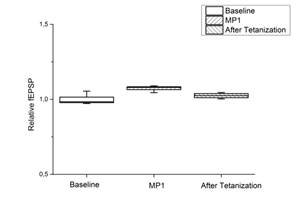
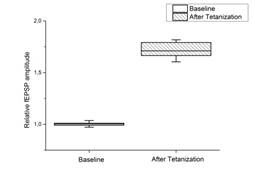
Рис. 1. Выработка ДПТП в срезе гиппокампа мыши
Ось ординат: нормализованная амплитуда ВПСП, стрелкой указано время начала тетанизации. a, b – контроль (n=17); c, d – МП1 в концентрации 0,01 мкгр/мл (n=7). b, d - Box plot – представление данных первых 10 минут эксперимента (Baseline), последующих 20 минут (MP1), последних 60 минут b (After Tetanization) и последних 30 минут d (After Tetanization). Box plot (b, d): центральная линия показывает медиану, границы прямоугольников представляют 25 и 75-й перцентили (OriginLab software)
Инкубация срезов с МП1 не изменяла базовых характеристик ВПСП и не оказывала влияния на параметры парной фасилитации. В то же время амплитуда ВПСП после тетанизации повышалась незначительно, а затем падала до базовых значений, то есть МП1 препятствовал развитию ДПТП (рис. 1).
Добавление МП2 в инкубационную среду вызывало колебания величины относительной амплитуды базовых ВПСП, однако они были статистически недостоверны. В срезах регистрировалась парная фасилитация, однако тетанизация коллатералей Шаффера не вызывала даже кратковременного увеличения относительной амплитуды ВПСП (рис. 2a).
a b
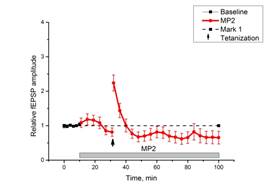
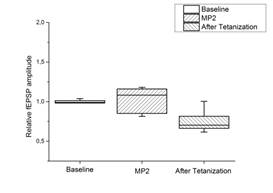
c d
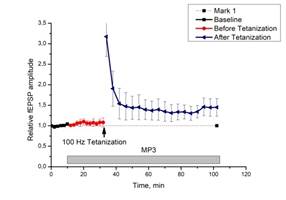
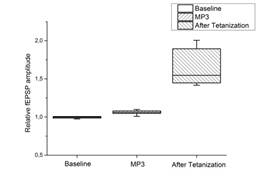
Рис. 2. Действие миелопептидов МП2 и МП3 на ДПТП в срезах гиппокампа мыши.
Ось ординат: нормализованная амплитуда ВПСП; стрелкой указано время начала тетанизации. a, b – МП2 в концентрации 0,01 мкгр/мл (n=9); c, d – МП3 в концентрации 0,01 мкгр/мл (n=8); прямоугольник внизу демонстрирует время действия соответствующих миелопептидов. b, d – Box plot – представление данных первых 10 минут эксперимента (Baseline), последующих 20 минут (MP), последних 60 минут (After Tetanization)
Более того, через 60 минут после тетанизации регистрируемая амплитуда ВПСП была ниже базовых значений. Таким образом, хотя динамика изменений относительной амплитуды ВПСП после тетанизации при инкубации с МП1 и МП2 различна, оба миелопептида препятствовали развитию ДПТП в срезах гиппокампа мышей, причем ингибирующее действие МП2 выражено гораздо сильнее.
Инкубация срезов с МП3 не оказывала влияния на базовые характеристики ВПСП, параметры парной фасилитации и формирование ДПТП (рис. 2 c, d).
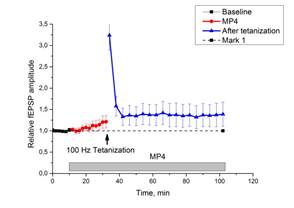
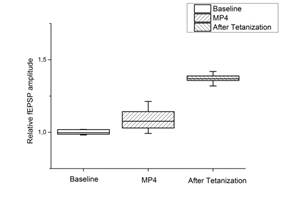
При внесении МП4 в инкубационную среду отмечено незначительное повышение амплитуды ВПСП, при этом в срезах регистрировали нормальную парную фасилитацию. Тетанизация коллатералей Шаффера приводила к повышению относительной амплитуды ВПСП, и это повышение сохранялось в течение 60 минут (рис. 3 a, b). Величина амплитуды ВПСП после тетанизации была ниже контрольной, однако статистический анализ не выявил достоверных различий, то есть ингибирующее действие МП4 на ДПТП сравнительно небольшое.
a b
c d
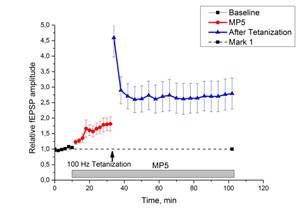
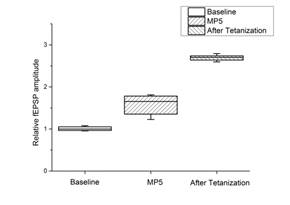
Рис. 3. Действие миелопептидов МП4 и МП5 на ДПТП в срезах гиппокампа мыши.
Ось ординат: нормализованная амплитуда ВПСП; стрелкой указано время начала тетанизации. a, b – МП4 в концентрации 0,01 мкгр/мл (n=10); c, d – МП5 в концентрации 0,01 мкгр/мл (n=9); прямоугольник внизу демонстрирует время действия соответствующих миелопептидов. b, d – Box plot – представление данных первых 10 мин. эксперимента (Baseline), последующих 20 мин. (MP), последних 60 мин. (After Tetanization)
Инкубация срезов с МП5 (рис. 3 c, d) приводила к достоверному повышению амплитуды базовых синаптических ответов (более чем в 1,5 раза за 20 минут), но не влияла на параметры парной фасилитации в срезах. Также существенно выросла средняя относительная амплитуда ВПСП после тетанизации (для сравнения: медианное значение в контроле 1,71 против 2,70 при действии МП5). Этот эффект сохранялся на протяжении 60 минут после тетанизации, что позволяет сделать заключение о фасилитации ДПТП при действии МП5.
Инкубация срезов гиппокампа интактных животных с МП6 (n=11) приводила к значительному уменьшению эффективности синаптической передачи в течение 20-минутной инкубации; последующая высокочастотная стимуляция вызывала увеличение ответов на 20-25%, однако эти значения не сохранялись, и к концу 60-минутного периода регистрации ответы падали до базовых значений (рис. 4). То есть МП6 не блокировал индукцию потенциации, но препятствовал сохранению ДПТП.
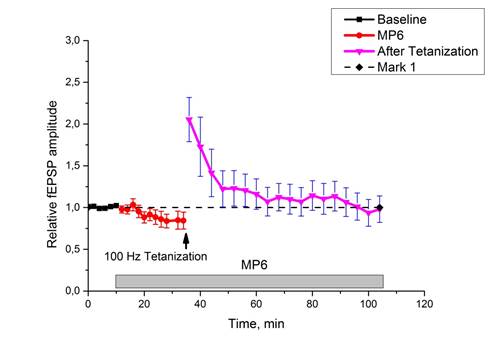
Рис. 4. Действие МР6 на характеристики синаптической передачи интактных мышей.
Ось ординат: нормализованная амплитуда ВПСП; стрелкой указано время начала тетанизации
Таким образом, проведенные эксперименты позволили выявить различия в действии миелопептидов на синаптическую пластичность гиппокампа в системе связей «коллатерали Шаффера – пирамидные нейроны области СА1». При этом все миелопептиды, за исключением МП5 и МП6, не оказывали существенного влияния на базовые характеристики синаптических ответов. Инкубация срезов с МП5 достоверно повышала, а с МП6 понижала относительную амплитуду ВПСП. При использовании каждого из миелопептидов не изменялись параметры парной фасилитации в указанной системе синаптических связей. МП3 не оказывал влияния на формирование ДПТП в срезах, а МП4 незначительно снижал величину относительной амплитуды ВПСП после тетанизации по сравнению с контролем. МП1 и МП2 ингибировали формирование ДПТП, а МП5, напротив, вызывал фасилитацию потенциации. При инкубации срезов гиппокампа с МП6 тетанизация приводила к индукции кратковременной потенциации, но она не переходила в долговременную.
Для изучения влияния миелопептидов на синаптическую пластичность гиппокампа животных с хронической зависимостью от морфина были выбраны два противоположных по своему действию на нормальные срезы миелопептида – МП2 и МП5.
В срезах гиппокампа мышей с хронической зависимостью от морфина характеристики парной фасилитации достоверно не отличались от ее характеристик в срезах интактных животных, что позволяло выбрать величину стимула для последующей тетанизации.
Как уже говорилось выше, у интактных мышей тетанизация приводила к значительному росту относительной амплитуды ВПСП, и это увеличение сохранялось в течение часа и более, что свидетельствовало о формировании ДПТП (рис. 1 a, b). В срезах гиппокампа животных с хронической зависимостью от морфина не наблюдали значительных изменений в базовых характеристиках ВПСП по сравнению с контролем, но тетанизация не вызывала роста относительной амплитуды ВПСП, то есть формирование ДПТП было заблокировано (рис. 5). Эти данные согласуются с результатами, полученными Пу с соавторами [11], изучавшими влияние хронической зависимости от морфина на синаптическую пластичность гиппокампа в системе связей «пирамидные нейроны СА1 – коллатерали Шаффера».
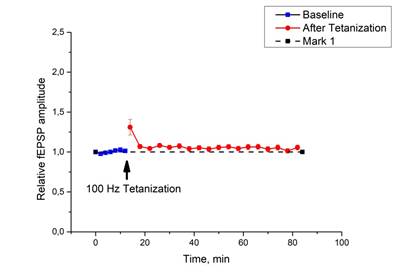
Рис. 5. Выработка ДПТП у мышей с хронической зависимостью от морфина
Если в срезах гиппокампа нормальных животных инкубация срезов с MP2 (n=9) в течение 20 минут приводила к угнетению синаптической передачи и уже через 10-15 минут инкубации ответы на тестовую стимуляцию падали ниже базовой линии, а выработка ДПТП была полностью блокирована (рис. 2 а, b), то действие MP2 (n=7) на срезы гиппокампа мышей с хронической зависимостью от морфина оказалось иным. Изменений в характере ответов при 20-минутной инкубации с МР2 не наблюдалось, но выработки ДПТП после тетанизации также не происходило, а все ответы в течение 60 минут после высокочастотной стимуляции незначительно превышали базовый уровень (рис. 6).
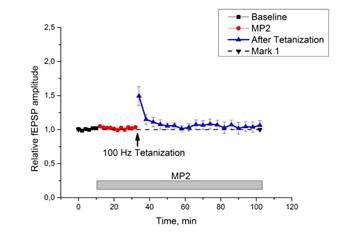
Рис. 6. Выработка ДПТП у мышей с хронической зависимостью от морфина при действии МР2
Инкубация срезов гиппокампа интактных мышей с МП5 в течение 20 мин. приводила, как уже говорилось выше, к достоверному увеличению амплитуды базовых ответов, а тетанизация вызывала фасилитацию ДПТП (рис. 3 c, d). В срезах гиппокампа животных с хронической зависимостью от морфина инкубация с МП5 приводила к тому, что амплитуда базовых ВПСП вначале несущественно превышала базовую линию, а затем опускалась незначительно ниже базовой линии; при этом после высокочастотной стимуляции не наблюдалось существенного изменения эффективности синаптической передачи, т.к. в течение 60 минут происходили колебания вокруг базовой линии (рис. 7).
Ни кратковременная, ни долговременная потенциация при этом не вырабатывалась.
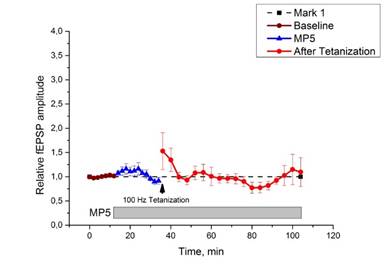
Рис. 7. Действие МР5 на срезы мышей с хронической зависимостью от морфина
Ранее в работах по изучению действия индивидуальных миелопептидов на клетки нейробластомы мыши авторы показали, что каждый из миелопептидов обладал дифференцирующим и нейропротекторным эффектом, как при токсическом действии морфина, так и при депривации кислорода и глюкозы [5]. Миелопептиды также замедляли развитие толерантности к морфину при формировании хронической опиатной зависимости у мышей [6]. Можно было бы предполагать, что все миелопептиды действуют в нервной ткани, используя какой-то сходный механизм. Однако необходимо отметить, что авторы обнаружили различия как в их эффектах на формирование хронической зависимости от морфина [3; 4], так и в представленных выше результатах. Так что механизмы действия миелопептидов еще предстоит изучить. Тем не менее выявленные эффекты однозначно свидетельствуют о способности этих пептидов влиять на синаптическую пластичность. Синаптическая пластичность играет основную роль в памяти и обучении [12–14], таким образом, миелопептиды принимают участие в регуляции функциональной активности нервной системы.
Заключение
Основными результатами проведенной работы можно считать следующее: миелопептиды оказывают влияние на синаптическую пластичность гиппокампа мышей, что представляет интерес для дальнейшего исследования возможности их применения в экспериментах по блокированию формирования аддиктивной памяти и усилению ее угасания; полученные данные подтверждают роль миелопептидов как коммуникаторов между иммунной и нервной системой, способность миелопептидов тормозить формирование хронической зависимости от морфина, их протекторное действие при морфиновой токсичности, способность миелопептидов ингибировать развитие толерантности к анальгетическому действию морфина, позволяют предположить, что на основе этой группы пептидов могут быть разработаны новые лекарственные средства для комплексной терапии наркотической зависимости.
Библиографическая ссылка
Береговой Н.А., Сорокина Н.С., Воевода М.И., Старостина М.В. ВЛИЯНИЕ МИЕЛОПЕПТИДОВ НА СИНАПТИЧЕСКУЮ ПЛАСТИЧНОСТЬ ГИППОКАМПА МЫШЕЙ В НОРМЕ И ПРИ ХРОНИЧЕСКОЙ ОПИЙНОЙ ЗАВИСИМОСТИ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33121 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33121



