Увеличение сывороточной активности аланинаминотрансферазы (АЛТсыв) используется в настоящее время в клинической диагностике как один из основных маркеров повреждения гепатоцитов, в том числе при диагностике заболеваний печени [1], отводе регулярных доноров [2] и принятии решений о прекращении разработки или удалении из оборота гепатотоксичных лекарственных средств [3, с. 241]. Диагностическая значимость этого критерия основана на высоком уровне экспрессии гена ALT1, кодирующего цитозольный изофермент АЛТ, в клетках печени. При повреждении гепатоцитов факторами любой этиологии (химическими веществами, вирусами, аутоиммунными реакциями и т.д.) количество разрушающихся клеток в единицу времени начинает увеличиваться по сравнению с фоновыми значениями, обусловленными нормальным физиологическим процессом репопуляции, что вызывает увеличение содержания АЛТ в межклеточной жидкости и плазме крови. Снижение АЛТсыв наблюдается на поздних стадиях цирроза, когда значительно уменьшается количество функционирующих гепатоцитов, и при недостаточном поступлении в организм витамина В6 (кофактора трансаминаз пиридоксаль 5'-фосфата).
Нормальными величинами АЛТсыв являются значения ниже 40 Ед/л у мужчин и ниже 31 Ед/л у женщин. Нижнюю границу нормы, составляющую для здоровых людей 5–10 Ед/л, часто не указывают, поскольку клинически значимым изменением маркера считается только увеличение. Тем не менее, в опытах на животных и других биологических моделях токсичность различных химических веществ (пестицидов, тяжелых металлов, лекарственных препаратов, природных токсинов и т.д.) нередко проявляется в снижении АЛТсыв вместо ожидаемого увеличения [4, 5, 6]. Таких случаев выявлено намного меньше, чем случаев увеличения показателя, но становится очевидным, что это не артефакты, а реальные, хотя и мало предсказуемые изменения, не связанные с определенной химической структурой токсиканта или определенным биологическим объектом [7, 8].
Большой вклад в легализацию этих данных внесла публикация Солтера с соавт. [9], в которой были сделаны первые шаги в попытке объяснения выявленного феномена: снижение активности АЛТ в печени крыс при введении им токсина синезеленых водорослей объясняется не ингибированием активного центра фермента, а подавлением экспрессии соответствующего гена, с параллельным дозозависимым снижением активности, количества белка и специфической мРНК АЛТ. Позднее нигерийские токсикологи Ojezele и Abatan [10], обсуждая свои данные по снижению АЛТсыв у цыплят под воздействием пестицидов и учитывая статью Солтера, высказали предположение о том, что снижение АЛТсыв отражает раннюю стадию повреждения гепатоцитов с подавлением их функциональной активности, но еще до нарушения целостности наружных мембран. Тем не менее, в рамках обычных токсикологических экспериментов длительностью от 4 суток до 2 месяцев (чаще всего 2–3 недели), включая и данные [10], выявлялись только однонаправленные эффекты – или снижение активности АЛТ, или ее увеличение.
Изучая токсичность наноматериалов и их аналогов иной степени дисперсности в хронических экспериментах на крысах длительностью 6 месяцев, авторы впервые обнаружили двухстадийные изменения АЛТсыв подопытных животных – сначала снижение, а затем увеличение [11, 12]. Этот факт был упомянут в текстах обеих статей, но подробному анализу зависимостей доза-время-эффект подвергались только целевые показатели окислительного стресса.
Цель данного исследования – изучить динамику изменения АЛТсыв с анализом зависимостей доза-время-эффект в хронических экспериментах по введению крысам ряда химических препаратов.
Материал и методы исследования. В работе использовали пять химических препаратов, описанных в таблице 1; там же приведены сокращенные названия, под которыми они будут упоминаться в тексте.
Препараты вводили крысам с питьевой водой в течение 6 месяцев. Каждая группа крыс состояла из 6 белых нелинейных самцов разводки питомника «Столбовая» с исходной массой 160–180 г. Животные содержались в стандартных условиях вивария с безлимитным доступом к питьевой воде.
Таблица 1
Характеристики препаратов, вводившихся крысам с питьевой водой
|
Препарат |
Сокращ. название |
Производитель, характеристики |
Концентрации в питьевой воде |
|
Cульфат серебра Ag2SO4 |
CC |
АО «Ленреактив», марка «хч» |
0,01; 0,05; 0,5 и 5 мг Ag/л воды
|
|
Наночастицы серебра |
НЧС |
OOO «Cентоза Факторинг НП», Ø 14±2 нм |
0,01; 0,05; 0,5 и 5 мг Ag/л воды
|
|
Углеродные нанотрубки («Таунит») |
УНТ |
ООО «НаноТЦ», Ø 15 – 40 нм |
0,75 и 1,5 мг/л воды |
|
Активированный уголь («Флотосорб А») |
АУ |
АО «Сорбент», частицы 10–100 мкм |
0,15 и 0,3 мг/л воды |
|
Карбонат кальция («Мицеллат») |
М |
ООО «Славянская аптека», коллоидный препарат меловых отложений, частицы 0,3–1,2 мкм |
3 мг Ca/л воды |
Пробы крови отбирали из подъязычной вены крыс через 2, 5, 12 и 24 недели после начала опыта. Активность АЛТ в сыворотках определяли на биохимическом анализаторе ChemWell Combi 2910 (Awareness, USA) с использованием тест-наборов ЗАО «Вектор-Бест» «Трансаминаза-АЛТ-Ново» (В-8016), основанных на определении 2,4-динитрофенилгидразона пировиноградной кислоты методом Райтмана–Френкеля.
Математический анализ полученных данных проводили с помощью компьютерной программы Statistica for Windows v. 7.0. Для оценки статистической значимости различий использовали двусторонний тест Манна–Уитни.
Результаты исследования и их обсуждение. Четыре из пяти изучаемых препаратов представляли собой коллоидные растворы нано- (НЧС, УНТ) или микрочастиц (АУ, М). Однако полученные данные не обусловлены специфическим воздействием частиц, поскольку наиболее активным препаратом – с точки зрения времени возникновения и амплитуды изменений АЛТсыв – оказался раствор СС (табл. 2). В таблице 2 полученные данные представлены в формализованном виде – показаны только те экспериментальные точки, в которых содержание АЛТсыв статистически значимо отличалось от соответствующего контроля. На ранних сроках экспериментального воздействия (через 5 недель для всех изучаемых препаратов и уже через 2 недели для СС) происходило снижение АЛТсыв, а на более поздних сроках – 3 и 6 месяцев – увеличение (для НЧС увеличение было слабым и не достигло уровня статистической значимости). Таким образом, впервые экспериментально показано, что снижение и увеличение сывороточной активности АЛТ в ответ на введение токсичных соединений – это не противоположные реакции, а две стадии одного и того же процесса.
Таблица 2
Статистически значимые изменения АЛТсыв (в % от контрольных значений) при хроническом введении крысам изучаемых препаратов с питьевой водой
|
Время |
С, мг/л |
CC а) |
НЧС а) |
АУ б) |
УНТ в) |
М г) |
|
2 недели |
С1 |
|||||
|
С2 |
64,9 ↓ |
- |
||||
|
С3 |
- |
- |
- |
|||
|
С4 |
44,8 ↓ |
- |
- |
- |
||
|
5 недель |
С1 |
70,6 ↓ |
83,2 ↓ |
62,2 ↓ |
54,6 ↓ |
61,8 ↓ |
|
С2 |
74,0 ↓ |
60,0 ↓ |
57,6 ↓ |
- |
||
|
С3 |
- |
- |
- |
|||
|
С4 |
- |
- |
- |
|||
|
3 месяца |
С1 |
148,5 ↑ |
139,3 ↑ |
131,3 ↑ |
139,6 ↑ |
|
|
С2 |
135,3 ↑ |
139,6 ↑ |
138,9 ↑ |
- |
||
|
С3 |
- |
- |
- |
|||
|
С4 |
- |
- |
- |
|||
|
6 месяцев |
С1 |
138,7 ↑ |
140,5 ↑ |
|||
|
С2 |
126,2 ↑ |
- |
||||
|
С3 |
- |
- |
- |
|||
|
С4 |
- |
- |
- |
Примечания
1. Концентрации препаратов в питьевой воде составляли:
а) С1-С4 (0,01; 0,05; 0,5 и 5 мг/л в пересчете на Ag)
б) С1, С2 (0,15 и 0,3 мг/л)
в) С1, С2 (0,75 и 1,5 мг/л)
г) С1 (3 мг/л в пересчете на Ca)
2. Пустые клетки означают отсутствие статистически значимых отличий активности АЛТ в данной экспериментальной группе крыс от соответствующего контроля. Знаком дефиса отмечены неиспользовавшиеся экспериментальные варианты.
3. Все табличные данные, кроме относящихся к мицеллату (М), опубликованы ранее вместе с 10 другими показателями в статьях [11, 12] с небольшими числовыми расхождениями (кратность различий по отношению к контролю определялась в [11, 12] по соотношению средних значений, а в таблице 2 – по соотношению медиан).
На рисунках 1 и 2 приведены зависимости доза-эффект и время-эффект для животных, которым вводили СС в концентрациях от 0,01 до 5 мг/л. Через 2 недели после начала введения крысам СС (рис. 1А) наблюдалось монотонное снижение АЛТсыв, связанное с концентрацией препарата в питьевой воде логарифмической зависимостью:
АЛТсыв (Ед/л) = –1,302 lnС (мг/л) + 12,299 (R² = 0,9619).
На сроке 5 недель эта монотонная зависимость превращалась в типичную адаптационную петлю (рис. 1Б), возникающую из-за различий в скорости изменения маркера при разных концентрациях действующего вещества. Как это видно из сравнения графиков 1Б и 2Б, на сроке 5 недель у животных, получавших СС в самой низкой концентрации (0,01 мг/л), еще продолжается адаптивное снижение активности АЛТ, а при более высоких концентрациях уже начинается противоположный процесс – увеличение данного маркера, хотя все экспериментальные точки петли по-прежнему лежат ниже контроля. Аналогичная U-образная зависимость доза-эффект была получена при внесении инсектицида дельтаметрина в аквариумы с рыбками Rhamdia quelen [6].
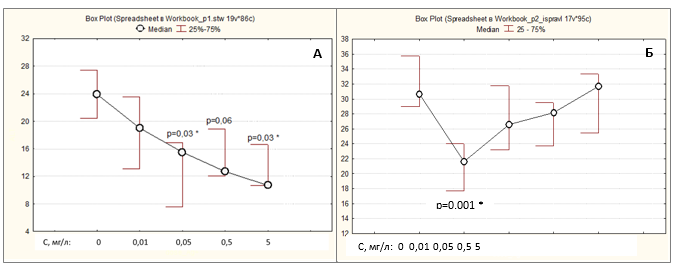
Рис. 1. Зависимости доза-эффект для АЛТсыв через 2 недели (А) и 5 недель (Б) после начала введения крысам СС в концентрациях от 0,01 до 5 мг/л
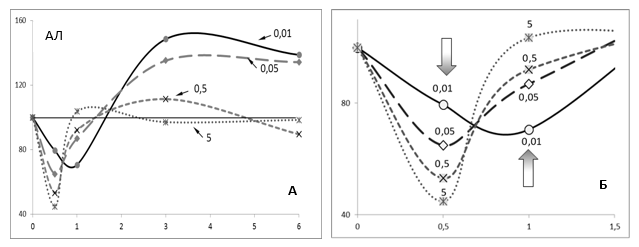
Рис. 2. Зависимости время-эффект (в % от контрольных значений АЛТсыв на этот же срок) при введении крысам СС в концентрациях от 0,01 до 5 мг/л. По оси абсцисс – время в месяцах. А – полная зависимость, Б – увеличенный фрагмент двух первых временных точек
Объяснить механизм возникновения вышеописанных изменений достаточно легко, если учесть, что катализируемая АЛТ реакция трансаминирования обратима (рис. 3А) и идет в печени и мышцах в противоположные стороны, образуя так называемый глюкозо-аланиновый цикл, или цикл Кэхилла (рис. 3Б). Биологический смысл этого цикла заключается в том, что избыток пирувата, образующийся в мышцах из глюкозы при высокой нагрузке, превращается митохондриальным изоферментом АЛТ в аминокислоту аланин. Аланин действует как челнок – он покидает мышечную клетку и с кровотоком перемещается в печень, где цитозольный изофермент АЛТ катализирует обратную реакцию, превращая его в пируват, из которого затем образуется глюкоза. Таким образом, в печени АЛТ катализирует специализированную экспортную реакцию, которая не нужна гепатоцитам для выживания, а направлена на создание условий для усиленного снабжения мышц глюкозой. Поэтому снижение экспрессии специализированного гена ALT1 на ранней стадии повреждения гепатоцитов представляется рациональным регуляторным решением, поскольку они получают возможность репарировать собственные повреждения, временно снизив обслуживающие функци
Рис. 3. Катализируемая АЛТ реакция трансаминирования.А) Обратимость реакции – в мышцах она идет справа налево, в печени – слева направо.
Б) Схема глюкозо-аланинового цикла (цикла Кэхилла)
Полученные данные позволяют предположить, что снижение АЛТсыв может оказаться клинико-диагностическим маркером ранней стадии повреждения гепатоцитов. Можно также предположить, что на этой стадии будет наблюдаться некоторое физическое ослабление пациентов, по крайней мере, с точки зрения индивидуальной выносливости. Однако вряд ли можно рассчитывать, что для целей диагностики достаточно будет только уточнить и ввести в практику определенное значение нижней границы АЛТсыв у здоровых людей. Сывороточная активность АЛТ зависит от генетического полиморфизма большого количества регуляторных, структурных и транспортных белков, определяющих запас прочности мембран гепатоцитов и момент их «пробоя» [13, 14]. В результате этот показатель имеет широкий диапазон нормы со скошенным влево распределением и длинным (примерно до 100 Ед/л) «хвостом», в котором находится 5–7% здоровых людей – носителей более редких наследственных сочетаний [15]. Эти объективные обстоятельства приводят к периодическим дискуссиям о пересмотре верхней границы нормального диапазона АЛТсыв, но тем более не позволят ввести твердую нижнюю границу для относительно небольших адаптивных изменений.
Однако в тех случаях, когда есть возможность отследить динамику изменения АЛТсыв у конкретного человека, описанные в данной статье изменения могут оказаться полезными для ранней диагностики заболеваний печени. АЛТсыв – один из обязательных биохимических показателей при профилактических и диспансерных осмотрах широких контингентов людей, в том числе и работающих во вредных условиях. В отличие от опытов на животных, пусть и хронических, развитие повреждения печени у людей может занимать годы, а не месяцы. Монотонное снижение АЛТсыв от года к году или характерная адаптационная петля могут оказаться своевременным показанием для углубленного обследования состояния печени данного человека. Аналогичные, но более быстрые изменения будут наблюдаться и при длительном приеме лекарственных средств, потенциально способных повреждать гепатоциты. Одна из целей данной публикации – привлечь к полученным авторами данным внимание врачей клинической лабораторной диагностики, которые могут продолжить эти исследования на практическом уровне.
Заключение. Полученные данные свидетельствуют о том, что снижение сывороточной активности АЛТ может оказаться ранним клинико-диагностическим маркером повреждения клеток печени при профилактических осмотрах групп населения повышенного риска, в том числе проживающих в экологически неблагополучных регионах, подвергающихся воздействию профессиональных факторов или длительно принимающих гепатотропные лекарственные средства.
Библиографическая ссылка
Хрипач Л.В., Алексеева А.В., Савостикова О.Н. ВОЗМОЖНОЕ ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СНИЖЕНИЯ СЫВОРОТОЧНОЙ АКТИВНОСТИ АЛАНИНАМИНОТРАНСФЕРАЗЫ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33100 (дата обращения: 31.12.2025).
DOI: https://doi.org/10.17513/spno.33100



