Растущая пандемия ожирения и метаболического синдрома (МС) становится важной проблемой общественного здравоохранения цивилизованных стран. Кроме обменных нарушений, в патогенезе МС участвуют острый и хронический стресс, при которых гиперкатехоламинемия дополнительно повышает уровни глюкозы, инсулина, способствуя дальнейшему развитию инсулинорезистентности, дислипидемии, артериальной гипертензии и висцерального ожирения. Вместе с метаболическими нарушениями стресс участвует в дисфункции НЭИМ-системы, влияя на опорно-двигательный аппарат, сердечно-сосудистую систему, печень [1], способствуя развитию низкоинтенсивного воспалительного процесса в организме [2].
Терапия МС комплексная (медикаментозная и немедикаментозная), патогенетическая, направлена на коррекцию основных звеньев патогенеза, включая существенное изменение образа жизни, связана с комплаентностью к терапии. Пациенты сегодня активно применяют БАДы и нутрицевтики, которые врачи включают в комплексную терапию МС, в некоторых случаях – при ожирении с ИМТ£27 кг/м2. Согласно научным данным, в такой ситуации физическая нагрузка и диетотерапия могут быть эффективны без лекарственной поддержки [3]. В то же время, с учетом непрерывной тенденции к росту заболеваемости МС, идет поиск новых методов его патогенетической немедикаментозной коррекции.
На территории Северного Кавказа произрастает более 6 тысяч видов растений, некоторые из которых являются эндемиками и входят в Красную книгу, многие интродуцированы человеком. Богатая и разнообразная флора региона считается народным достоянием, поскольку растения – это возобновляемый источник сырья для сельского хозяйства, фармацевтики и парафармацевтики, пищевой промышленности и медицины. В медицинской практике одно растение имеет разнообразные точки приложения, что объясняется многокомпонентным набором БАВ и их вторичных метаболитов. Особенности экологии, климата, географических зон оказывают специфичное действие на обменные процессы, синтез и накопление биологически активных веществ (БАВ), определяющих биологическую эффективность, что обусловливает ценность культур (интродуцентов) того или иного региона произрастания.
Цель исследования – обоснование возможности использования известных биологически активных веществ, выделенных из некоторых лекарственных растений, перспективных к интродукции в регионах Северного Кавказа, для коррекции ожирения и метаболического синдрома.
Материалы и методы исследования
В рамках исследования проведен поиск научных данных в научных информационных базах: PubMed, Scopus, eLibrary, опубликованных за последнее десятилетие. Анализ публикаций по биологическим эффектам БАВ растений был выполнен независимо двумя исследователями в базах данных PubMed, Scopus, eLibrary, ограничен 10 годами. Поиск публикаций производили в течение мая – августа 2023 года. Для поиска использовали только статьи по направлению «медицина», для подбора публикаций по патогенетическому эффекту БАВ, кроме фильтров «метаболический синдром», «системное воспаление», «NF-kB», использовали ключевые слова, характеризующие патогенетическую активность БАВ: «клеточный стресс», «противовоспалительный эффект» и т.д. Параметрами включения лекарственного растения в раздел с определенным видом активности стали соответствие ключевому эффекту и наличие аналога/эндемика / возможного интродуцента во флоре регионов Северного Кавказа. В обзор предпочтительно включали исследования за последние 5 лет, однако, если научных данных по лекарственному эффекту в этот период не было опубликовано, включали и более ранние работы.
Результаты исследования и их обсуждение
Патофизиология МС представлена сложными механизмами, включает немодифицируемые генетические и эпигенетические факторы, образ жизни (гиподинамия, повышение калоража пищи), стрессы, которые реализуются через центральные и периферические регуляторные механизмы на клеточном уровне после формирования висцерального ожирения [4]. Все перечисленные факторы сопровождаются включением универсального сигнального пути воспаления через транкрипционный фактор NF-kB [5], который запускает основные провоспалительные реакции в ядре клетки (рисунок). БАВ растений способны воздействовать на различные уровни этого механизма, оказывая системное действие на пути активации воспалительного процесса.
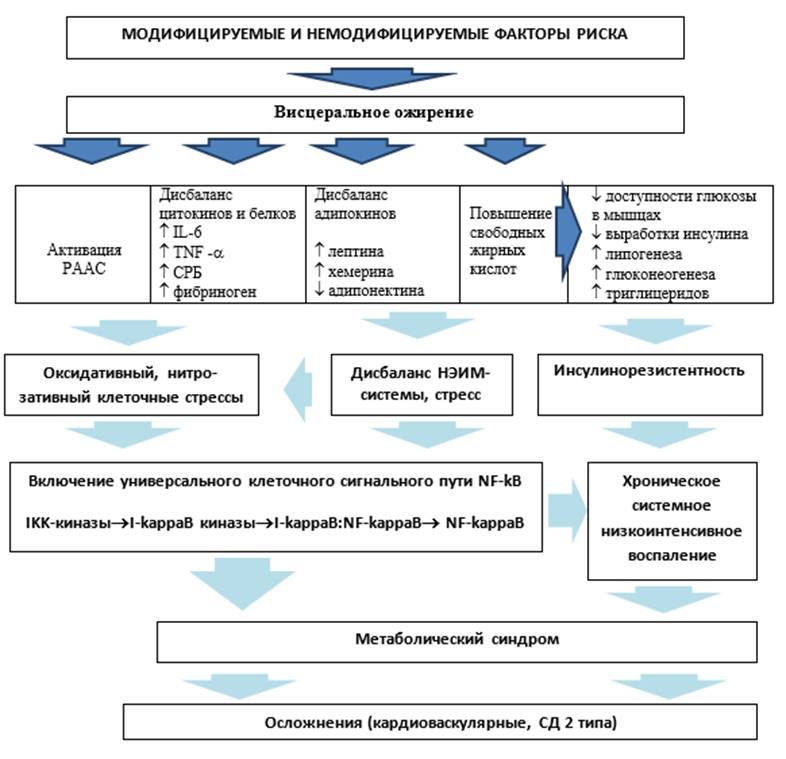
Патофизиологические механизмы метаболического синдрома[4], дополнен
Блокада клеточного стресса
Оксидативный и нитрозативные стрессы, сопровождающиеся накоплением активных форм кислорода (АФК), нитритов и NO-факторов активации неинфекционного воспаления, через запуск NF-kB вносят существенный вклад в патогенез МС. В начале века было доказано, что полифенолы растений (например, зеленого чая и красного вина) блокируют окислительный стресс [6]. Так, водорастворимые полисахаридные комплексы корневищ аира болотного (Acorus calamy L.) тормозят ПОЛ, блокируя взаимодействие с молекулами токсических веществ, оксидов, пероксидов, проявляя при этом высокую антиоксидантную активность [7], повышают резистентность мембран эритроцитов. БАВ алтея лекарственного (Althea officinalis L.) ингибируют высвобождение TNF-α, IL6 макрофагами в эксперименте на культуре эндотелия пуповинной крови, снижая окислительное повреждение [8].
Брусника (Vaccinium vitis-idaea L.) обладает самой высокой антиоксидантной активностью среди ягодных, включая ежевику, чернику, малину, клубнику и клюкву. Цианидин-3-галактозид, входящий в ее состав, является доминирующим антоцианом, обеспечивающим антиоксидантную активность, он снижает продукцию АФК, повышает экспрессию супероксиддисмутазы 2 (SOD2), глутатионпероксидазы (GPx) и каталазы в воспаленных адипоцитах [9].
Спиртовый экстракт девясила высокого (Inula helenium L.) ингибирует продукцию NO и уровень экспрессии индуцибельной синтазы оксида азота (iNOS), подавляя экспрессию IL-6 за счет содержания β-кариофиллена, последний имеет более высокую антиоксидантную активность, чем эталонная аскорбиновая кислота, и яцеозид (ингибитор продукции NO) [10].
БАВ диаскореи кавказской (Dioscorea сaucasica lypsky): сапонины диосгенин, диосцин, грациллин – тормозят окислительный стресс, модулируют кишечную микробиоту при воспалении [11, 12]. Защитный эффект изорамнетина облепихи крушиновидной (Hippophae rhamnoides L.) связан с ингибированием окс-ЛПНП-рецептора 1 и мРНК каспазы-3, снижением высвобождения NO [13].
Гиспаглабридины А и В, изофлавоны, выделенные из экстрактов солодки голой (G. Glabra), предотвращают перекисное окисление митохондриальных липидов в клетках печени крыс, вызванное Fesup3+ in vitro, ингибируют окисление ЛПНП, возможно, никотинамидадениндинуклеотидфосфат (НАДФН) оксидазы; повышают экспрессию антиоксидантных ферментов в макрофагах, снижают экспрессию молекул адгезии – молекулы межклеточной адгезии-1 (ICAM-1), молекулы адгезии сосудистых клеток-1 (VCAM-1) и Е-селектина в эндотелии, подавляют производство медиаторов воспаления (TNF-α, IL-1, NO) [14, 15].
Выраженное антиоксидантное действие хмеля обыкновенного (Humulus lupulus) обусловлено представленным в нем комплексом биологически активных веществ: α- и β-кислот, халконов (ксантогумол, изоксантогумол, дезметилксантогумол), флавонов, процианидинов и других соединений, которые угнетают индуцируемое сульфатом меди или анионом пероксинитрила окисление ЛПНП. В эксперименте доказано, что антиоксидантное действие ксантогумола выше, чем у α-токоферола [16].
Источником природных антиоксидантных соединений, аналогичных α-токоферолу, могут стать растения рода Seseli: порезник закавказский (жабрица) – Libanotis transcaucasica, флавоноиды шалфея мутовчатого – Salvia verticillata L., способные активировать ферментативную систему АОС клетки [17, 18].
Противовоспалительное действие
Представляют интерес и основные противовоспалительные механизмы растительных компонентов. На модели жировой ткани in vitro экстракт плодов брусники подавлял воспаление в TNF-активированных адипоцитах 3T3-L1, снижал экспрессию IL-6, моноцитарного хемоаттрактантного белка I (MCP-1), IL-1, TNF-α, МСР-1, ЦОГ-2, iNOS; усиливал экспрессию противовоспалительных цитокинов (IL-10, адипонектина). Было доказано, что ингибирующее действие экстракта брусники на экспрессию iNOS и образование NO более выражено, чем у будесонида – глюкокортикостероида с высоким противовоспалительным потенциалом [19].
Компоненты настоя горца мясо-красного (Змеевик большой) – Persicaria bistorta (L.) Samp. – тормозят высвобождение IL-1β, TNF-α, IL-8, положительно влияют на жизнеспособность и апоптоз здоровых клеток [].
Лиофилизированный цветочный настой лабазника обыкновенного (Таволга обыкновенная, земляной орех – F. vulgaris) богат полифенолами, относящимися к классам флавоногликозидов, фенолокислот и гидролизуемых дубильных веществ. Благодаря флавоноидам (спиреозид, астрагалин 2″-O-галлат и смесь гиперозида 2″-O-галлата и изокверцитрина 2″-O-галлата) он способен снижать выработку провоспалительных эйкозаноидов ex vivo в тромбоцитах человека, ингибировать активность ЦОГ-1 и ЦОГ-2, поглощать избыток NO, демонстрируя достоверный противовоспалительный потенциал in vitro и in vivo [21, 22].
Широким спектром противовоспалительных эффектов обладают 4 класса лигнанов лимонника китайского (Schirandra Chinensis Baill): «лигнаны Schisandra chinensis» и полифенолы экстрактов листьев черной смородины (Ríbes nígrum), что подтверждено на различных моделях воспаления [23, 24].
Некоторые БАВ солодки голой аналогично стероидному гормону (гидрокортизону) ингибируют активность фосфолипазы А2; глицирризиновая кислота in vitro подавляет активность ЦОГ и образование простагландина Е2, что тормозит воспаление в эксперименте и клинике [25]. Противовоспалительный иммунологический эффект характерен для большинства фитоадаптогенов (таких как солодка голая, элеутерококк колючий, девясил высокий, родиола розовая и др.).
Экстракт черники обыкновенной (Vaccinium myrtillus L.) оказывает противоспалительное действие за счет уменьшения количества Т-клеток, продуцирующих IFNγ; снижает экспрессию TNF-α в жировой ткани, VCAM-I и адипонектина в плазме, повышает уровень хемокинового лиганда 1 с мотивом C-X-C [CXCL1]), подавляет экспрессию IL-1β и IL-6, ферментов (iNOS, ЦОГ-2), модулирующих сигнальные пути и снижающих уровень АФК в клеточных и животных моделях [26].
Снижение всасывания жиров в кишечнике, гепато- и панкреопротекторный эффект
Одним из направлений терапии метаболических расстройств является подавление активности пищеварительных ферментов, ответственных за всасывание пищевых жиров и сахара из кишечника. Среди 30 исследованных плодов, которые нутрициология относит к «суперфуду», только брусника и красная смородина ингибировали активность липазы, глюкозидазы, α-амилазы поджелудочной железы, тот же эффект был характерен для сесквитерпеновых лактонов (СЛ) васильков (Centaure) [27, 28]. Брусника снижает накопление липидов в печени и уровень воспалительного маркера ингибитора активатора плазминогена-1 (PAI-1), опосредует положительные эффекты гомеостаза глюкозы [28].
При применении этанольного экстракта цветков девясила высокого у мышей C57BL/6J, получавших продукты с высоким содержанием жиров, были отмечены ингибирование накопления липидов в адипоцитах 3T3-L1 и печени in vitro, снижение жировой массы тела, увеличение мышечной массы [29].
Изокверцитрин девясила в исследовании in vivo на китайских мышах с диабетом 2-го типа стимулировал секрецию и биодоступность глюкагоноподобного пептида-1 (GLP-1), инсулина, понижал уровень глюкозы натощак; оказывал гепатопротекторный эффект. Алантолактон девясила повышает уровень поглощения глюкозы и является возможным препаратом для лечения резистентности к инсулину и непереносимости глюкозы, поскольку способен ингибировать воспалительный процесс, индуцированный IL-6 [30].
Гиперицин, гиперфорин и адперфорин зверобоя – травы Святого Джона (Hypericum perforatum L.) – защищают β-клетки от повреждения цитокинами, уменьшая потерю их функции при диабете и увеличивая выживаемость [31]. У крыс при высокожировой диете применение H. perforatum нормализует уровень повышенного холестерина, триглицеридов и глюкозы в крови, приводит к нормализации глюкозы и ЛПВП при стрептозотоциновом диабете [32]. Широкий спектр вторичных метаболитов H. perforatum (алкалоидов, терпенов, фенолов, галлата эпигаллокатехина) стимулирует термогенез, тормозит накопление жира, что связано со способностью ингибировать липазу поджелудочной железы [32, 33].
Коррекция дислипидемии, уровня глюкозы
Зверобой продырявленный активен и при коррекции дислипидемии; так, экстракт H. perforatum ингибировал повышение уровня Lpl полностью дифференцированных адипоцитов (фермент, который играет роль в превращении триглицеридов в жирную кислоту и глицерин) до уровня, характерного для преадипоцитов; снижал экспрессию TNF-α и IL-6, мРНК синтазы жирных кислот в адипоцитах [34].
Бетаин брусники и сесквитерпеновые лактоны васильков (Centaure) в эксперименте снижали массу печени, содержание холестерина, уровень глюкозы в крови, тормозили развитие стеатоза печени и гиперлипидемию у мышей [35, 36].
Триллин диаскореи у крыс на высокоуглеводной диете снижал уровень глюкозы в крови и гликемический индекс, что определяет его включение в функциональные пищевые продукты для облегчения постпрандиальной гипергликемии [37].
Потенциальное влияние изофлавонов клевера лугового (Trifolium pratense L.) на метаболизм липидов было доказано в экспериментах на животных и в клинике – прием компонентов красного клевера приводил к снижению общего холестерина, холестерина ЛПНП и триглицеридов, а также к умеренному, но незначительному повышению уровня ЛПВП в сыворотке крови. Основным механизмом влияния на дислипидемию является активация рецепторов, активируемых пролифератором пероксисом (PPAR), – ядерных рецепторов, которые участвуют в гомеостазе клеточных липидов [38]. Биоханин А и формононетин клевера являются двойными агонистами PPAR-альфа, которые регулируют метаболизм липидов посредством прямого контроля транскрипции генов, участвующих в проксисомальных и митохондриальных путях бета-окисления, поглощении жирных кислот и катаболизме триглицеридов [38]. Наблюдаемые эффекты, вероятно, являются результатом снижения экспрессии пропротеинконвертазы субтилизина/кексина типа 9 (PCSK9), что приводит к повышению уровня печеночных рецепторов ЛПНП и увеличивает клиренс холестерина ЛПНП из кровотока [39]. В то же время инактивация PCSK9 в эпителии кишечника снижает постпрандиальную триглицеридемию [39].
В эксперименте при кормлении крыс Fischer богатым антоцианами соком черники в течение 10 недель снижались уровни триглицеридов, холестерина, резистина и лептина в сыворотке крови, но это не влияло на высвобождение адипонектина или других адипокинов из жировой ткани [40].
Блокирование универсального клеточного механизма NF-kB
В большинстве своем БАВ растений оказывают блокирующий эффект на уровне центрального аппарата клеток. Так, СЛ васильков участвуют в регуляции NF-κB и сигнального пути митоген-активируемой протеинкиназы (MAPK) [41], снижая выработку хемокинов (MCP-1, TGF-β1, FN), ингибируют вызванную сахаром деградацию IκBα, подтверждая эффективность в качестве возможных препаратов для лечения диабетической нефропатии [42, 43].
Гидроэтанольный экстракт девясила высокого у мышей ингибирует индуцированную TNF-α активацию NF-κB и экспрессию IL-1, IL-4 и TNF-α на линии клеток человека HaCat [44]. Изокверцитрин девясила высокого, действуя на миокардиоциты, ослабляет вызванную ЛПС сердечную дисфункцию, снижает уровни TNF-α, IL6, MCP1 и iNOS in vivo и in vitro, блокируя MAPK и NF-пути κB [45]. Алантолактон девясила высокого – СЛ эвдесманолида с фрагментом α-метилен-γ-лактона – ингибирует индуцированную ЛПС продукцию NO в макрофагах лучше, чем аминогуанидин, нарушает сигнальный путь NF-κB посредством ингибирования фосфорилирования ингибирующего κB-α (IκB-α) и IKK, а также пути MAPK [45].
Изорхамнетин – флавоноид листьев, цветков и плодов облепихи крушиновидной [13, 46, 47] – регулирует NF-kB, PI3K/AKT, MAPK и другие сигнальные пути и регулируемые ими факторы; защищает сердечно-сосудистые клетки от воспаления, окислительного повреждения и апоптоза, воздействуя на сигнальные пути PI3K/AKT и NF-κB, ингибирует пролиферацию гладкомышечных клеток [48], оказывает протекторное действие на повреждение эндотелиальных клеток, вызванное H2O2 и ox-LDL [49], благодаря его противовоспалительному и антиоксидантному эффектам [50].
Прием черники снижал уровни мишеней NF-κB, таких как циркулирующий hsCRP, IL-6 и MIG; отмечены более высокие уровни кверцетина и р-кумаровой кислоты в плазме. Кроме того, полифенолы кверцетин, ресвератрол и эпикатехин подавляют активацию NF-kB в моноцитарных клетках человека, обработанных ЛПС.
Заключение
Необходимо отметить, что экстракты одного растения способны содержать десятки БАВ, которые обеспечивают в большинстве случаев синергетические эффекты, однако известны растения, например фитоадаптоген женьшень, которые содержат вещества (гинзеноиды) разнонаправленного (антагонистического) действия. В последнем случае биологический эффект веществ растения определяется исходным статусом организма, на которое идет воздействие. Те же эффекты ожидаемы и для комплексов, включающих БАВ 2 и более растений. В научных базах данных мало работ, посвященных изучению явления «синергизма» и «антагонизма» растений, а также серьезных клинических исследований, посвященных применению отдельных растительных экстрактов и их комплексов, поскольку, по мнению О.А. Бочаровой (2008–2022), необходим иммунологический контроль индивидуальной чувствительности и наступающей со временем толерантности к отдельным экстрактам, в связи с чем большинство описанных в обзоре эффектов изучены для изолированных веществ в эксперименте. Отсутствуют надежные методы стандартизации многокомпонентных смесей БАВ в экстрактах, особенно выращенных в различных климатических условиях. Большинству многокомпонентных комплексов растений присущи «политаргетные» (многоцелевые) и, как следствие, синергетические эффекты, что можно объяснить способностью отдельных веществ независимо действовать на вне- и внутриклеточные рецепторы благодаря собственному химическому строению, а также особенностями плазматических мембран клетки и субклеточных структур. Также важно понимать, что комплексы растительных БАВ оказывают эффект в соответствии с патофизиологическим статусом организма, обусловленным включением в патологическое состояние адаптивных механизмов физиологических систем, что может существенно влиять на биологические эффекты комплексов растений, и при различных патологических состояниях векторы эффектов могут отличаться.
Тем не менее, современному прогрессу в получении эффективных лечебных средств растительного происхождения способствуют значительные успехи химии и фармакологии, которые создали более совершенные аналитические методы для объективизации лечебной активности БАВ растений. В оценке эффективности растений стал важен их химический состав. Продуцируемые в растениях БАВ являются продуктами метаболизма в живом организме, поэтому значительная часть этих продуктов более естественно включается в биохимические и другие жизненные процессы, чем синтезированные лекарства, что снижает процент нежелательных эффектов при применении фитопрепаратов. Компоненты растений, перспективных для интродукции в регионах Северного Кавказа, представляют научный интерес при изучении их биологических эффектов, а также при разработке новых препаратов для немедикаментозной терапии метаболических нарушений.
Библиографическая ссылка
Датиева Ф.С., Фарниева О.А., Дзампаева Ж.В., Хадарцев А.А., Датиева Л.Р., Базаева И.К. ВОЗМОЖНОСТИ ИСПОЛЬЗОВАНИЯ ЛЕКАРСТВЕННЫХ РАСТЕНИЙ, ПЕРСПЕКТИВНЫХ ДЛЯ ИНТРОДУКЦИИ НА СЕВЕРНОМ КАВКАЗЕ, В КОРРЕКЦИИ СИСТЕМНОГО ВОСПАЛЕНИЯ ПРИ МЕТАБОЛИЧЕСКИХ НАРУШЕНИЯХ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33099 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33099



