Существует несколько методов для снижения интраоперационного кровотечения [1; 2]. Управляемая гипотония – один из таких методов, который существенно уменьшает интенсивность кровотечения, но его применение не всегда возможно. Важно отметить, что значительное снижение артериального давления во время операции противопоказано, если у пациента установлены: ишемическая болезнь сердца, атеросклероз, сахарный диабет. В том числе не рекомендуется применять у лиц пожилого возраста и с сопутствующими заболеваниями.
Гемостатические средства, в свою очередь, могут оказаться малоэффективными в случае значительных повреждений тканей и крупных сосудов, а также при проведении обширных операций, и в определенных случаях их применение может быть нежелательным [3].
Интересно, что внутривенные инъекции лидокаина снижают дозы общих анестетиков и наркотических обезболивающих средств во время операций [4; 5], улучшается качество визуализации, уменьшаются интраоперационные кровотечения при ринохирургических процедурах [6]. Эффекты лидокаина на снижение интраоперационной кровоточивости включают в себя противовоспалительный [7; 8] и сосудосуживающий и зависят от плазменной концентрации [9; 10]. Однако в ряде случаев необходимый уровень визуализации не удается достигнуть, требуется введение максимальных доз внутривенного лидокаина [5].
Внутривенные инъекции лидокаина вводятся со скоростью не более 300 мг в час [10], что тесно связано с уровнем его плазменной концентрации, не должной превышать 5 мкг/л [9]. Важно отметить, что лидокаин оказывает комплексное двухфазное воздействие на гладкую мускулатуру и периферические сосуды. При минимальных концентрациях в крови он стимулирует вазоконстрикцию, в то время как при увеличении концентрации происходит вазодилатация [5; 9].
Интересно, что вазоконстрикция, инициированная лидокаином, способствует значительному снижению интраоперационного кровотечения. Однако следует помнить, что превышение концентрации лидокаина в крови на уровень 6-8 мкг/л может вызвать разнообразные токсические реакции. Например: остановка дыхания, AV-блокада, коллапс, кома, снижение AД, тонико-клонические судороги, общая слабость, психомоторное возбуждение [5; 6; 10].
Инъекции лидокаина внутривенно даже в умеренных дозировках 4 мг/кг/час в течение 30-60 минут иногда могут вызывать повышение концентрации лидокаина в плазме крови до 5,82-7,10 мкг/мл, что может приводить к развитию вышеперечисленных токсических реакций [11]. Интраназальное введение лидокаина может применяться для анестезии полости носа, блокады тройничного нерва [12], лечения мигрени [8], снижения воспаления в дыхательных путях [8; 13]. Не описано влияние на интраоперационное кровотечение при ринохирургических операциях интраназального введения лидокаина в сочетании с внутривенным введением. В результате анализа литературных данных авторы предполагают, что сочетанное применение внутривенного и интраназального способов введения лидокаина может способствовать снижению общей дозы введенного лидокаина и усовершенствованию визуализации хирургической области при эндоскопических эндоназальных ринохирургических вмешательствах. Применение внутривенного и интраназального введения лидокаина не будет приводить к превышению допустимых показателей плазменной концентрации лидокаина, т.к. для снижения кровоточивости не потребуется введение максимальных дозировок.
Цель исследования: исследовать перспективы использования комбинированного внутривенного и интраназального введения лидокаина в процессе эндоскопических риносинусохирургических операций с общей анестезией.
Материал и методы исследования
«В рамках данного исследования, которое включало в себя анализ 57 случаев оперативных вмешательств, проведенных с применением общей анестезии и искусственной вентиляции легких, стоит уделить особое внимание следующим аспектам. Пациенты, подвергнутые хирургическим процедурам, были случайным образом разделены на две разнообразные группы, важность которых состояла в определении эффективности интраназального и внутривенного введения лидокаина во время операции. Первая группа, которая включала в себя 27 человек, представляла собой группу контроля (К). Они не получали внутривенное и эндоназальное введение лидокаина в процессе операции. Вторая группа, состоявшая из 30 человек, оказалась группой, в которой применялось интраназальное введение и постоянная инфузия лидокаина через шприцевой насос с целью контроля гемодинамических показателей и снижения интенсивности интраоперационного кровотечения (Л). Интенсивность интраоперационного кровотечения в этой группе уменьшали путем дополнительного введения повышенных доз фентанила, в результате чего добивались снижения среднего артериального давления. Следует отметить, что все пациенты были предварительно обследованы в соответствии с протоколом клиники. Уровень артериального давления измерялся трижды: перед операцией, за день до нее и за несколько часов до начала операции. Состояние системы гемостаза анализировалось за несколько дней до операции с использованием различных медицинских показателей, включая международное нормализованное отношение, активированное частичное тромбиновое время, фибриноген, антитромбин III, время свертывания крови, длительность кровотечения, а также количество и качество тромбоцитов.
Критерии включения в исследование определялись наличием пациентов в возрасте от 18 до 65 лет и наличием патологии полости носа и околоносовых пазух, которую можно было корректировать хирургическим путем с минимальной инвазивностью. При этом они не должны были иметь системных нарушений свертывания крови и неконтролируемой артериальной гипертензии. Критерии невключения: неконтролируемая гипертоническая болезнь, выраженная ишемическая болезнь сердца с частыми болевыми приступами, выраженный распространенный атеросклероз, аллергические реакции на местные анестетики в анамнезе, прием антикоагулянтов или дезагрегантов, клинико-лабораторные изменения в системе гемостаза, системные заболевания, проявляющиеся поражением сосудов (васкулиты, гранулематоз Вегенера и другие). Средний возраст участников составил 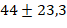 года, а среднее время продолжительности операции оценивалось в
года, а среднее время продолжительности операции оценивалось в 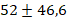 минуты. Среднее время внутривенного введения лидокаина оценивалось в
минуты. Среднее время внутривенного введения лидокаина оценивалось в 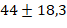 минуты. Важно подчеркнуть, что все пациенты подверглись общей комбинированной анестезии в сочетании с инвазивной искусственной вентиляцией легких.» В операционной до начала общей анестезии и операции выполнялось интраназальное введение 4% лидокаина, полученного путем разведения 10% раствора, по 1-2 мл в каждую ноздрю. После подготовки операционной зоны перед началом основной фазы хирургического вмешательства в группе лидокаина проводилось внутривенное введение лидокаина следующим образом: вводился болюсный инъекционный 1%-ный лидокаин в дозе 1-1.5 мг на каждый килограмм веса пациента. Затем, в соответствии с характером операции и реакцией гемодинамики пациента, проводилось микроструйное введение лидокаина в дозировке 2-5 мг/кг/час, но не превышающее скорость 300 мг в час. В группе контроля вместо лидокаина вводился физиологический раствор для «ослепления» оперирующего хирурга, по методике введения в группе лидокаина. После этой процедуры ход проведения анестезии в обеих группах не различался. Процедура премедикации включала введение фентанила в дозе 0.002-0.003 мг на каждый килограмм веса пациента интравенозно и атропина в дозе 0.005 мг на каждый килограмм веса пациента интравенозно. Индукция анестезии проводилась с использованием пропофола в дозе 2-3 мг на каждый килограмм веса пациента. Устанавливался надгортанный воздуховод, и пациентам проводилась искусственная вентиляция легких при объеме дыхания 6-8 мл на один кг веса. Во всех случаях контролировали концентрацию углекислого газа, который выдыхается, при минимальном потоке свежего воздуха в объеме 0.5-1 литр в минуту. Газ десфлюран использовался в концентрации 4-12%, чтобы достичь определенных значений минимальной альвеолярной концентрации (МАК) в диапазоне от 0.8 до 1.4. Эти параметры важны для обеспечения нужного уровня анестезии и безопасности пациента во время операций. Введение фентанила осуществлялось по мере необходимости и зависело от текущего этапа операции.» Один и тот же хирург выполнял все оперативные вмешательства, проводил оценку интенсивности интраоперационного кровотечения (ИК) каждые 5 минут. Для этой цели использовалась шкала, состоящая из 6 категорий, известная как шкала Fromme-Boezaart Score (табл. 1), в которой 0 баллов соответствует отсутствию кровотечения, сухому операционному полю, 5 баллов – выраженное кровотечение, невозможность выполнять оперативное вмешательство [6]. Хирург не был информирован о введении внутривенного лидокаина. Интенсивность кровотечения в 0-1 балл считали незначимым, кровотечение более 2 баллов – значимым.
минуты. Важно подчеркнуть, что все пациенты подверглись общей комбинированной анестезии в сочетании с инвазивной искусственной вентиляцией легких.» В операционной до начала общей анестезии и операции выполнялось интраназальное введение 4% лидокаина, полученного путем разведения 10% раствора, по 1-2 мл в каждую ноздрю. После подготовки операционной зоны перед началом основной фазы хирургического вмешательства в группе лидокаина проводилось внутривенное введение лидокаина следующим образом: вводился болюсный инъекционный 1%-ный лидокаин в дозе 1-1.5 мг на каждый килограмм веса пациента. Затем, в соответствии с характером операции и реакцией гемодинамики пациента, проводилось микроструйное введение лидокаина в дозировке 2-5 мг/кг/час, но не превышающее скорость 300 мг в час. В группе контроля вместо лидокаина вводился физиологический раствор для «ослепления» оперирующего хирурга, по методике введения в группе лидокаина. После этой процедуры ход проведения анестезии в обеих группах не различался. Процедура премедикации включала введение фентанила в дозе 0.002-0.003 мг на каждый килограмм веса пациента интравенозно и атропина в дозе 0.005 мг на каждый килограмм веса пациента интравенозно. Индукция анестезии проводилась с использованием пропофола в дозе 2-3 мг на каждый килограмм веса пациента. Устанавливался надгортанный воздуховод, и пациентам проводилась искусственная вентиляция легких при объеме дыхания 6-8 мл на один кг веса. Во всех случаях контролировали концентрацию углекислого газа, который выдыхается, при минимальном потоке свежего воздуха в объеме 0.5-1 литр в минуту. Газ десфлюран использовался в концентрации 4-12%, чтобы достичь определенных значений минимальной альвеолярной концентрации (МАК) в диапазоне от 0.8 до 1.4. Эти параметры важны для обеспечения нужного уровня анестезии и безопасности пациента во время операций. Введение фентанила осуществлялось по мере необходимости и зависело от текущего этапа операции.» Один и тот же хирург выполнял все оперативные вмешательства, проводил оценку интенсивности интраоперационного кровотечения (ИК) каждые 5 минут. Для этой цели использовалась шкала, состоящая из 6 категорий, известная как шкала Fromme-Boezaart Score (табл. 1), в которой 0 баллов соответствует отсутствию кровотечения, сухому операционному полю, 5 баллов – выраженное кровотечение, невозможность выполнять оперативное вмешательство [6]. Хирург не был информирован о введении внутривенного лидокаина. Интенсивность кровотечения в 0-1 балл считали незначимым, кровотечение более 2 баллов – значимым.
Таблица 1
Оценка интенсивности кровотечения в зоне оперативного доступа
|
Интенсивность (балл) |
Характеристика |
|
0 |
Кровотечение отсутствует, аспиратор не применяют |
|
1 |
Минимальная кровоточивость, аспиратор не применяют |
|
2 |
Хороший обзор, минимальная кровоточивость, аспиратор – не часто |
|
3 |
Небольшая кровоточивость, аспиратор – часто |
|
4 |
Средняя кровоточивость. Аспиратор – очень часто. Практически постоянное нахождение аспиратора в поле операции |
|
5 |
Тяжелая кровоточивость. Постоянное нахождение аспиратора. Поле операции не обозримо, применение аспиратора неэффективно. Операция невыполнима |
«У всех пациентов проводился непрерывный мониторинг различных параметров, включая неинвазивное артериальное давление с регистрацией среднего артериального давления, контроль нейромышечного блока и уровня седации с использованием BIS-монитора, частоту сердечных сокращений, электрокардиографию, пульсоксиметрию (измерение уровня кислорода в крови). Процесс пробуждения пациентов оценивался с использованием двух шкал: шкалы Aldrete, которая предназначена для оценки степени пробуждения пациента, и шкалы Ричмонда, которая используется для измерения уровня возбуждения-седации. Не менее двух часов пациентов наблюдали после операции. Наблюдение включало регулярный контроль различных медицинских показателей, таких как частота сердечных сокращений, неинвазивное артериальное давление, электрокардиография и уровень кислорода в крови.
Статистический анализ проводился с использованием программы StatTech v. 3.1.10 (разработчик - ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро-Уилка (при числе исследуемых менее 50) или критерия Колмогорова-Смирнова (при числе исследуемых более 50). Количественные показатели, имеющие нормальное распределение, описывались с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей.
Результаты исследования и их обсуждение. Антропометрические показатели, включая пол, возраст и индекс массы тела (ИМТ), не показали статистически значимых различий между сравниваемыми группами. Также не выявлено различий в количестве проведенных септум-операций, степени полипоза по шкале Фридмана и продолжительности операции между группами. В течение общей анестезии после достижения стабильной плазменной концентрации лидокаина (примерно через 3-5 минут после введения болюса) наблюдалось стабильное снижение интенсивности кровотечения (табл. 2).
Таблица 2
Измерение интенсивности кровотечения в различных фазах операции
|
Точки исследования |
ИК |
Группы исследования |
p |
|
|
Контроль |
Лидокаин |
|||
|
10-я минута операции |
1 балл |
9 (33.3) |
24 (80.0) |
0.004* |
|
2 балла |
16 (59.3) |
6 (20.0) |
||
|
3 балла |
1 (3.7) |
0 (0.0) |
||
|
4 балла |
1 (3.7) |
0 (0.0) |
||
|
30-я минута операции |
1 балл |
12 (44.4) |
21 (70.0) |
0.083 |
|
2 балла |
14 (51.9) |
7 (23.3) |
||
|
3 балла |
1 (3.7) |
2 (6.7) |
||
|
60-я минута операции |
1 балл |
11 (40.7) |
24 (80.0) |
0.008* |
|
2 балла |
15 (55.6) |
6 (20.0) |
||
|
3 балла |
1 (3.7) |
0 (0.0) |
||
|
ИК - интенсивность интраоперационного кровотечения по шкале Fromme-Boezaart; *различия показателей статистически значимы (p<0,05); Л - группа с лидокаином; БЛ - группа без лидокаина. |
||||
ИК в группе Л на 10-й и 60-й минутах оперативного вмешательства была убедительно ниже. Согласно результатам исследования, на 10-й и 60-й минутах величина среднего артериального давления (СрАД) не показала статистически значимых различий между группами, но на 30-й минуте она была немного выше в группе Л (табл. 3). В течение операции обе группы демонстрировали стабильные значения СрАД. Согласно мнению некоторых исследователей, хорошая видимость в операционной зоне обеспечивается СрАД в диапазоне от 60 до 70 мм рт. ст. [14]. Однако в других исследованиях предлагается снижать СрАД до 50 мм рт. ст. [15]. Эти данные позволяют заключить, что общая анестезия была безопасной на высоком уровне. Однако стоит отметить, что существует риск ишемии для мозга, миокарда, глазной сетчатки и нарушения почечной перфузии при значительном снижении СрАД, помимо его преимуществ, таких как снижение интенсивности интраоперационного кровотечения [11; 14; 15].
Таблица 3
Изменения среднего артериального давления в местах исследования на различных этапах хирургической процедуры
|
Точки исследования |
Группы исследования |
Показатели среднего артериального давления (мм рт. ст.) |
p |
||
|
Me |
Q₁ – Q₃ |
n |
|||
|
10-я минута операции |
Контроль |
68.00 |
60.00 – 75.50 |
27 |
0.103 |
|
Лидокаин |
71.33 |
65.83 – 75.33 |
30 |
||
|
30-я минута операции |
Контроль |
66.00 |
60.50 – 73.00 |
27 |
0.020* |
|
Лидокаин |
72.00 |
68.42 – 77.42 |
30 |
||
|
60-я минута операции |
Контроль |
70.00 |
64.00 – 79.00 |
27 |
0.135 |
|
Лидокаин |
73,83 |
70.17 – 81.33 |
30 |
||
|
Me - медиана; Q1-Q3 - верхний и нижний квартили. |
|||||
Общая доза введенного лидокаина составляла в среднем 1,5-2,5 мг/кг/час, что не превышает рекомендуемых безопасных показателей. Во время операции показатели гемодинамики оставались стабильными: средний пульс составил 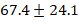 удара в минуту, а среднее артериальное давление составило
удара в минуту, а среднее артериальное давление составило 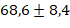 миллиметра ртутного столба. «Электрокардиограмма и измерение уровня кислорода в крови показали результаты в пределах нормы. После основного этапа операции введение лидокаина прекратили примерно за
миллиметра ртутного столба. «Электрокардиограмма и измерение уровня кислорода в крови показали результаты в пределах нормы. После основного этапа операции введение лидокаина прекратили примерно за 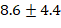 минуты до завершения операции. Процесс пробуждения пациентов начался непосредственно на операционном столе, и среднее время от окончания введения ингаляционного анестетика до полного пробуждения составило
минуты до завершения операции. Процесс пробуждения пациентов начался непосредственно на операционном столе, и среднее время от окончания введения ингаляционного анестетика до полного пробуждения составило 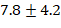 минуты. Пациенты по шкале Aldrete получали высокие баллы (9-10), отмечали хорошее состояние после операции. Уровень возбуждения-седации у пациентов был в пределах от -2 до 0 баллов по шкале Ричмонда. В раннем послеоперационном периоде у троих пациентов возникали тошнота и рвота, которые успешно купировались однократным введением ондансетрона. Один пациент испытывал выраженную слабость и головокружение, но и эти симптомы были сняты введением 1000 мл NaCl. Все пациенты после операции чувствовали себя комфортно и не испытывали боли, и через два часа после вмешательства не было необходимости в наркотических анальгетиках. Также не было признаков токсического воздействия лидокаина.»
минуты. Пациенты по шкале Aldrete получали высокие баллы (9-10), отмечали хорошее состояние после операции. Уровень возбуждения-седации у пациентов был в пределах от -2 до 0 баллов по шкале Ричмонда. В раннем послеоперационном периоде у троих пациентов возникали тошнота и рвота, которые успешно купировались однократным введением ондансетрона. Один пациент испытывал выраженную слабость и головокружение, но и эти симптомы были сняты введением 1000 мл NaCl. Все пациенты после операции чувствовали себя комфортно и не испытывали боли, и через два часа после вмешательства не было необходимости в наркотических анальгетиках. Также не было признаков токсического воздействия лидокаина.»
Полученные результаты, демонстрирующие низкие показатели интенсивности интраоперационного кровотечения в группе, где использовался лидокаин, представляют важный вывод для его будущего применения в риносинусохирургических вмешательствах. В настоящее время механизм этого эффекта требует дальнейшего изучения. По мнению некоторых исследователей, стабильные показатели артериального давления и сердечной частоты, а также сосудосуживающее действие лидокаина при низких концентрациях [9] могут способствовать уменьшению интенсивности интраоперационного кровотечения. Кроме того, исследования, как экспериментальные, так и клинические, демонстрируют, что внутривенное введение амидных анестетиков, в частности лидокаина, имеет потенциал сокращения выделения цитокинов. Этот эффект, в свою очередь, способен уменьшить степень локальных воспалительных проявлений, что подтверждается результатами ряда исследований [7; 8]. Однако эти предположения требуют дополнительных исследований.
Ограничениями данного исследования является небольшая выборка относительно здоровых пациентов, которым проводились малоинвазивные вмешательства малой травматичности в области ЛОР-хирургии. Хотя шкала оценки интенсивности интраоперационного кровотечения Fromme-Boezaart Score валидизирована за рубежом, нельзя исключить ее субъективности при использовании одним и тем же специалистом. В эндоскопической микрохирургической оториноларингологии сложно объективно оценить объем кровопотери, так как важное значение играет не количество мл потерянной крови, которое обычно не является значительным и не вызывает кровопотерю, а ухудшение видимости вследствие повышенной кровоточивости в ограниченном пространстве полости носа (в операционном поле).
Выводы. Комбинированное использование внутривенного и интраназального введения лидокаина способствует сокращению общего объема применяемого лидокаина и повышению качества визуализации хирургической области при проведении эндоскопических эндоназальных ринохирургических процедур. Сочетанное применение внутривенного и интраназального введения лидокаина не приводит к превышению допустимых показателей плазменной концентрации лидокаина, т.к. для снижения кровоточивости не требуется введения максимальных дозировок, что обеспечивает большую безопасность анестезиологического пособия и оперативного вмешательства для больного.
Библиографическая ссылка
Павлов В.Е. НОВЫЕ ВОЗМОЖНОСТИ ПРИМЕНЕНИЯ ЛИДОКАИНА ПРИ ЭНДОСКОПИЧЕСКИХ РИНОСИНУСОХИРУРГИЧЕСКИХ ВМЕШАТЕЛЬСТВАХ С ПОЗИЦИИ АНЕСТЕЗИОЛОГА // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33082 (дата обращения: 05.01.2026).
DOI: https://doi.org/10.17513/spno.33082



