Вирус папилломы человека (ВПЧ) является безоболочечным вирусом семейства Papillomaviridae. Геном ВПЧ представлен двухцепочечной кольцевой ДНК, имеющей 8 открытых рамок считывания, которые кодируют вирусные белки, разделен на три раздела: раннюю, позднюю и длинную контрольную области. Первые шесть генов кодируют ранние вирусные белки и экспрессируются в начале жизненного цикла вируса [1]. Два основных гена из ранней области: E1 и E2, необходимы для репликации ДНК вируса. E2 также действует как активатор или репрессор вирусной транскрипции в зависимости от того, где он связывается, и участвует в сегрегации вирусного генома во время митоза. Поздняя область генома ВПЧ кодирует два вирусных капсидных белка: L1 и L2. Продукция капсидных белков ограничена высоко или терминально дифференцированными эпителиальными клетками на поздней стадии инфекции и запускается репликацией вирусной ДНК. Длинная контрольная область содержит сайты связывания вирусных белков E1 и E2 для инициации репликации ВПЧ [2].
Первоначальное прикрепление вирионов ВПЧ к кератиноцитам хозяина происходит путем взаимодействия вирусных капсидных белков с рецепторами клеток хозяина. Цикл репродукции ВПЧ включает в себя три последовательных этапа: 1) проникновение вируса и доставка вирусного генома в ядро клетки-мишени, 2) экспрессия генов вируса и репликация генома, 3) сборка и высвобождение вирионов из клетки. Репликация вируса в инфицированных кератиноцитах зависит от их дифференцировки, так, его ранние гены, включая вирусные онкогены E6 и E7, экспрессируются в недифференцированных или промежуточно дифференцированных кератиноцитах, в то время как экспрессия поздних генов происходит только в кератиноцитах, подвергающихся высокой или терминальной дифференцировке [3]. Эта сложная экспрессия вирусных генов, зависящая от клеточной дифференцировки, является результатом использования альтернативных вирусных промоторов, сплайсинга РНК и полиаденилирования РНК для обеспечения надлежащего времени и уровня экспрессии вирусных белков на каждой стадии репродукции вируса.
Многими исследованиями доказано, что ВПЧ является канцерогенным для человека. Однако большинство типов (генотипов) ВПЧ не вызывают рак. Из 448 типов, которые были задокументированы, только двенадцать (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) классифицируются как канцерогенные. Инфекции, вызванные этими канцерогенными типами ВПЧ, чрезвычайно распространены, но около 80% излечиваются иммунной системой в течение трех лет, и только около 3% прогрессируют до предрака/рака в течение 7 лет [4]. Основываясь на ассоциации с опухолевым процессом, типы генитального ВПЧ можно разделить на типы низкого риска, вызывающие в основном остроконечные кондиломы, и типы высокого риска, которые могут вызывать инвазивный рак. В отличие от ВПЧ низкого риска, ВПЧ высокого риска экспрессируют два мощных онкопротеина: E6 и E7, которые опосредуют, соответственно, деградацию клеточного p53 и pRb, белков-супрессоров опухолей, необходимых для контроля клеточного цикла и стабильности генома, что приводит к канцерогенезу, индуцированному ВПЧ.
ВПЧ 16 и ВПЧ 18 являются наиболее распространенными канцерогенными типами, совместно ответственными за более 70% случаев рака шейки матки и практически за все виды рака, ассоциированного с ВПЧ, у мужчин. ВПЧ 16 преимущественно ассоциирован с плоскоклеточным раком, в то время как ВПЧ 18 чаще обнаруживается при аденокарциномах, что позволяет предположить, что эти типы ВПЧ различаются по своей специфичности к клеткам-мишеням [5].
Биологическая активность белков E6 и E7 у ВПЧ низкого и высокого риска различная. ВПЧ низкого риска не индуцируют пролиферацию клеток в базальном и парабазальном слое эпителия, что способствует их более низкому онкогенному потенциалу [6]. E7 от ВПЧ низкого риска нацелен на членов семейства pRb аналогично ВПЧ высокого риска; однако было показано, что они отдают предпочтение p130, который регулирует начало клеточного цикла в верхних слоях эпителия. 6 и 11 типы ВПЧ наиболее часто регистрируются при доброкачественных заболеваниях; до 90% остроконечных кондилом связаны с этими подтипами. Аногенитальные бородавки не обладают метастатическим потенциалом; однако они обычно имеют рецидивирующее течение и могут влиять на качество жизни, в то время как их лечение является более сложным у пациентов с ослабленным иммунитетом, особенно на фоне коинфекции вирусом иммунодефицита человека [7].
В настоящее время для профилактики ВПЧ доступны три лицензированные вакцины: Церварикс (2vHPV) – двухвалентная вакцина для защиты от инфицирования штаммами ВПЧ 16 и ВПЧ 18, Гардасил (4vHPV) – четырехвалентная вакцина, которая нацелена на серотипы ВПЧ 6, 11, 16, 18, Гардасил 9 (9vHPV) для профилактики инфекции ВПЧ 6, 11, 16, 18, 31, 33, 45, 52, 58 типов. Вакцины 4vHPV и 9vHPV производятся на основе Saccharomyces cerevisiae. Вакцина против 4vHPV показана для профилактики остроконечных кондилом, предраковых или диспластических поражений и онкопатологии шейки матки у женщин и различных форм ВПЧ-инфекции у мужчин в возрасте 9–26 лет. Доказана эффективность вакцины 9vHPV для профилактики диспластических поражений, остроконечных кондилом, а также онкопатологии влагалища, вульвы, шейки матки и анального отверстия у лиц в возрасте до 45 лет [8].
По рекомендациям Индийского онкологического общества [9], вакцинацию всех детей следует начинать в возрасте 9–14 лет, в то время как поздняя вакцинация для тех, кто не был вакцинирован в рекомендуемом возрасте, должна быть завершена как можно скорее, а очень поздняя вакцинация должна предлагаться в группах высокого риска.
Каждый год ВПЧ вызывает 630 000 случаев рака у мужчин и женщин (т.е. 4,5% всех случаев рака), тем самым создавая серьезную угрозу общественному здравоохранению в глобальном масштабе. Рак, ассоциированный с ВПЧ, поражает участки слизистой оболочки, при этом 64–91% случаев рака влагалища, 40–50% рака вульвы, 88–94% рака анального отверстия и 40–50% случаев рака полового члена связаны с ВПЧ [10].
В Российской Федерации в 2019 году ВПЧ-инфекция выявлялась у 38,7% из общего числа обследуемых. При этом частота обращения женщин в 8,5 раз превышала частоту обращения мужчин. Чаще обследовались девушки 20–29 лет, что составило 46,1% от числа женщин, у которых была диагностирована ВПЧ-инфекция. Наиболее распространенным серотипом являлся ВПЧ 16, на его долю приходилось 13,8% случаев инфицирования, а также ВПЧ 6 – 10,6%. При этом большинство заболевших приходилось на Центральный, Приволжский и Южный федеральные округа [11].
В России уровень заболеваемости аногенитальными бородавками в 2018 году составил 18,8 случая на 100 тысяч человек, при этом у лиц от 0 до 14 лет на 100 тысяч человек приходилось 0,58 случая, от 15 до 17 лет – 21,1 случая, старшее 22 лет – 22,8 случая на 100 тыс. человек. В 2018 году было выявлено 17 766 случаев рака шейки матки, на 100 тыс. населения приходилось 15,8 случая ВПЧ-ассоциированных диагнозов, подтвержденных лабораторно. При этом самый высокий уровень заболеваемости данным заболеванием регистрировался в Карелии – 31,4 лабораторно подтвержденного случая на 100 тысяч населения, в Архангельской области – 17,2 случая на 100 тысяч, в Челябинской области – 16,6 случая на 100 тысяч [12].
Цель настоящего исследования – оценка инфицированности населения Республики Мордовия вирусом папилломы человека.
Материалы и методы исследования
Биологическим материалом явились урогенитальные соскобы от пациентов разного пола и возраста, исследованные методом полимеразной цепной реакции с помощью наборов реагентов «АмплиСенс® ВПЧ 16/18-FL», «АмплиСенс® ВПЧ 6/11-FL» на базе лаборатории ГБУЗ РМ «Мордовский республиканский кожно-венерологический диспансер» (МРКВД). В рамках исследования были проанализированы образцы, полученные в 2018–2022 гг.
Результаты исследования анализировали относительно времени, пола, возраста. Учитывали лабораторно подтвержденные данные об инфицированности ВПЧ разных типов от общего числа проведенных исследований. Был применен критерий Фишера для анализа частоты качественных признаков; так как в ходе исследования присутствовали множественные группы сравнения, то использовали поправку Бонферрони. При оценке распространенности штаммов ВПЧ определяли коэффициент корреляции Пирсона (r). Достоверными считали различия при уровне значимости p≤0,05. Анализ полученных данных проводился при помощи программы Microsoft Excel.
Результаты исследования и их обсуждение
За 2018–2022 гг. в МРКВД обратились с подозрением на ВПЧ-инфекцию 5170 пациентов, из них диагноз подтвердился данными лабораторных исследований у 261 человека – 5,05%.
Согласно полученным результатам, наиболее распространенным типом в Республике Мордовия является ВПЧ 16 (табл.) – выявлен в среднем в 47,9% случаев, чаще данный штамм диагностировался в 2018 году. Вторым по частоте встречаемости определялся ВПЧ 6 – в среднем в 24,5% случаев, чаще в 2019 г. (прирост относительно 2018 г. – 63,6%). Серотип ВПЧ 18 диагностировался в среднем у 15,3% инфицированных лиц. Наименьшая распространенность ВПЧ 11 наблюдалась в 2020 г., наибольшая – в 2022 г. (рис. 1), в среднем за 5-летний период инфицированность данным типом вируса выявлялась в 12,3% случаев.
Выявляемость штаммов ВПЧ в 2018-2022 гг.
|
|
ВПЧ 6 |
ВПЧ 11 |
ВПЧ 16 |
ВПЧ 18 |
Всего, абс. |
||||
|
абс. |
% |
абс. |
% |
абс. |
% |
абс. |
% |
||
|
2018 г. |
11 |
18,6 |
6 |
10,2 |
35 |
59,3 |
7 |
11,9 |
59 |
|
2019 г. |
18 |
34,6 |
4 |
7,7 |
20 |
38,5 |
10 |
19,2 |
52 |
|
2020 г. |
9 |
21,4 |
3 |
7,15 |
24 |
57,15 |
6 |
14,3 |
42 |
|
2021 г. |
14 |
25,9 |
8 |
14,8 |
22 |
40,8 |
10 |
18,5 |
54 |
|
2022 г. |
12 |
22,2 |
11 |
20,4 |
24 |
44,4 |
7 |
13 |
54 |
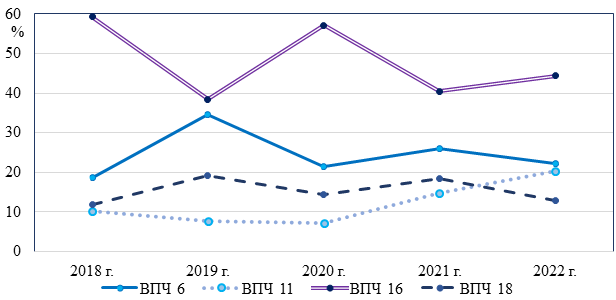
Рис. 1. Распространенность штаммов ВПЧ в 2018-2022 гг.
Выявлено наличие сильной положительной корреляционной связи ВПЧ 6 и 18 (r=0,898, р<0,01), обратной взаимосвязи средней силы между типами ВПЧ 6 и 16 (r= -0,539, р<0,01), ВПЧ 16 и 18 (r= -0,527, р<0,01).
Обращение женского населения (n=219) к врачу с ВПЧ-инфекцией превышало частоту обращений мужского населения (n=38) в 5,76 раза. При этом у мужского населения среди высоко канцерогенных типов ВПЧ 16 диагностировался чаще, чем ВПЧ 18, в 3,26 раза (р=0,005), а из низко канцерогенных штаммов распространенность ВПЧ 6 была больше частоты ВПЧ 11 в 3,18 раза (р=0,019). У женского населения, как и у мужского, наиболее часто из высоко канцерогенных штаммов выявлялся ВПЧ 16, превышая распространенность ВПЧ 18 в 2,23 раза (р=0,014), а среди штаммов с низким онкогенным риском частота встречаемости ВПЧ 11 и ВПЧ 6 была одинаковой (р=0,006). При суммировании количество случаев ВПЧ-инфекции, вызванной высоко канцерогенными типами, у мужчин составило 68,2%, у женщин – 42%. Распределение ВПЧ по полу с учетом канцерогенности представлено на рис. 2.
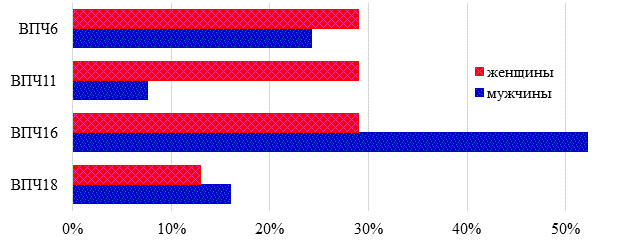
Рис. 2. Распределение штаммов ВПЧ по половым группам
Выявлено, что наиболее часто ВПЧ-инфекция диагностируется в возрасте 20–29 лет. Можно предположить, что на данный возраст приходится пик сексуальной активности и, соответственно, пик обращений к врачу по поводу инфекций, передаваемых половым путем.
Распределение пациентов по количеству выявленных штаммов было следующим (рис.3): моноинфекция ВПЧ была выявлена у 238 пациентов (91,2% от общего числа инфицированных), смешанная инфекция – у 23 человек (8,8%). Следовательно, количество моноинфекций в 10,3 раза превысило число смешанных. При этом диинфекция наблюдалась у 17 пациентов (73,9% смешанных инфекций), триинфекция – у 6 (26,1%).
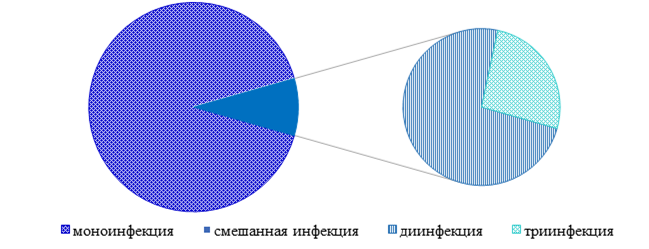
Рис. 3. Диагностирование смешанных и моноинфекций ВПЧ
Распределение высоко канцерогенных штаммов, согласно клинической значимости вероятности дисплазии шейки матки у женщин, показано на рис. 4. Значение оценивалось у всех женщин с ВПЧ-инфекцией, вызванной типами 16 и 18. При этом уровни клинической значимости распределены следующим образом: меньше 3 lg – результат вероятности дисплазии шейки матки малозначимый, в пределах от 3 lg до 5 lg – значимый, а при больше 5 lg – значимость повышена. Значимый результат вероятности дисплазии шейки матки у женщин превышал остальные примерно в 1,75 раза, малозначимая и повышенная значимость встречались с почти одинаковой частотой.
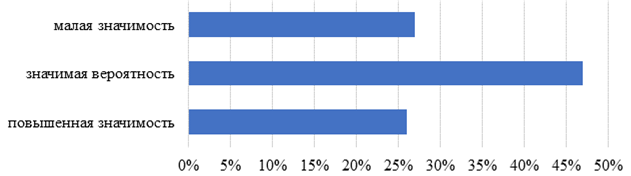
Рис. 4. Клиническая значимость вероятности дисплазии шейки матки при ВПЧ-инфекции
Заключение
Проведенный анализ данных выявил, что в период с 2018 по 2022 год в Республике Мордовия чаще диагностировалась моноинфекция, обусловленная высоко канцерогенным штаммом ВПЧ 16, реже низко онкогенным ВПЧ 6, что совпадает с распространенностью данных штаммов как на территории Приволжского федерального округа, так и на территории Российской Федерации в целом.
Частота выявления ВПЧ-инфекции была наиболее велика у женского населения, при этом преимущественно у лиц в возрасте 20–29 лет, что, вероятно, определяется сексуальной активностью и большим количеством обращений к врачу по поводу инфекций, передаваемых половым путем. Негативной тенденцией является низкая частота обращений лиц мужского пола по поводу ВПЧ-инфекции, что особенно неблагоприятно на фоне большей частоты выявления у них высоко канцерогенных типов ВПЧ 16 и ВПЧ 18 (в 68,2% случаев).
Значимый результат и повышенная значимость вероятности дисплазии шейки матки суммарно определены у 73% женщин.
Выявленные факты обусловливают необходимость усиления профилактических мероприятий и модернизации диагностических алгоритмов и схем лечения ВПЧ-инфекции.
Библиографическая ссылка
Костина Ю.А., Пузакова Д.В., Сыркина М.Г., Матвеева Л.В., Копылова О.В., Савкина Н.В., Доник Д.А. АНАЛИЗ ИНФИЦИРОВАННОСТИ ВИРУСОМ ПАПИЛЛОМЫ ЧЕЛОВЕКА НАСЕЛЕНИЯ РЕСПУБЛИКИ МОРДОВИЯ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33080 (дата обращения: 14.02.2026).
DOI: https://doi.org/10.17513/spno.33080



