Рост первичного и ревизионного эндопротезирования коленного сустава сохраняется на протяжении последних десятилетий. Зарубежные авторы прогнозируют к 2030 году до 3,48 млн операций в год [1, 2]. Такая тенденция неизбежно ведет к увеличению количества пациентов с неудовлетворительными результатами лечения, которые в первую очередь обусловлены различными осложнениями [3]. Одним из тяжелых осложнений является перипротезная инфекция (ППИ), по поводу которой выполняется до 53,1% повторных вмешательств [4]. Двухэтапная тактика лечения с применением на I этапе антибактериального спейсера, импрегнированного антибиотиками, показывает наиболее высокую результативность с купированием инфекции в 80–83% случаев [5, 6]. Дефекты костных тканей выявляются в 100% случаев, для их оценки и выбора тактики ревизионного протезирования наиболее широко применяется классификация, разработанная в Anderson Orthopedic Research Institute (AORI) [7, 8]. Частота выявления наиболее крупных дефектов (2B – 3 типов по AORI) достигает 42% случаев [7, 8, 9].
При ППИ коленного сустава с наличием дефектов 3-го типа по AORI применяются преимущественно блокирующие конструкции, исключающие движения в коленном суставе, что приводит к артрофиброзу и гипотрофии мышц. Ревизионное эндопротезирование в таких случаях отличается высокой травматичностью из-за необходимости объемного релиза. В результате у большинства пациентов в послеоперационном периоде наблюдаются болевой синдром, неудовлетворительные функциональные результаты и значительное снижение качества жизни [10, 11, 12]. Альтернативным вариантом лечения ППИ при значительных костных дефектах являются «операции отчаяния» (артродез коленного сустава или ампутация нижней конечности). Артродезирование коленного сустава в случаях наличия костных дефектов, близких к сегментарным, приводит к еще большему укорочению, отличается повышенным риском несращения и формирования фиброзного анкилоза [3]. Ампутация на уровне бедра и в настоящее время остается последним вариантом при неконтролируемой инфекции, при компрометированных мягких тканях, при невозможности или несостоявшемся артродезе [13].
Современный уровень аддитивных технологий позволяет применить индивидуально изготовленные костно-замещающие 3D-имплантаты [14]. Однако использование таких технологий в условиях перипротезной инфекции остается редким в связи с технологическими и организационными сложностями.
Цель исследования – демонстрация результатов двухэтапного лечения рецидивирующей перипротезной инфекции коленного сустава при наличии значительного дефекта большеберцовой кости (Т3 типа по AORI).
Материал и методы исследования
Пациентка Д., 76 лет, в ноябре 2021 г. госпитализирована в гнойное отделение травматологии и ортопедии № 5 Университетской клиники ФГБОУ ВО «ПИМУ» для планового оперативного лечения в связи с рецидивом ППИ правого коленного сустава. В анамнезе многократные хирургические вмешательства. В 2011 г. выполнено тотальное эндопротезирование правого коленного сустава по поводу идиопатического гонартроза 3-й стадии с выраженным болевым синдромом. Через год в связи с развитием ППИ произведены удаление эндопротеза, хирургическая обработка гнойного очага, имплантация артикулирующего спейсера. Через 7 месяцев выполнено ревизионное эндопротезирование. В 2018 г. после ушиба коленного сустава выявлен рецидив инфекции. Повторно выполнено двухэтапное реэндопротезирование с интервалом 4,5 месяца. В середине 2021 г. развился острый болевой синдром с нарушением функции сустава, подъемами температуры тела до 38°С, сформировался свищ с гнойным отделяемым. При поступлении в отделение пациентка передвигалась при помощи костылей с частичной опорой на правую нижнюю конечность. Жаловалась на резкие боли при опоре на ногу, при активных движениях в коленном суставе, ограничение сгибания (амплитуда 0/5/60°). Сопутствующие заболевания: сахарный диабет 2-го типа, ожирение II степени (ИМТ – 36,1), ИБС – постоянная форма фибрилляции предсердий, гипертоническая болезнь III степени, риск 4, анемия легкой степени тяжести, язвенная болезнь двенадцатиперстной кишки (ремиссия), хронический калькулезный холецистит (ремиссия). Локально: гиперемия и отечность области сустава, свищ по передней поверхности, сообщающийся с полостью сустава, гипотрофия мышц правого бедра – 5 см. Функциональное состояние правой нижней конечности по шкале KSS неудовлетворительное (38 баллов), уровень боли по ВАШ 8 баллов. При обследовании: СОЭ – 48 мм/ч, СРБ – 13,6 мг/л, в суставном аспирате – рост Staphylococcus caprae, рентгенологически – дефекты суставных концов F2A и T3 по AORI.
Предоперационное планирование
Для предоперационного планирования выполнена мультиспиральная компьютерная томография (МСКТ) области коленного сустава с минимальным шагом. Уточнены объемы дефектов мыщелков бедренной кости и метафиза большеберцовой кости, выявлены признаки нестабильности металлоконструкции в виде неравномерной резорбции костных тканей, прилегающих к компонентам ревизионного эндопротеза (более тибиального) с истончением кортикального слоя.
На основе цифровых данных МСКТ создана виртуальная 3D-модель большеберцового компонента, повторяющая по форме и размерам имеющийся костный дефект, включающий артикулирующую поверхность (рис. 1).
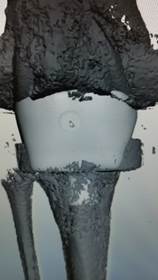 |
Рис. 1. Виртуальная 3D-модель индивидуального большеберцового компонента, воспроизводящая дефект кости
В соответствии с виртуальной моделью индивидуального компонента на завершающем этапе подготовки методом 3D-печати изготавливалась разъемная матрица из ударопрочного полистирола. В центре нижней части корпуса матрицы предварительно создавали отверстие для удаления лишнего количества цемента и установки стержня в массив имплантата.
Ход оперативного вмешательства
Операция выполнялась под спинальной анестезией в положении пациентки на спине. Переднемедиальным парапателлярным доступом (по старому послеоперационному рубцу) осуществлены иссечение свища и вскрытие суставной полости правого коленного сустава. При вскрытии выделилось 40 мл гнойного содержимого, отмечены выраженные рубцовые изменения периартикулярных тканей и разрастания грануляционной ткани. Удалены нестабильные бедренный и тибиальный компоненты эндопротеза. Произведена хирургическая обработка гнойного очага (иссечены патологические измененные ткани), на микробиологическое исследование отправлены 5 образцов тканевых биоптатов из различных локализаций. Произведена обработка суставных концов бедренной и большеберцовой костей с помощью осцилляторной пилы и костных ложек до жизнеспособных костных структур. Дефект – диастаз между суставными концами – составил 73 мм. Интраоперационно при помощи изготовленной и стерильной матрицы сформирован индивидуальный большеберцовый компонент из двух доз костного цемента (80 г) с добавлением 4 г термостабильного антибиотика, назначенного на основании предоперационной антибиотикограммы. Индивидуальный имплантат на стадии полимеризации армирован титановым стержнем для последующей интрамедуллярной фиксации. Выполнена проверка ориентации индивидуального большеберцового и официнального бедренного компонентов в соответствии с предоперационным планированием, после определения необходимого положения компоненты спейсера имплантированы на костный цемент с добавлением антибиотика. После полимеризации проверена состоятельность связочного аппарата сустава тестами боковой и переднезадней стабильности с определением тенденции к вывиху/подвывиху при сгибании и разгибании голени. Интраоперационная пассивная амплитуда движений в суставе составляла 0/0/95°. Установлен дренаж Редона, произведен послойный шов раны.
Послеоперационный период протекал без осложнений. В стационаре пациентка получала внутривенную антибактериальную терапию вместе с антикоагулянтом в профилактической дозировке. На 3-и сутки пациентке рекомендованы индивидуальные упражнения, разрешена ходьба с частичной нагрузкой на оперированную конечность при помощи костылей под контролем инструктора ЛФК. Выписана на амбулаторный этап через 9 дней после хирургического вмешательства с первично заживающей послеоперационной раной без отделяемого.
Амбулаторный этап
На амбулаторном этапе пациентке рекомендован прием антибактериального и антикоагулянтного препаратов в таблетированных формах. Антибактериальную терапию продолжать до 6 недель, антикоагулянтная профилактика сроком 35 дней после операции. Контрольные осмотры проводились трехкратно с интервалом в 1 месяц. При этом оценивались локальный статус, функция сустава, выполнялись пункции коленного сустава с микробиологическим исследованием аспирата для исключения рецидива инфекции. После получения двух отрицательных результатов бактериологического исследования пациентке выполнено МСКТ исследование правого коленного сустава. На основании полученных данных была создана виртуальная индивидуальная модель имплантата, соответствующая форме и размерам дефекта суставного конца большеберцовой кости, а также имеющая правильную осевую ориентацию. При помощи 3D-печати, методом лазерного спекания мелкодисперсного титанового порошка, изготовлен индивидуальный имплантат, замещающий дефект проксимального отдела большеберцовой кости. В своей структуре имплантат имел опорную поверхность под официнальные компоненты ревизионного эндопротеза, а также отверстие для установки интрамедуллярной ножки на костный цемент.
В течение всего периода амбулаторного наблюдения у пациентки отмечено отсутствие клинических и лабораторных признаков рецидива инфекции. Трехкратное бактериологическое исследование суставного аспирата показало отрицательные результаты.
Ревизионное эндопротезирование
Через 4,5 месяца после установки спейсера пациентка госпитализирована для выполнения заключительного этапа ревизионного эндопротезирования. При поступлении пациентка передвигалась при помощи трости с частичной опорой на правую нижнюю конечность. Жалобы на умеренные боли при нагрузке и активных движениях. Локально: кожные покровы физиологической окраски, незначительная отечность области сустава. Активные движения в коленном суставе от 0 до 85°, функциональное состояние правой нижней конечности по шкале KSS хорошее (79 баллов), уровень боли по ВАШ 3 балла. При обследовании: СОЭ – 20 мм/ч, СРБ – 4,3 мг/л, в суставном аспирате роста микроорганизмов не выявлено, тест на лейкоцитарную эстеразу отрицательный, при цитологическом исследовании выявлено 347 клеток на микролитр. Рентгенологически компоненты артикулирующего спейсера стабильны (рис. 2).
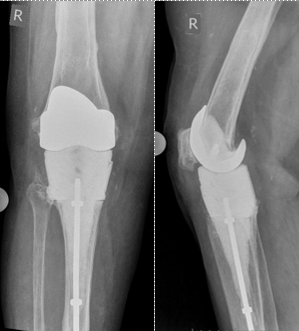
Рис. 2. Пациентка Д., 76 лет. Рентгенограммы правого коленного сустава в прямой и боковой проекциях перед выполнением ревизионного эндопротезирования
Ревизионное эндопротезирование выполнялось под спинальной анестезией с седацией в положении пациентки на спине. Выполнен переднемедиальный парапателлярный доступ с иссечением старого послеоперационного рубца. При вскрытии полости сустава выделилось 10 мл прозрачной, желтоватой синовиальной жидкости. При выполнении ревизии установлено: оболочка полости сустава бледная, фиолетово-синюшного цвета, рубцово-измененная. Суставная жидкость, фрагменты оболочки и рубцовых тканей взяты для гистоморфологического и бактериологического исследований. Удалены компоненты артикулирующего спейсера при помощи ревизионного набора инструментов, без особых технических трудностей. Визуализирован дефект T3 типа, проксимальный отдел большеберцовой кости практически отсутствует. С использованием стандартного набора инструментов подготовлено костное ложе для бедренного компонента эндопротеза повышенной связанности. Для дополнительной фиксации бедренного и индивидуального большеберцового компонентов выполнены костномозговые каналы под стандартные интрамедуллярные ножки. Прецизионно замещен костный дефект индивидуальным титановым имплантатом. Оставшиеся компоненты эндопротеза установлены на костный цемент с термостабильным антибиотиком. Произведены краевая моделирующая резекция и денервация надколенника при помощи осцилляторной пилы и электрокаутера. На заключительном этапе выполнены мобилизация нижнего отдела четырехглавой мышцы, послойное ушивание операционной раны. Интраоперационная амплитуда пассивных движений в суставе от 0 до 90°.
В послеоперационном периоде проводились внутривенная антибактериальная терапия и подкожное введение антикоагулянта в профилактической дозировке. Пациентка вертикализирована на следующие сутки после операции под контролем инструктора ЛФК, рекомендована ходьба при помощи костылей с частичной опорой на оперированную конечность. Температура тела не превышала 36,9оС, жалобы на умеренные боли в правом коленном суставе при опоре. Послеоперационная рана без раневого отделяемого. Через 3 дня после операции пациентка выписана на амбулаторное лечение по месту жительства с рекомендациями: курс индивидуальных упражнений с постепенным увеличением нагрузки на оперированный сустав для восстановления силы мышц, амплитуды движений, стереотипа ходьбы, прием антибактериальных препаратов в таблетированной форме 6 недель, антикоагулянтного препарата 35 дней после операции, контрольные осмотры в динамике в сроки 1, 3, 6, 12 месяцев и последующим ежегодным наблюдением.
Спустя 6 месяцев в институте реабилитации ФГБОУ ВО «ПИМУ» пациентке проведен курс восстановительного лечения: массаж правой нижней конечности, локальная крио- и лазеротерапия, занятия ЛФК (в том числе в бассейне), тренировки с биологической обратной связью по опорной реакции, механотерапия, а также аппаратные статокинетические нагрузки.
Результаты исследования
Через 12 месяцев после операции пациентка ходит без дополнительной опоры с полной нагрузкой на оперированную конечность. Активные движения в коленном суставе от 0 до 95°, болевой синдром по ВАШ – 2, результат по шкале KSS составил 88 баллов. На контрольных рентгенограммах признаки нестабильности металлоконструкции отсутствуют, сохраняется правильная ориентация компонентов ревизионного эндопротеза правого коленного сустава (рис. 3).
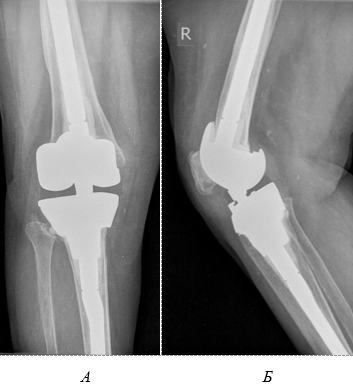
Рис. 3. Пациентка Д., 76 лет. Рентгенограммы правого коленного сустава через 12 месяцев после ревизионного эндопротезирования: А – прямая проекция, Б – боковая проекция
Заключение
Замещение обширных дефектов T3 и F3 типов остается значимой проблемой при выполнении двухэтапного реэндопротезирования. Ранее пациентам с неоднократными рецидивами ППИ и обширными дефектами костных структур для купирования инфекционного процесса преимущественно выполнялись «операции отчаяния» (артродез коленного сустава или ампутация на уровне бедра). Развитие аддитивных технологий с возможностью создания прецизионных компонентов позволило выполнить органосохраняющее двухэтапное реэндопротезирование с замещением Т3 дефекта на каждом из этапов. Полученные результаты лечения демонстрируют высокий потенциал данной хирургической тактики у пациентов с перипротезной инфекцией и наличием дефектов 3-го типа по AORI. Сохранение опороспособности нижней конечности, функции сустава и низкий болевой синдром обеспечивают высокое качество жизни данной группы пациентов.
Библиографическая ссылка
Митрофанов В.Н., Зыкин А.А., Королёв С.Б., Преснов Д.В., Комаров Р.Н., Живцов О.П., Горбатов Р.О. ПРИМЕНЕНИЕ ИНДИВИДУАЛЬНЫХ ИМПЛАНТАТОВ ПРИ ДВУХЭТАПНОМ ЛЕЧЕНИИ ПЕРИПРОТЕЗНОЙ ИНФЕКЦИИ КОЛЕННОГО СУСТАВА: КЛИНИЧЕСКИЙ СЛУЧАЙ // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33063 (дата обращения: 08.01.2026).
DOI: https://doi.org/10.17513/spno.33063



