Болевой синдром сопутствует подавляющему большинству патологических состояний, что делает обезболивание одной из наиболее актуальных проблем медицинской помощи, особенно в периоперационном периоде. Действительно, качественная анальгезия непосредственно связана с оценкой качества жизни и потребностью в медицинской помощи [1–3]. Послеоперационный болевой синдром характерен для более чем 80% пациентов, более половины из которых сообщают о недостаточном обезболивании [4–6]. Значительную роль в борьбе с болью играет применение мультимодальной анальгезии, в том числе НПВС. И, поскольку не существует единой схемы обезболивания, подбор препаратов остается искусством анестезиолога. Но можно ли оптимизировать такую терапию? Насколько активное применение НПВС в пери-, а особенно предоперационном периоде, безопасно?
С одной стороны, использование НПВС ограничено рядом факторов безопасности: так, известно, что эта группа препаратов может вызывать ОПП, приводить к коагуляционным нарушениям и т.д. [7–9]. С другой стороны, метаанализ исследований, посвященных безопасности НПВС (Cochrane 2021) [10], демонстрирует неопределенность, и для оценки профиля безопасности нужны дальнейшие исследования.
Полагаем, что наша работа будет способствовать взвешенной оценке рисков и пониманию безопасности пациента при проведении анальгезии с применением НПВС в пред- и послеоперационном периоде.
Цель исследования – оценка эффективности и безопасности превентивного применения различных НПВС при плановых операциях в условиях общей анестезии.
Материал и методы исследования
Настоящее одноцентровое рандомизированное проспективное исследование проведено на базе ФГБУ СЗОНКЦ им. Л.Г. Соколова ФМБА России и получило одобрение локального этического комитета (Протокол № 4 заседания ЛЭК ФГБУ СЗОНКЦ им. Л.Г. Соколова от 27.03.2023 г.).
В исследование первоначально планировалось включить 70 пациентов, однако 10 человек исключены в соответствии с критериями невключения и 2 – в связи с отказом от дальнейшего участия в исследовании (табл. 1). Пациенты были разделены на две группы, сопоставимые по антропометрическим характеристикам, структуре фоновой патологии и типам выполняемых операций торакального и урологического профиля.
Таблица 1
Критерии отбора пациентов для исследования
|
Критерии включения |
1. Подписанное информированное добровольное согласие 2. Пациенты обоих полов старше 18 лет 3. Плановые торакальные или урологические операции |
|
Критерии невключения |
1. Непереносимость НПВС, используемых в исследовании 2. Пациенты с бронхиальной астмой 3. Эрозивные и язвенные поражения ЖКТ в стадии обострения 4. Печеночная недостаточность, 10–15 баллов по Чайлд-Пью 5. ОПП/ХБП, клиренс креатинина <50 ml/min 6. Декомпенсация ХСН 7. Цереброваскулярное (в том числе внутричерепное) или другие кровоизлияния 8. Гемофилия и другие коагулопатии, в том числе гипокоагуляция 9. Беременность, грудное вскармливание 10. Пациенты младше 18 лет |
|
Критерии пострандомизационного исключения |
1. Отзыв информированного согласия 2. Отказ от дальнейшего участия в исследовании |
Продолжительность оперативных вмешательств составляла в среднем 194,3±37,6 мин. Для индукции использовали пропофол в дозе 1,9±0,6 мг/кг и фентанил в дозе 151,1±50,6 мкг. Поддержание анестезии осуществлялось севофлураном 1–3 об% и фентанилом 2–3 мкг/кг/ч. Миорелаксиция достигалась применением рокурония бромида 101,2±33,7 мг под контролем нейромышечной проводимости с помощью монитора TOF-Watch. Для обеспечения безопасности пациента интраоперационно применяли Гарвардский стандарт мониторинга, а оценка выраженности боли проводилась с помощью индекса qNOX монитора CONOX Fresenius Kabi. Этот монитор позволяет проводить альгезиметрию (индекс qNOX) и оценку глубины анестезии (индексы qCON), однако применительно к данной работе нас интересовал только первый параметр.
Пациенты были разделены на две группы. В группе 1 (n=32) пациентам за полчаса до операции и 1 раз в 12 ч в ОРИТ вводили ибупрофен 800 мг в/в капельно, а в группе 2 (n=26), контрольной, – кетопрофен 100 мг в/в капельно в симметричных моментах. Интенсивность боли определяли с помощью альгезиметра (индекс qNOX), последнее значение индекса записывали по завершении операции. Кроме подхода к обезболиванию, различий в ведении послеоперационного периода в ОРИТ не было. Рандомизация распределения пациентов по группам производилась методом таблиц. Структура групп по сопутствующей патологии и выполненным вмешательствам приведена в таблицах 2 и 3.
В послеоперационном периоде оценивали эффективность и безопасность анальгезии. Выраженность болевого синдрома контролировали по ВАШ (каждые 3 часа) и потребности в наркотических анальгетиках. Кроме того, изучали динамику уровня кортизола в крови как индикатора стресс-ответа на боль. Для оценки безопасности использовали лабораторные данные, в первую очередь, концентрацию креатинина, мочевины и цистатина С, характеризующих функцию почек, динамику ОАК и ретикулоцитоз, а также сывороточные показатели гемостаза и функциональные тесты (ТЭГ).
Таблица 2
Структура групп по характеристикам пациентов и сопутствующей патологии
|
Критерии |
Изучаемая группа, [min; max] |
Группа контроля |
Значение p |
|
N |
32 |
26 |
|
|
Пол мужской/женский |
66,7%/33,3% |
62,5%/37,5% |
0,73 |
|
Возраст, годы |
57 [38; 70] |
61 [40; 73] |
0,89 |
|
ХСН по NYHA, медиана, размах |
3 [1; 5] |
3 [1; 5] |
0,89 |
|
Аритмии |
32,4% |
20,0% |
0,82 |
|
СД, тип 2 |
44,4% |
42,7% |
0,70 |
|
ХОБЛ |
14,8% |
20,0% |
0,87 |
|
ИМТ >30,0 |
44,4% |
40,0% |
0,74 |
Таблица 3
Структура групп по виду операций
|
Операция |
Изучаемая группа |
Группа контроля |
||
|
n |
% |
n |
% |
|
|
Верхняя лобэктомия |
7 |
21,9 |
8 |
30,8 |
|
Средняя лобэктомия справа |
3 |
9,4 |
1 |
3,8 |
|
Нижняя лобэктомия |
6 |
18,8 |
2 |
7,7 |
|
Тимэктомия |
3 |
9,4 |
2 |
7,7 |
|
Резекция булл, плеврэктомия |
8 |
25,0 |
11 |
42,3 |
|
Резекция почки |
5 |
15,6 |
2 |
7,7 |
|
Всего |
32 |
100 |
26 |
100 |
Статистическая обработка данных выполнена в программе Jamovi (версия 2.3.18). Авторы выбрали в качестве критериев значимости 95%-ный доверительный интервал и p<0,05. Анализ данных проведен с применением t-теста, метода Хи-квадрат и корреляционного анализа (коэффициент Пирсона).
Результаты исследования и их обсуждение
В процессе выполнения исследования 58 пациентов были разделены на 2 группы. В первой, включившей 32 пациента, для обезболивания использовали ибупрофен, во второй группе 28 пациентов получали кетопрофен. В обеих группах проверка на нормальность подтвердила соответствие наблюдаемого распределения изучаемых параметров (кроме ВАШ) нормальному закону, а кроме того, отсутствие значимых различий по половозрастному составу групп, характеристикам пациентов и виду сопутствующей патологии делает группы сопоставимыми (табл. 2 и 3). Оценка значений ВАШ показала распределение, отличное от нормального, поэтому для анализа наблюдаемых различий был выбран критерий Хи-квадрат; в результате в трех первых контрольных точках (0, 3, 6 часов) ВАШ в группе ибупрофена была ниже, чем в группе кетопрофена, p=0,036–0,044.
Основной идеей работы была оценка профиля безопасности применяемых препаратов. И, если кетопрофен используется сравнительно давно, то опыта использования внутривенной формы ибупрофена в дозе 1600 мг/сут, в том числе превентивного применения, в отечественной практике мало, как и информации о возможных неблагоприятных эффектах.
В первую очередь авторы оценили наличие почечной дисфункции вследствие применения НПВС. Для этого в динамике оценивали уровни мочевины, креатинина и цистатина С (ранний предиктор ОПП). В результате концентрация креатинина и мочевины между группами значимо не различалась (содержание креатинина сразу после операции в группе ибупрофена 95,02±9,01 мкмоль/л, в группе кетопрофена – 92,37±5,67 мкмоль/л, p>0,05, на следующий день – 102,96±8,38 мкмоль/л и 92,75±7,05 мкмоль/л соответственно, p>0,05). Иная картина наблюдается при оценке цистатина С. Его концентрация определялась по окончании операции и утром следующего дня. В исследуемой группе после операции уровень цистатина С составил 0,92±0,24 мг/л, а в контрольной он был выше – 1,17±0,42 мг/л, p<0,05. Важной особенностью было то, что уже при этом первом контроле у 10 пациентов (31,3%) исследуемой группы и 5 (19,2%) контрольной концентрация цистатина С выходила за пределы референсных значений, а наблюдаемые межгрупповые различия не являются статистически значимыми. Однако в следующей контрольной точке при схожих средних значениях (0,95±0,29 мг/л и 1,19±0,43 мг/л в группах ибупрофена и кетопрофена соответственно) различия между группами оказываются значимыми при p<0,05.
Рассмотрим динамику уровня цистатина. В исследуемой группе на втором контроле он был повышен у 14 пациентов (43,8%), а в контрольной – у 15 (58,3%). При этом в группе ибупрофена у 10 пациентов из этих 14 цистатин был повышен уже на первом контроле, а из этих 10 у 8 на втором контроле уровень цистатина был меньше, чем на первом. Отсюда можно заключить, что в исследуемой группе изменение концентрации цистатина от физиологической до патологической наблюдалось лишь у четырех пациентов (12,5%). В контрольной группе такая динамика наблюдалась в 10 случаях (34,6%); у 5 пациентов уровень цистатина был повышен уже на первом контроле, у 1 он снизился на втором контроле по сравнению с первым. Наглядно описанная динамика представлена на рисунке 1.
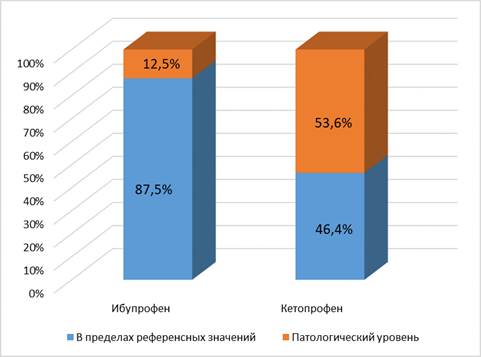
Рис. 1. Динамика концентрации цистатина С (доля пациентов, продемонстрировавших нарастание от нормального уровня до патологического) в изучаемых группах
Авторы полагают, что нарастание уровня цистатина С до патологических значений свидетельствует о нарушении функции почек, обусловленном как перенесенной операцией (хирургическим стрессом), так и проводимой терапией. Клинически у многих пациентов в послеоперационном периоде имеет место дисфункция почек, выражающаяся в редукции диуреза. Как правило, это состояние транзиторно, но, тем не менее, говорит о патологических изменениях выделительной функции. В данной работе демонстрируется объективный критерий такой дисфункции. Значимость выявленных различий между группами по этому признаку можно оценить с помощью критерия Хи-квадрат: в группе ибупрофена дисфункция выявлена в 4 случаях из 32, а в группе ибупрофена – в 10 из 26. В таком случае значение критерия Хи-квадрат равно 0,031, что подтверждает статистическую значимость выявленных различий при p<0,05.
Итак, принимая во внимание сравнимость групп по типам операций и характеристикам пациентов, а также то, что различия в терапии послеоперационного периода связаны только с применяемым НПВС, можно заключить, что меньшая частота нарушения функции почек в исследуемой группе связана с большей безопасностью ибупрофена по сравнению с кетопрофеном.
Вторым важным вопросом было влияние применяемых препаратов на гемостаз. Для его оценки авторы изучали статические (коагулограмму, а именно МНО, АЧТВ, фибриноген, Д-димер) и функциональные (ТЭГ) тесты.
При анализе показателей коагулограммы в группах получены следующие результаты. Так, уровень Д-димера сразу по окончании операции составил в группе ибупрофена 337,54±79,79 нг/мл, а в группе кетопрофена – 506,38±109,17 нг/мл. Значение p в этом случае >0,05, что позволяет говорить об отсутствии значимых различий на данном этапе. На следующий день значения Д-димера составили 800,88±161,99 нг/мл и 1272,56±260,99 нг/мл в группах ибупрофена и кетопрофена соответственно, p>0,05. Таким образом, и на этом этапе не наблюдается значимых межгрупповых различий. Далее авторы сравнили значения АЧТВ-ratio: в исследуемой группе сразу после операции оно составило 0,97±0,02, а в контрольной – 0,96±0,03, p>0,05, а на следующий день – 0,92±0,02 и 0,86±0,03 соответственно, p>0,05. Следовательно, этот параметр в обеих группах значимо не различался ни после окончания операции, ни на следующий день. Аналогичную картину демонстрируют фибриноген (4,24±0,4 г/л в группе 1 и 3,61±0,3 г/л в группе 2, p>0,05, сразу по окончании операции и 4,61±0,25 г/л в группе 1 и 4,51±0,25 г/л в группе 2, p>0,05, на следующий день), МНО (1,03±0,03 г/л в группе 1 и 1,03±0,01 г/л в группе 2, p>0,05, сразу по окончании операции и 1,09±0,01 г/л в группе 1 и 1,15±0,03 г/л в группе 2, p>0,05, на следующий день) и тромбоциты (253,93±15,88 тыс/мл в группе 1 и 282,86±24,94 тыс/мл в группе 2, p>0,05 сразу по окончании операции и 217,21±9,15 тыс/мл в группе 1 и 207,6±15,39 тыс/мл в группе 2, p>0,05, на следующий день).
На следующем этапе авторы оценили различия в показателях ТЭГ, анализ выполнялся на следующий день после операции. Так, в группе ибупрофена и кетопрофена соответственно R составил 5,82±3,11 мин и 6,34±2,56 мин, p>0,05, K – 1,97±1,02 мин и 2,04±1,10 мин, p>0,05, угол альфа – 62,91±14,11° и 58,47±13,84°, p>0,05, МА – 59,12±11,08 мм и 61,24±12,17 мм, p>0,05.
Таким образом, продемонстрировано отсутствие значимых межгрупповых различий как по статическим тестам, так и по динамическим, что позволяет сделать вывод об отсутствии сколько-нибудь клинически существенного влияния изучаемых препаратов на функцию свертывающей системы крови при указанной схеме применения.
Еще одним важным критерием безопасности для авторов являлось влияние изучаемых препаратов на различные ростки кроветворения. Если о влиянии на тромбоциты сказано ранее в аспекте гемостаза, то для оценки влияния на эритропоэз можно оценить динамику ретикулоцитов. Оценка изменения числа лейкоцитов в данном случае не будет достаточно надежно говорить о влиянии на лейкопоэз, так как, с одной стороны, воспаление в области выполненной операции будет вызывать лейкоцитоз, с другой стороны, НПВС-активность препаратов будет ограничивать развитие воспаления, но это не является влиянием на число лейкоцитов непосредственно. Итак, авторы оценили ретикулоцитоз в изучаемых группах (анализ проводился только на следующий день после операции): среди пациентов, которым вводили ибупрофен, он составил 0,95±0,40, а у пациентов, получавших кетопрофен, – 1,14±0,37, p>0,05, причем в обеих группах значения находились в пределах референсного интервала. Из этого можно сделать вывод об отсутствии значимого влияния ибупрофена на развитие эритроцитов. С учетом сказанного ранее о динамике тромбоцитов можно судить о том, что в изучаемом диапазоне доз и длительности применения ибупрофен не оказывает негативного влияния на картину периферической крови.
Для иллюстрации приведенных данных можно обратиться к рисункам 2 и 3. На представленных графиках значения средних и стандартных отклонений приведены в процентном виде, чтобы адекватно изобразить величины разных размерностей.
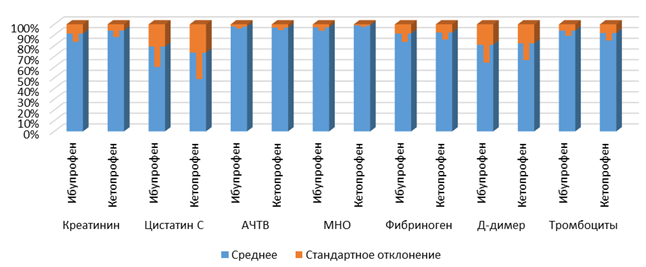
Рис. 2. Средние значения и стандартные отклонения указанных величин сразу после операции
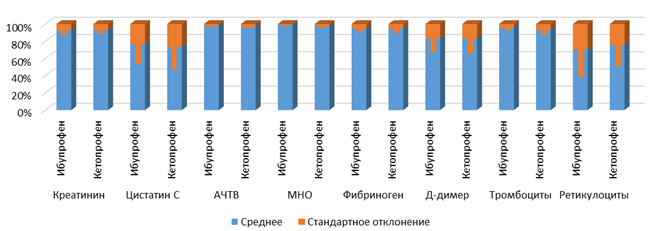
Рис. 3. Средние значения и стандартные отклонения указанных величин на следующий день после операции
В отношении обезболивания ибупрофен и кетопрофен продемонстрировали сходный уровень интраоперационной анальгезии, однако при поступлении в ОРИТ пациенты из группы ибупрофена отмечали меньшую интенсивность болевого синдрома. В качестве критериев оценки использовали динамику плазменной концентрации кортизола (в группе ибупрофена 571,3±336,8 нмоль/л, а в группе кетопрофена – 402,2±265,0 нмоль/л, p>0,05, значимой разницы нет) и потребность в агонистах опиоидных рецепторов, которая в исследуемой группе была значимо ниже: 42±17,5 мг тримеперидина/сут и в контрольной – 50±19,7 мг/сут, p<0,05.
Для объективизации оценки боли авторы изучили динамику индекса qNOX. Было отмечено, что превентивная анальгезия в составе индукции анестезии позволяет достичь эффективного обезболивания в обеих группах, но к моменту окончания анестезии значения индекса qNOX возрастали: в группе ибупрофена в начале операции он составлял 37,5±7,3, а в конце – 61,8±8,4, а в контрольной группе – 40,6±4,8 и 57,2±9,0, разница между этапами (но не между группами) значима при p<0,05. Этот эффект может быть связан с желанием врача обеспечить скорейший выход из общей анестезии путем сокращения дозы опиоидных агонистов к концу операции, что, очевидно, приводит к снижению качества анальгезии. И в этой ситуации индекс qNOX позволяет визуализировать границу необходимого и достаточного обезболивания.
Для оценки связи между ВАШ и qNOX в момент окончания анестезии авторы оценили коэффициент корреляции Пирсона в изучаемых группах, он составил 0,43 (p<0,001), что демонстрирует совпадение субъективной оценки боли пациентом с ее инструментальной оценкой.
Таким образом, индекс qNOX минимизирует риски, связанные с проведением общей анестезии, и позволяет оптимизировать дозировку препаратов [11].
Заключение
В представленной работе авторы, в первую очередь, хотели оценить безопасность использования ибупрофена для внутривенного введения в схеме превентивного обезболивания. Кроме значимо более высокого уровня анальгезии, препарат показал лучший профиль безопасности по сравнению с кетопрофеном. Так, продемонстрированы его меньшее повреждающее действие на почечную функцию и отсутствие негативного влияния на систему гемостаза как по данным инструментальной оценки, так и клинически в виде отсутствия геморрагических осложнений. Кроме того, было показано, что применение альгезиметра позволяет надежнее выполнять обезболивание и предотвращать риски недостаточной анальгезии.
Таким образом, выбор ибупрофена в качестве препарата для превентивного периоперационного обезболивания в плановой хирургии – это безопасный и эффективный вариант анальгезии, и такая схема лечения заслуживает места в арсенале врача анестезиолога-реаниматолога.
Библиографическая ссылка
Данилов М.С., Симутис И.С., Ратников В.А., Щеглов А.Н., Сыроватский А.А., Половцев Е.Г., Карелов А.Е. ВЫБОР НЕСТЕРОИДНОГО ПРОТИВОВОСПАЛИТЕЛЬНОГО СРЕДСТВА КАК ПРЕДИКТОР БЕЗОПАСНОСТИ ПЕРИОПЕРАЦИОННОГО ПЕРИОДА // Современные проблемы науки и образования. 2023. № 6. ;URL: https://science-education.ru/ru/article/view?id=33040 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/spno.33040



