Согласно современной классификации ВОЗ, выделяют три типа синоназальных папиллом (CП): инвертированный (Ит), онкоцитарный (От) и экзофитный (Эт). Все три типа относятся к группе доброкачественных новообразований синоназального тракта. На основании множества наблюдений установлено, что СП Ит – это группа доброкачественных опухолей с агрессивным клиническим течением и высокой частотой рецидивов; кроме того, было показано, что они способны и к малигнизации. Так, по разным литературным данным, частота малигнизации СП колеблется от 5 до 27% со средним значением в 9%, данные выводы были сделаны на основе проведенного метаанализа в общей сложности 3177 клинических случаев [1].
Эпителиальный компонент СП Ит может быть сформирован различными типами эпителиальных клеток: многослойным плоским неороговевающим эпителием, цилиндрическим реснитчатым либо так называемым переходным, по сути, являющимся гиперплазированным слоем базальных и парабазальных клеток эпителия респираторного типа, без наличия реснитчатых эпителиоцитов в апикальной части пласта. Кроме того, часто встречается комбинация этих эпителиев в пределах одного случая, так же как и различного процентного соотношения участков экзофитного и эндофитного типов роста [2].
В настоящее время выделены следующие клинические факторы, позволяющие предположить злокачественную трансформацию СП: наличие кровянистых и гнойных выделений из носа, длительный стаж курения, деструкция стенки орбиты на КТ [3]. При этом морфологические критерии малигнизации СП до сих пор не описаны. Иммуногистохимический профиль малигнизации до конца не изучен.
Предполагаются два варианта возникновения злокачественных опухолей, ассоциированных с СП: СП и злокачественная опухоль сосуществуют одновременно (синхронные процессы), и метахронный процесс, когда злокачественная опухоль возникает в локализации предсуществующей, ранее резецированной СП [4].
Чаще всего СП инвертированного и онкоцитарного типа малигнизируются в конвенциональный плоскоклеточный рак и синоназальный плоскоклеточный неороговевающий рак [5]. Также в литературе были описаны наблюдения синхронного аденокистозного рака, мукоэпидермоидного рака, синоназальной недифференцированной карциномы, мелкоклеточной карциномы и карциномы NOS, инвертированной папилломы синоназального типа [6, 7].
Злокачественный компонент в СП может занимать различный объем опухоли. По разным литературным данным, эти цифры варьируют от 10 до 95% от всего объема опухоли [8], что значительно усложняет процесс дооперационной морфологической диагностики и требует от клинического врача применения мультифокальной дооперационной диагностической биопсии, взятой в различных локализациях опухоли, особенно ближе к основанию центральной части [9, 10].
Цель исследования. Выявить морфологические критерии малигнизации СП Ит.
Материалы и методы исследования. Из 271 случая СП конвенциональный плоскоклеточный рак и синоназальная плоскоклеточная неороговевающая карцинома были обнаружены в 13 случаях инвертированного типа. Для иммуногистохимического исследования было отобрано 5 наиболее показательных случаев. Критерии для включения наблюдений в данную группу определялись такими гистологическими признаками, как: участки с выраженным ядерным полиморфизмом и наличием атипических форм митозов в эпителиальном пласте СП, а также присутствие инвазивного, а не погружного роста эпителиального пласта в подлежащую строму с нарушением целостности базальной мембраны. Кроме того, в пределах одного операционного материала от одного пациента должны были быть как участки СП, так и очаги уже сформированной злокачественной опухоли, т.е. в исследование включены пациенты только с синхронным вариантом процесса. Данный критерий принят намеренно, поскольку в нынешних условиях очень сложно достоверно выявить злокачественный метахронный процесс при доброкачественных опухолях синоназального тракта (вследствие невозможности пересмотра предыдущих микропрепаратов, частичного исследования операционного материала при доброкачественном диагнозе, отсутствия гистологической верификации).
Исследование является ретроспективным. Материалом исследования служил операционный материал, полученный от 13 пациентов в стационаре ФГБУ НМИЦО ФМБА России. Во всех случаях опухоль удалялась хирургами с помощью эндоскопического оборудования, вследствие этого операционный материал был раскускован, поэтому исследованию подвергался весь материал без исключения и без формирования влажного архива. Операционный материал фиксировался в нейтральном забуференном 10%-ном формалине на протяжении 24 часов. Далее материал проходил обработку в гистопроцессоре карусельного типа MTP Slee Medical (Германия) с последующей заливкой в парафин и формированием парафиновых блоков. С парафиновых блоков изготавливались срезы толщиной 4–7 мкрм, с дальнейшим монтированием их на предметные стекла с адгезивным электростатическим покрытием «МиниЛаб» (Россия). Иммуногистохимическое исследование проводилось в иммуногистостейнере Ventana BencMark GX с использованием системы детекции UltraVIEW Universal DAB Detection KIT (Ventana Medical Systems, Inc, CША) и антителами Phosphohistone-H3 Rabbit Polyclonal Antibody (Roche Diagnostics, GmbH, Германия) и Ki-67 (clone: 30-9) (Ventana Medical Systems, Inc, CША).
Индекс пролиферативной активности (Ki-67) получали, вычисляя соотношение окрашенных и неокрашенных ядер на 500 клеток в пяти репрезентативных полях при х400. Митотическую активность (PHH3) определяли как количество клеток с позитивно-окрашенными ядрами в десяти полях зрения при увеличении х400.
Морфометрические измерения проводили на микроскопе Nikon Eclipse Ci-L, с программным обеспечением NIS-Elements D (Nikon, Япония).
Статистическую обработку цифровых показателей проводили в программном обеспечении Statistica 10 (StatSoft Inc., США). Данные были представлены в виде медианы (Me) с указанием квартилей (Q1–Q3). Оценку статистической достоверности полученных данных проводили с помощью непараметрического критерия Краскела–Уоллиса, z-теста с поправкой на множественные сравнения. Различия между показателями считали значимыми при p<0,05.
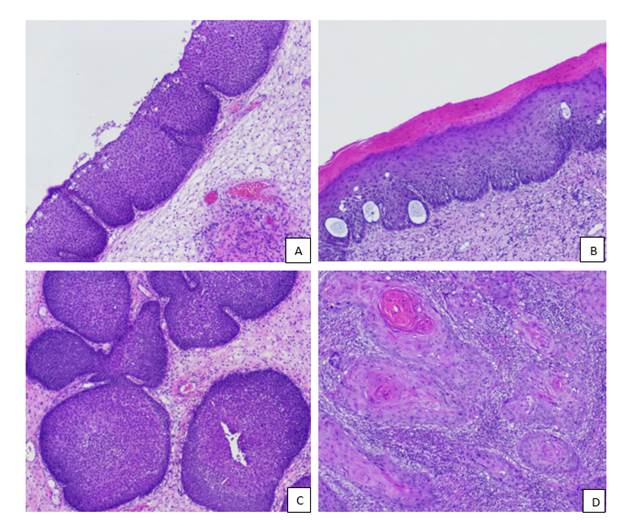
Результаты исследования и их обсуждение. При обзорной окраске гематоксилином и эозином в пределах одного случая нами было выделено 4 основных типа эпителиальных изменений: участки респираторного эпителия с базальноклеточной гиперплазией (ГКБ); участки плоскоклеточной метаплазии (Пл.мет.); участки синоназальной папилломы инвертированного типа (Сп Ит); участки плоскоклеточного рака (Пл. рак) (рис. 1).
В каждом конкретном случае количество парафиновых блоков/микропрепаратов было различно (зависело от объема операционного материала) и составляло от 3 до 12. Со всех стекол были изготовлены гистотопограммы. При изучении гистотопограмм учитывалась площадь всех стекол в пределах одного случая: сперва измерялась общая площадь (Sобщ.) всего операционного материала, включая участки типичной СП Ит, полипозно-измененной слизистой оболочки, участки неизменной слизистой оболочки, а также участки плоскоклеточного рака. После этого уже прицельно производились измерения площади участков плоскоклеточного рака (Sc-r), включающих как и участки карциномы in situ, так и уже инвазивную форму плоскоклеточного рака, с дальнейшим расчетом процентного показателя от общей площади микропрепаратов одного случая (табл. 1).
Таблица 1
Количество исследуемых микропрепаратов в каждом случае, а также общая площадь (Sобщ) исследуемого материала и площадь плоскоклеточного рака (Sc-r )
|
Порядковый № случая |
Кол-во блоков/препаратов |
Sобщ (мм2) |
Sc-r (мм2) |
|
1 |
4 |
215,59 |
35,99 ; (16%) |
|
2 |
7 |
481,20 |
77,19 ; (16%) |
|
3 |
11 |
592,78 |
173,19 ; (29%) |
|
4 |
13 |
744,8 |
43,35 ; (6%) |
|
5 |
14 |
966,12 |
11,01 ; (1%) |
|
6 |
9 |
710,56 |
322,67 ; (45%) |
|
7 |
12 |
823,26 |
64,87 ; (8%) |
|
8 |
7 |
536,91 |
169,60 ; (31%) |
|
9 |
9 |
659,82 |
282,87 ; (42%) |
|
10 |
5 |
484,77 |
248,54 ; (51%) |
|
11 |
10 |
701,95 |
195,35 ; (28%) |
|
12 |
8 |
697,01 |
432,92 ; (62%) |
|
13 |
7 |
510,99 |
117,45 ; (23%) |
Soбщ (мм2) – общая площадь всех гистологических срезов в пределах одного клинического случая, Sc-r (мм2) – площадь злокачественного компонента СП Ит.
Участки респираторного эпителия с базальноклеточной гиперплазией (или так называемый переходный эпителий) были представлены эпителиальным пластом, состоящим из мономорфных клеток с округлым ядром, узким ободком цитоплазмы, без признаков атипии или полиморфизма. Межклеточные контакты при окраске гематоксилином и эозином не визуализировались. В люминальной части эпителиального пласта, как правило, располагался слой цилиндрических реснитчатых клеток. Базальная мембрана эпителия на всем протяжении была интактна.
В отличие от зон, типичных для СП Ит, отсутствовали булавовидные погружения в строму и, как правило, отсутствовала интраэпителиальная инфильтрация нейтрофилами. Пролиферативный потенциал по Ki-67 составлял от 48 до 96% (Me=70 [58;93]), митотическая активность по PHH3 – от 1 до 4 митозов (Me=2 [2;3]).
В 9 случаях СП Ит с участками малигнизации были обнаружены участки плоскоклеточной дифференцировки с очагами дискератоза в виде гипер- или паракератоза, что составило 69,23% в этой группе. При этом из 258 случаев синоназальных папиллом без признаков малигнизации только в 3 случаях были обнаружены участки дискератоза, что составило 1,17%.
Очаги покровного эпителия с Пл.мет. характеризовались появлением признаков плоскоклеточной дифференцировки: клетки эпителиального пласта приобретали полигональную форму, визуально увеличивался объем цитоплазмы, цитоплазма приобретала эозинофильную окраску, отчетливо визуализировались межклеточные контакты в виде так называемых межклеточных мостиков, характерных для плоских эпителиев.
При этом важно отметить, что отсутствовали митозы в средних и верхних отделах эпителиального пласта (так называемые высокие митозы), в том числе и атипические, а также признаки ядерного и цитоплазматического полиморфизма. Пролиферативный потенциал по Ki-67 составлял от 19 до 71% (Me=48 [22;58]), митотическая активность по PHH3 – от 1 до 4 митозов (Me=1 [1;2]).
Участки СП Ит были представлены эпителием респираторного типа с выраженной базальноклеточной гиперплазией, с наличием множественных булавовидных погружений в строму, сегментоядерной интраэпителиальной инфильтрацией с формированием микроабсцессов. Пролиферативный потенциал по Ki-67 составлял от 7 до 39% (Me=12 [10;27]), митотическая активность по PHH3 – от 0 до 4 митозов (Me=1 [1;2]).
|
|
|
|
|
|
Рис. 1. A – участки респираторного эпителия с базальноклеточной гиперплазией; B – участки плоскоклеточной метаплазии; C – участки СП Ит; D – участки плоскоклеточного рака. Окраска гематоксилином и эозином. Ув.: х100
Местами эпителиальный пласт опухоли подвергался эпидермизации, схожей с картиной при Пл.мет., однако, в отличие от последней, отмечались грубые нарушения гистоархитектоники эпителиального пласта, чаще встречались фигуры митозов в базальном и парабазальном слоях (так называемые высокие митозы), в том числе и атипические, появлялся ядерный полиморфизм. Отмечался истинный инвазивный рост с наличием мелких эпителиальных отсевов вокруг основных очагов. Отсутствовала инраэпителиальная инфильтрация сегментоядерными лейкоцитами, свойственная для эпителиального компонента СП (рис. 2). Пролиферативный потенциал по Ki-67 составлял от 49 до 98% (Me=73 [52;82]), митотическая активность по PHH3 – от 2 до 9 митозов в п/з (Me=5 [4;7]). Данные опухоли при макроскопическом исследовании имели кожистый, мелкозернистый вид, отличающийся от типичного вида СП Ит без участков эпидермизации (рис. 3).
Таким образом, наиболее высокий пролиферативный потенциал по Ki-67 наблюдался в участках Пл. рака, причем статистически значимая разница была лишь со значениями Ki-67 участков Пл.мет. и типичной СП Ит. С очагами гиперплазии базальных клеток статистической значимости разницы не обнаружено, так же как и при сравнении между собой групп СП Ит и Пл.Мет (табл. 2).

Рис. 2. Гистологические признаки малигнизации СП Ит. А – наличие патологических фигур митозов. Ув.: х200. B – инвазивный рост опухоли. Ув.: х100, C – участки эпидермизации с нарушением гистоархитектоники эпителиального пласта, Ув.: х200, D – очаги ядерного полиморфизма. Ув.: х100. Окраска гематоксилином и эозином
Митотическая активность по PHH3 также была наибольшей в участках Пл. рака, и, в отличие от пролиферативного потенциала по Ki-67, разница с группой ГБК была статически значимой (табл. 2).
Таблица 2
Значения пролиферативного потенциала и митотической активности в различных участках СП Ит с участками малигнизации
|
Группа |
Пролиферативный потенциал по Ki-67 Me (Q1; Q3) |
Митотическая активность по PHH3 Me (Q1; Q3) |
|
ГБК (n=5), 1 |
70,00 (58,00;93,00) |
2,00 (2,00;3,00) |
|
Пл. Мт. (n=5), 2 |
48,00 (22,00;58,00) |
1,00 (1,00;2,00). |
|
СП Ит (n=5), 3 |
12,00 (10,00;27,00) |
1,00 (1,00;2,00) |
|
Пл. рак (n=5), 4 |
73,00 (52,00;82,00), |
5,00 (4,00;7,00) |
|
Тест Краскела–Уоллиса (n=20) |
H= 40,42 p<0,001 |
H= 65,69 p<0,001 |
|
P – значение попарных сравнений z-тестом с поправкой на множественные сравнения |
P1-2<0,05 P1-3<0,001 P1-4>0,05* P2-3>0,05* P2-4<0,05 P3-4<0,001 |
P1-2>0,05* P1-3<0,05 P1-4<0,001 P2-3<0,05* P2-4<0,001 P3-4<0,001 |
ГБК – базальноклеточная гиперплазия, Пл.Мт. – плоскоклеточная метаплазия, СП Ит – синоназальная папиллома инвертированного типа, Пл.рак – плоскоклеточный рак. p<0,05 – статистически значимые различия.
|
|
|
|
|
|
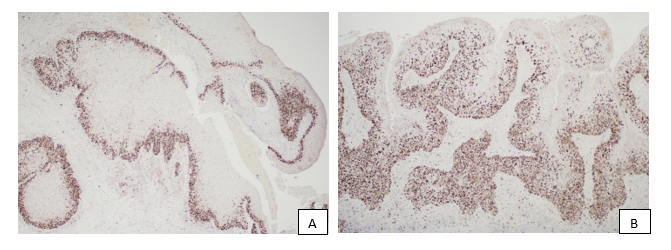
Рис. 3. А – пролиферативный потенциал по Ki-67 в эпителиальном пласте в участках СП Ит. Иммуногистохимический метод исследования, Ki-67 (clon: 30-9). Ув.: x100. В – пролиферативный потенциал по Ki-67 в участках эпителиального пласта в очагах плоскоклеточного рака. Иммуногистохимический метод исследования, антитело Ki-67 (clon: 30-9). Ув.: x100. С – митотическая активность по PHH3 (красная стрелка) и неспецифическая реакция DAB – хромогена с пероксидазой нейтрофильных лейкоцитов (зеленая стрелка). Иммуногистохимический метод исследования, PHH3 (clon: polyclonal). Ув.: x400. D – митотическая активность по PHH3 (красная стрелка – патологическая фигура митоза), неспецифическая реакция DAB-хромогена с перокисдазой нейтрофильных лейкоцитов отсутствует. Иммуногистохимический метод исследования, PHH3 (clon: polyclonal). Ув.: x400
Согласно приказу Министерства здравоохранения РФ от 24 марта 2016 179н «О правилах проведения патологоанатомических исследований» (п. 16.2), «объем вырезки и назначаемые окраски (реакции, определения) определяются врачом-патологоанатомом исходя из задач прижизненного патологоанатомического исследования», а также «с учетом клинических рекомендаций (протоколов лечения) по вопросам оказания медицинской помощи» [11]. При анализе при микроскопическом исследовании процентного показателя площади плоскоклеточного рака от общей площади всего операционного материала нами были получены показатели с широким диапазоном значений – от 1 до 62%, что было расценено как показание к тотальному гистологическому исследованию всего операционного материала, несмотря на отсутствующие признаки злокачественного роста при макроскопическом исследовании.
Кроме того, учитывая гетерогенность опухоли и современные возможности эндоскопической диагностики, а также относительно доступную локализацию СП на этапе дооперационной прижизненной патологоанатомической диагностики, авторы рекомендуют проведение именно мультифокальной биопсии, значительно повышающей достоверность диагноза с последующим адекватным выбором хирургической тактики.
Косвенным признаком, позволяющим заподозрить малигнизацию, было наличие участков плоскоклеточной метаплазии с явлениями гипер- и паракератоза покровного эпителия на поверхности образования, т.е. участков дискератоза без признаков атипии и полиморфизма. Так, в общей группе всех СП без признаков малигнизации данный процесс наблюдался лишь в 1,17% случаев против 69,23% группы СП Ит с малигнизацией, что подтверждается и другими исследованиями [12]. При этом существуют недавно опубликованные работы, расценивающие очаги плоскоклеточной метаплазии как отрицательный предиктор рецидива инвертированной папилломы [13] в СП Ит без очагов плоскоклеточного рака.
В участках малигнизации и плоскоклеточного рака визуально уменьшалась интраэпителиальная нейтрофильная инфильтрация, отсутствовали интраэпителиальные микроабсцессы, свойственные СП Ит. Данное явление, возможно, связано с запуском иного клеточно-опосредованного иммунитета.
Интересен тот факт, что пролиферативный потенциал между показателями Ki-67 в очагах базальноклеточной гиперплазии и плоскоклеточного рака не показал статистически значимых различий, имелись наиболее высокие показатели в сравнении с участками СП Ит и плоскоклеточной метаплазии. При этом митотическая активность по PHH3 относительно других исследуемых групп отмечалась лишь в участках плоскоклеточного рака (p<0,05). Таким образом, при оценке эпителиального пласта рационально исследовать не только пролиферативный потенциал, но и митотическую активность по PPH3. Важно отметить, что большое количество интраэпителиальных нейтрофильных лейкоцитов в эпителиальном пласте СП Ип во всех случаях давали неспецифическую реакцию с DAB-хромогеном, это должно учитываться в дальнейшем при подсчете митотического индекса. Исследование только пролиферативного потенциала по Ki-67, по нашему мнению, является неинформативным и может способствовать гипердиагностике злокачественного процесса.
Заключение. Основными и главными критериями наличия участков малигнизации являются: наличие доказанного инвазивного роста; появление клеточной и ядерной атипии и полиморфизма; наличие митозов в парабазальных и поверхностных слоях эпителиального пласта СП Ит; появление атипичных фигур митозов.
К косвенным признакам, позволяющим заподозрить процесс малигнизации в СП Ит при рутинном гистологическом исследовании биопсийного и операционного материала, следует отнести очаги дискератоза эпителиальной выстилки и снижение количества интраэпителиальной лейкоцитарной инфильтрации. Данные признаки должны расцениваться как показание к более детальному изучению всего операционного материала.
Библиографическая ссылка
Бахтин А.А., Сапегина О.А. МОРФОЛОГИЧЕСКИЕ ПРИЗНАКИ МАЛИГНИЗАЦИИ СИНОНАЗАЛЬНЫХ ПАПИЛЛОМ ИНВЕРТИРОВАННОГО ТИПА. // Современные проблемы науки и образования. 2023. № 5. ;URL: https://science-education.ru/ru/article/view?id=33021 (дата обращения: 29.01.2026).
DOI: https://doi.org/10.17513/spno.33021