Дексаметазон является одним из часто применяемых препаратов в анестезиологической практике. Парентеральное введение дексаметазона, наиболее часто используется с антиэмической целью для профилактики ПОТР [1]. Поскольку препарат обладает иммуносупрессивным и противовоспалительным действием, возможно его назначение для подавления воспалительных процессов в тканях и тем самым снижения интенсивности болевого синдрома [2]. Учитывая начало максимального эффекта препарата через 60-120 минут, обосновано его назначение до начала оперативного вмешательства в предоперационном периоде [3]. С развитием регионарной анестезии и поиском длительных местных анестетиков появился ряд исследований с применением адъювантов. Одним из применяемых адъювантов при блокаде периферических нервов является дексаметазон [4]. На настоящий момент имеются литературные данные о продлении длительности и повышении анальгетической эффективности периферических блокад с применением дексаметазона в качестве адъюванта к раствору местного анестетика [5; 6]. Пациенты после выполнения декомпрессивно-стабилизирующих операций на позвоночнике нуждаются в качественной анальгезии в послеоперационном периоде, что способствует более ранней активизации и реабилитации. Применение двустороннего болюсного ESP-блока при операциях на позвоночнике в качестве компонента анальгезии способствует снижению болевого синдрома и минимизации использования наркотических анальгетиков [7; 8]. На настоящий момент проведено множество работ по данному виду анальгезии, однако остается потребность в продлении анальгетического действия блокады и увеличении продолжительности времени до первого требования сильнодействующих анальгетиков.
Цель исследования: оценить анальгетическую эффективность дексаметазона в качестве адъюванта к раствору местного анестетика (ропивакаин) при выполнении межфасциальной блокады мышцы, выпрямляющей позвоночник (Erector spinae plane block, ESP-блок)
Материалы и методы исследования
Исследование выполнено на базе Университетской клиники ФГБОУ ВО «ПИМУ» Минздрава России. После одобрения этическим комитетом и получения добровольного письменного информированного согласия от пациентов проведено открытое, рандомизированное исследование. Распределение исследуемых на группы было проведено методом простой табличной рандомизации. В исследование были включены 37 пациентов в возрасте от 34 до 67 лет, которым выполнялись операции на позвоночнике по поводу дегенеративных изменений межпозвоночных дисков и компрессионных переломов тел позвонков. Соотношение по полу, возрасту и характеру оперативного вмешательства в каждой из групп равномерное (табл.).
Общая характеристика пациентов
|
|
Группа 1 (n=13) |
Группа 2 (n=12) |
Группа 3 (n=14) |
|
Пол (м/ж), n |
6/7** |
6/6** |
6/8** |
|
Средний возраст, Me(Q1;Q3) |
53,2(37;65)* |
52,4(35;63)* |
52,6(38;61)* |
|
ИМТ, Me(Q1;Q3) |
26,3 (19,7; 30,1)* |
25,9 (19,3; 30)* |
26,2 (20,1; 29,6)* |
|
ASA (I/II), n |
5/8** |
5/7** |
7/7** |
|
Диагноз/Операция |
|||
|
Нестабильный перелом тела позвонка (n)**/Одноуровневая декомпрессия и транспедикулярная фиксация соседних позвонков |
6 |
6 |
7 |
|
Остеохондроз позвоночника, спондилолистез, спинальный стеноз (n)** / Одноуровневая декомпрессивно-стабилизирующая операция с использованием кейджа и транспедикулярной фиксацией |
7 |
6 |
7 |
Примечание. Результаты считали достоверными при p≤0,05 для множественных сравнений (тест Краскела-Уоллиса*), p≤0,01 в парных сравнениях (тест Манна-Уитни), для оценки достоверности соотношений применяли критерий χ2(**).
Критериями включения являлись возраст пациентов от 30 до 70 лет с ASA I-II, которым необходима плановая одноуровневая декомпрессивно-стабилизирующая операция на позвоночнике по поводу дегенеративных изменений позвоночника (остеохондроз, спинальный стеноз, спондилолистез поясничного отдела позвоночника) или травматического повреждения позвонков (нестабильные переломы грудного или поясничного отдела позвоночника), а также наличие согласия пациента на проведение исследования. Критериями исключения являлись отказ от проведения исследования, возраст младше 30 и старше 70 лет, хронические заболевания сердечно-сосудистой, дыхательной и эндокринной систем в стадии декомпенсации, а также поражения кожных покровов воспалительного характера в месте предполагаемого проведения блокады. Не включались в группу исследования пациенты с аллергической реакцией на амидные анестетики в анамнезе. В зависимости от использования раствора дексаметазона все пациенты разделены на 3 группы. Для выполнения двустороннего ESP-блока пациентам 1-й группы (n=13) вводили по 20 мл 0,375% раствора ропивакаина (Fresenius Kabi, NORGE, Норвегия) с 4 мг дексаметазона (адъювант) с каждой стороны; во 2-й группе (n=12) выполняли ESP-блок 20 мл 0,375% раствора ропивакаина с каждой стороны в сочетании с внутривенным болюсным введением 8 мг дексаметазона (ООО «Эллара», Россия); в 3-й группе (n=14) ESP-блок выполнен 20 мл 0,375% раствором ропивакаина с каждой стороны без адъюванта и без внутривенного болюса дексаметазона.
Всем пациентам проводилась стандартная индукция анестезии с использованием фентанила (1,5-2,5 мкг/кг), пропофола (2,-3,5 мг/кг) и рокурония (0,6-1,0 мг/кг). После интубации трахеи поддержание анестезии осуществлялось ингаляционным анестетиком севофлураном (0,9-1,0 МАК). В положении пациентов на животе определялся уровень выполнения ESP-блока (на 2 сегмента выше предполагаемого оперативного доступа). После асептической обработки места пункции, с помощью ультразвуковой визуализации (аппарат SonoSite S II, FUJIFILM SonoSite, Inc, США) и датчика (конвексного С60xi 5-2 MHz для поясничного уровня; линейного для грудного уровня HFL 38xi/13-6 MHz) проводилась идентификация анатомических структур, необходимых для проведения блокады (поперечный отросток позвонков, мышца, выпрямляющая позвоночник, плевра, ребра). В пространство между мышцей, выпрямляющей позвоночник, и поперечным отростком позвонка вводился раствор местного анестетика. Для этого кончик иглы (20 G, B.Braun, Stimuplex A 120 мм, Германия) располагался на поверхности поперечного отростка позвонка, после проведения аспирационной пробы вводилась тест-доза раствора местного анестетика в объеме 1-2 мл. При правильном расположении кончика иглы отмечался «эффект линзы» - отслоение фасции мышцы, выпрямляющей позвоночник, от поверхности поперечного отростка позвонка. Далее вводился весь объем местного анестетика с проведением аспирационной пробы через каждые 5 мл введенного раствора. Правильность распространения раствора подтверждалась визуальным образованием гипоэхогенной полосы между мышцей, выпрямляющей позвоночник, и поперечными отростками позвонков.
В группе 1 в качестве адъюванта к раствору ропивакаина добавлялся дексаметазон по 4 мг с каждой стороны. Ропивакаин вводился в концентрации 0,375% по 20 мл с каждой стороны. В группе 2 выполнялся ESP-блок 0,375% раствором ропивакаина по 20 мл с каждой стороны. Перед началом операции вводился внутривенно болюсно дексаметазон в дозировке 8 мг. Пациентам группы 3 был выполнен ESP-блок 0,375% раствором ропивакаина по 20 мл с каждой стороны без применения дексаметазона.
Средняя длительность оперативного вмешательства - 140 минут. На этапе поддержания анестезии дополнительных введений анальгетиков не потребовалось. С целью поддержания миоплегии вводился рокуроний (15 мг/час). В послеоперационном периоде в случае недостаточной анальгезии вводили кетопрофен (100 мг) внутримышечно, при болевом синдроме выше 5 баллов и выше по визуально-аналоговой шкале вводился трамадол (100 мг) внутримышечно. Проводилась оценка интраоперационной гемодинамики (АДср., АДс, АДд,ЧСС), потребности в интраоперационных анальгетиках, оценка боли по визуально-аналоговой шкале в послеоперационном периоде, оценивалась длительность безболевого периода (от окончания операции до первого введения анальгетика), проводилось исследование уровня кортизола плазмы крови на наиболее травматичном этапе операции и через сутки после оперативного вмешательства, оценивалась потребность в дополнительном обезболивании после операции.
Проводилась с помощью пакета программы Statistica 10.0. Для определения характера распределения использовали критерий Шапиро-Уилка и графики квантилей. В качестве предварительного статистического метода применяли критерий Краскела-Уоллиса, с последующим попарным сравнением с помощью U-теста Манна-Уитни (для независимых выборок) и теста Уилкоксона (для зависимых выборок). Различия считали статистически значимыми при p≤0,01 (после пересчета на число сравнений). Учитывая малый объем выборки, использовали средние значения генеральной совокупности (доверительный интервал). Данные исследования были представлены также в виде среднего (М), стандартного отклонения (sd) и в виде медианы (Me), первого (Q1) и третьего квартиля (Q3). Для оценки долей использовали критерий χ2.
Результаты исследования и их обсуждение
Интраоперационная гемодинамика на всех этапах операции во всех группах исследования была стабильная. Показатели АДср., ЧСС, АДд, АДс между группами достоверных различий не имели (р=0,12). Дополнительного введения анальгетиков ни в одной из групп во время операции не потребовалось. В послеоперационном периоде оценивалась боль по шкале ВАШ через 1, 4, 6, 12 и 24 часа. Результаты представлены на рисунке 1. Интенсивность боли в первые 5 часов после операции во всех группах исследования была умеренная и достоверной разницы между группами не имела (р > 0,05). Спустя 5 часов после операции в группе 3 интенсивность болевого синдрома была выше, чем в других группах, что потребовало дополнительного введения сильнодействующих анальгетиков (p=0,001). При оценке боли через 12 и 24 часа интенсивность боли во всех группах сравнялась (p=0,21).
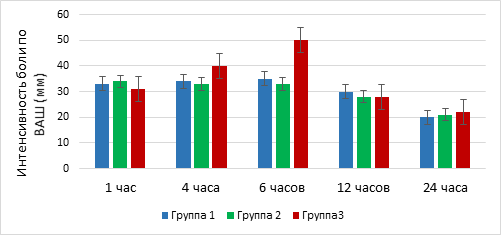
Рис. 1. Оценка болевого синдрома в послеоперационном периоде
Длительность безболевого периода (время до первого требования сильнодействующего анальгетика) составила для 1-й группы 5,5±1,3 ч, во 2-й группе – 5,2±1,0 ч, для 3-й группы - 4,2±1,6 ч. Частота использования сильнодействующих анальгетиков (трамадола): группа 1 и 2 - однократное введение в первые сутки (100 мг), группа 3 - двукратное введение в первые сутки (200 мг).
Исходный уровень кортизола плазмы крови перед операцией не различался между группами (p>0,05). Динамика изменений показателей плазменного кортизола в группах представлена на рисунке 2. Уровень кортизола на травматичном этапе оперативного вмешательства составил для 1-й группы 302,1±82,2 нмоль/л [95% ДИ 102,8-502,6]; во 2-й группе - 278,2±79,1 нмоль/л [95% ДИ 138,2-456,4]; в 3-й группе - 652±57,0 нмоль/л [95% ДИ 394,6-710,2] (р=0,004). Спустя 24 часа после операции уровень кортизола для 1-й группы составил 96,9±26,9 нмоль/л [95% ДИ 43,8-160,2], во 2-й группе - 115,1±32,9 нмоль/л [95% ДИ 43,5-187,3], в 3-й группе – 464,1±38,1 нмоль/л [95% ДИ 384,4-544,1] (р=0,01).

Рис. 2. Динамика показателей кортизола в плазме крови
Послеоперационная тошнота и рвота отмечалась в небольшом проценте в 3-й группе (20%). Осложнений от проведения анестезии не выявлено.
По результатам работы отмечено увеличение продолжительности эффективной анальгезии в группах исследования, в которых получали дексаметазон вне зависимости от способа введения. Основным в механизме влияния дексаметазона на интенсивность болевого синдрома является ингибирование синтеза простагландинов, циклооксигеназы и фосфолипазы А2, а также способность проникать через клеточную мембрану и изменять транскрипции генов [9]. Есть мнение, что при использовании дексаметазона в качестве адъюванта к раствору местного анестетика его действие обусловлено снижением возбудимости ноцицептивных С-волокон за счет прямого действия на мембраны клетки, подавляет выработку брадикинина в тканях, связывается с глюкокортикоидными рецепторами в цитозоле клеток и индуцирует изменения в ионных каналах [10]. Все это приводит к угнетению нейронных разрядов в нервных волокнах, снижается ноцицептивная стимуляция из зоны поврежденной ткани, что проявляется увеличением длительности и эффективности действия местного анестетика. Данные о том, что анальгетическое действие дексаметазона обусловлено снижением локального отека тканей в зоне повреждения, тоже имеют свою достоверность [11]. Однако в случае межфасциального ESP-блока, который предусматривает введение раствора на удаленном расстоянии от непосредственной области хирургического вмешательства, данная теория не является основополагающей. По результатам исследований имеются данные, что дексаметазон оказывает влияние на селективные m-рецепторы и оказывает опиоидоподобное действие [12]. Каждый из приведенных механизмов действия дексаметазона в большей или меньшей степени воздействует на организм, но что из них является доминирующим - остается открытым для изучения.
При анализе уровня кортизола плазмы выявлено снижение показателей кортизола в интраоперационном периоде на травматичном этапе оперативного вмешательства в тех группах, где использовался дексаметазон независимо от способа введения. В группе, где ESP-блок выполнялся без применения адъюванта, показатели плазменного кортизола были выше, но не выходили за верхние референсные значения нормы. Спустя сутки после операции уровень плазменного кортизола во всех группах не выходил за пределы нормы, но у исследуемых, получивших дексаметазон, показатели приближались к нижней границе нормы. Дексаметазон обладает подавляющим действием на секрецию кортизола за счет торможения гипоталамо-гипофизарно-адреналовой системы [13]. Кортизол является стресс-маркером в ответ на хирургическую травму, и его уровень в плазме крови напрямую зависит от качества интраоперационной анальгезии [14; 15]. Стоит отметить эффективность периоперационной анальгезии на фоне использования двусторонней межфасциальной блокады мышцы, выпрямляющей позвоночник (ESP-блок), при декомпрессивно-стабилизирующих операциях на позвоночнике во всех исследуемых группах, которая отразилась в стабильных показателях плазменного кортизола в пределах референсных интервалов. Системное действие дексаметазона проявилось в группах, где его применяли и внутривенно, и в качестве адъюванта к раствору местного анестетика при проведении ESP-блока, что проявилось более низкими показателями кортизола в плазме этих пациентов.
Заключение
По результатам исследования отмечается, что добавление дексаметазона к раствору местного анестетика при выполнении ESP-блока при операциях на позвоночнике увеличивает продолжительность эффективной анальгезии, снижает интенсивность болевого синдрома, а также минимизирует потребность в дополнительном обезболивании, тем самым снижая количество возможных осложнений. Тем не менее внутривенное введение дексаметазона при использовании ESP-блока до начала операции - показало сравнимые результаты качества обезболивания и удлинение периода до первого требования анальгетика. Стоить отметить положительное влияние дексаметазона на анальгетическую эффективность ESP-блока независимо от способа введения.
Библиографическая ссылка
Морунова А.Ю., Ежевская А.А., Загреков В.И., Боков А.Е., Наргизян А.З. ВЛИЯНИЕ ДЕКСАМЕТАЗОНА НА АНАЛЬГЕТИЧЕСКУЮ ЭФФЕКТИВНОСТЬ ESP БЛОКА ПРИ ДЕКОМПРЕССИВНО-СТАБИЛИЗИРУЮЩИХ ОПЕРАЦИЯХ НА ПОЗВОНОЧНИКЕ // Современные проблемы науки и образования. 2023. № 5. ;URL: https://science-education.ru/ru/article/view?id=32975 (дата обращения: 22.02.2026).
DOI: https://doi.org/10.17513/spno.32975



