Одним из часто встречающихся внекишечных проявлений воспалительных заболеваний кишечника (ВЗК) является поражение опорно-двигательного аппарата, распространенность артропатий достигает 50% среди пациентов с ВЗК [1; 2]. Согласно современным представлениям, общими характеристиками для ВЗК и спондилоартритов (СпА) являются генетическая предрасположенность с чувствительностью к факторам окружающей среды (курение, стрессы, инфекции) и дефекты иммунной регуляции, приводящие к аутоиммунным и аутовоспалительным реакциям. Помимо иммуногенетического маркера высокой предрасположенности к СпА – человеческого лейкоцитарного антигена HLA B27 (Human leukocytic antigen B27), полногеномные ассоциативные исследования (genome-wide association study, GWAS) выявили полиморфизмы в интерлейкине-23R (ИЛ-23R), ИЛ-12, STAT3, PTGER4, ИЛ-6R, ИЛ-10 и CARD9 [3]. Изучение механизмов, лежащих в основе иммунной регуляции и разрешения воспаления, представляет большой интерес для лучшего понимания патофизиологии внекишечных проявлений ВЗК и разработки новых подходов к терапии [4]. При обсуждении реализации механизмов врожденного и приобретенного иммунитета первоочередное значение уделяется провоспалительным цитокинам – фактору некроза опухоли α (ФНО–α), интерлейкинам (ИЛ-1β, ИЛ-6 и т.д.), что привело к созданию генно-инженерных биологических препаратов, применяемых для лечения ВЗК и СпА. Увеличение концентрации провоспалительных цитокинов при ВЗК и СпА является в том числе результатом запуска сигнальных путей нейтрофилов. Активность нейтрофилов реализуется посредством фагоцитоза с образованием активных форм кислорода (АФК) и нетоза - образования нейтрофильных внеклеточных ловушек (NETs). Роль противовоспалительных цитокинов в регуляции и разрешении воспаления при различных аутоиммунных и аутовоспалительных заболеваниях и их возможный терапевтический потенциал требуют уточнения.
Цель исследования – оценить возможные связи между показателями функциональной активности нейтрофилов и уровнями ФНО-α, пептидил-аргинин деиминазы 4 типа (PAD-4), ИЛ-10, ИЛ-17А, ИЛ-23 у пациентов с ВЗК и внекишечным проявлением в виде суставного синдрома.
Материал и методы исследования. Дизайн – одномоментное исследование. В исследование включены пациенты, обратившиеся в гастроэнтерологический кабинет и находившиеся на стационарном лечении ГБУЗ «Челябинская областная клиническая больница» в период с декабря 2019 года по январь 2021 года. Все пациенты подписали информированное согласие, одобренное этическим комитетом ФГБОУ ВО «ЮУГМУ» МЗ РФ (протокол №10 от 15.11.2019). Критерии включения: установленный диагноз язвенный колит (ЯК) или болезнь Крона (БК), возраст старше 18 лет, согласие пациента на участие в исследовании. Критерии исключения: наличие острых инфекционных заболеваний, онкологические заболевания с активностью процесса в течение последних пяти лет, беременные. Диагноз ЯК и БК устанавливался в соответствии с актуальными национальными клиническими рекомендациями [5; 6]. Выявление артропатий и наличия воспалительной боли в спине проводилось согласно критериям ASAS (The Assessment of SpondyloArthritis international Society, 2009), клинико-лабораторное и инструментальное обследования - согласно клиническим рекомендациям [7].
Для иммунологического исследования использовали венозную кровь, которую забирали в вакуумную пробирку с литий-гепарином объемом 6 мл. Исследование субпопуляционного спектра лейкоцитов крови проводили методом проточной цитометрии на проточном цитометре Navios 6/2 (Beckman Coulter, США). Для фенотипирования и дифференцировки субпопуляций нейтрофилов использовали конъюгаты моноклональных антител: CD3, PE-eFluor 610 (eBioscience, США); CD19, PE (eBioscience, США); CD56, PE (eBioscience, США); CD4, APC (eBioscience, США); CD8, PE-Cy5.5 (Invitrogen, США); CD25, PE-Cy7 (eBioscience, США); CD127, FITC (eBioscience, США).
Функциональную активность нейтрофилов периферической крови исследовали по показателям поглотительной способности частиц монодисперсного полистирольного латекса (активность, интенсивность фагоцитоза, фагоцитарное число), показателям кислородзависимого метаболизма в тесте с нитросиним тетразолием (НСТ): активности и интенсивности спонтанного и индуцированного НСТ-теста. Лизосомальную активность определяли по интенсивности люминесценции лизосом, обработанных акридиновым оранжевым [8].
Концентрацию PAD4 в сыворотке оценивали метода ELISA c использованием наборов производства Wuhan Fine Biotech Co., Ltd (КНР). Концентрацию ФНО-α, ИЛ-10 в сыворотке оценивали методом ELISA c использованием тест-системы «Вектор-Бест» (Россия). Концентрацию ИЛ-17А, ИЛ-23 в сыворотке оценивали методом ELISA c использованием тест-системы Cloud-Clone Corp. (КНР). Исследование уровня цитокинов и PAD4 проводили на иммуноферментном анализаторе ADALTIS Personal LAB (Италия).
Статистическая обработка данных проводилась с использованием пакета статистического анализа данных IBM SPSS v.19 и MedCalc v.20.218. Качественные переменные описывали абсолютными и относительными частотами (процентами). Количественные переменные описывали медианой (Ме) c указанием интерквартильного интервала [25-й процентиль; 75-й процентиль]. В целях определения взаимосвязей показателей использовали корреляционный анализ Спирмена. Для оценки значимости различий между двумя группами использовали критерий Манна-Уитни. Для сравнения качественных данных использовался критерий χ2 Пирсона. При сравнении трёх групп использовали критерий Краскела-Уоллиса с последующим апостериорным сравнением критерием Данна с поправкой уровня значимости по Бонферрони. Диагностическую значимость количественных признаков определяли ROC-анализом. Различия считали статистически значимыми при критическом уровне значимости 0,05.
Результаты исследования и их обсуждение. В исследование были включены 97 пациентов. Характеристика пациентов представлена в таблице 1.
Таблица 1
Характеристика больных с воспалительными заболеваниями кишечника
|
Показатели/ Characteristics |
БК/ CD (n=13) |
ЯК/ UC (n=84) |
Всего/ Total (n=97) |
p |
|
Мужчины (n, %)/ Male (n, %) Женщины (n, %)/ Female (n, %) |
2 (15,4%) 11 (84,6%) |
41 (48,8%) 43 (51,2%) |
43 (44,3%) 54 (55,7%) |
0,024 |
|
Возраст, лет (Ме, ИИ)/ Age, years (Ме [LQ; UQ]) |
40 (32,5; 64,0) |
45 (34,3; 56,8) |
45 (34,5; 57,0) |
0,987 |
|
Возраст начала заболевания, лет (Ме, ИИ)/ Age of IBD onset, years (Ме [LQ; UQ]) |
33 (29,0; 54,5) |
37 (28,0; 47,5) |
36 (28,0; 48,0) |
0,983 |
|
Тяжесть/ IBD severity: Легкая (n, %)/ Mild (n, %) Средняя (n, %)/ Moderate (n, %) Тяжелая (n, %)/ Severe (n, %) |
2 (15,4%) 3 (23,1%) 8 (61,5%) |
19 (22,6%) 24 (28,6%) 41 (48,8%) |
21 (21,6%) 27 (27,8%) 49 (50,6%) |
0,556 0,681 0,393 |
|
Локализация БК/ CD localizаtion: Верхние отделы ЖКТ (n, %)/ Isolated upper disease (n, %) Терминальный илеит (n, %)/ Ileal (n, %) Илеоколит (n, %)/ Ileocolonic (n, %) Колит (n, %)/ Colonic (n, %) |
1 (7,7%)
2 (15,4%)
6 (46,2%)
5 (38,4%) |
|
|
|
|
Локализация ЯК/ UC localization: Проктит (n, %)/ Proctitis (n, %) Левосторонний колит (n, %)/ Left-sided colitis (n, %) Тотальный колит (n, %)/ Pancolitis (n, %) |
|
4 (4,8%)
19 (22,6%)
61 (72,6%) |
|
|
Примечания: БК – болезнь Крона, ЯК – язвенный колит, ЖКТ – желудочно-кишечный тракт.
Comments: IBD = inflammatory bowel disease; CD = Crohn’s disease; UC = ulcerative colitis; LQ = lower quartile; UQ = upper quartile.
При оценке гендерного состава среди пациентов с болезнью Крона мужчины встречались реже, в то время как сравнительная оценка тяжести течения ВЗК достоверных различий между группами не выявила.
Среди пациентов с жалобами на боли в суставах остеоартрит диагностирован у 37 (38,1%) пациентов, периферический артрит у 47 (48,5%) пациентов. У 13 (13,4%) пациентов не выявлено объективных признаков воспаления, нарушения функции суставов, установлена артралгия и рекомендовано динамическое наблюдение. Проведенный анализ позволил установить статистически значимые различия возраста пациентов с определенной артропатией (p<0,0001). Апостериорные сравнения показали, что по возрасту пациенты с остеоартритом были статистически значимо старше пациентов с периферическим артритом (p<0,016). На рисунке 1 представлены значения возраста пациентов с ВЗК с суставным синдромом.
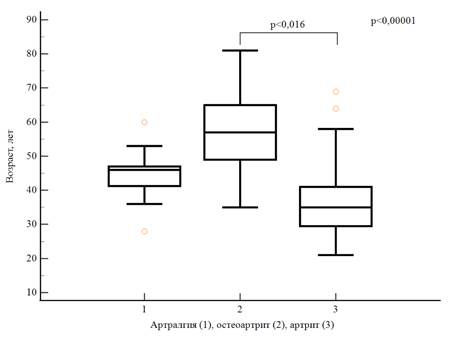
Рис. 1. Возраст пациентов с артропатиями при воспалительных заболеваниях кишечника
Оценка уровня цитокинов, PAD4, функциональной активности нейтрофилов и субпопуляционного состава лейкоцитов представлена в таблице 2.
Таблица 2
Показатели гуморальных и клеточных факторов иммунитета у пациентов с воспалительными заболеваниями кишечника и жалобами на боли в суставах
|
Показатели/ Characteristics |
БК/ CD (n=13) |
ЯК/ UC (n=84) |
Всего/ Total (n=97) |
p |
|
PAD4, нг/мл (Ме, ИИ)/ PAD4, ng/ml (Ме [LQ; UQ]) |
0,272 (0,071; 0,670) |
0,269 (0,159; 0,521) |
0,269 (0,145; 0,524) |
0,818 |
|
Фактор некроза опухоли α, пг/мл (Ме, ИИ)/ Tumor necrosis factor α, pg/ml (Ме [LQ; UQ]) |
3,793 (2,586; 26,538) |
2,457 (1,983; 3,944) |
2,672 (1,983; 4,138) |
0,045 |
|
Интерлейкин-10, пг/мл (Ме, ИИ)/ Interleukin -10, pg/ml (Ме [LQ; UQ]) |
3,857 (1,429; 5,714) |
3,429 (2,250; 5,625) |
3,429 (2,071; 5,625) |
0,685 |
|
Интерлейкин -17А, пг/мл (Ме, ИИ)/ Interleukin -17А, pg/ml (Ме [LQ; UQ]) |
0,555 (0,454; 0,808) |
0,606 (0,429; 0,959) |
0,606 (0,454; 0,947) |
0,464 |
|
Интерлейкин -23, пг/мл (Ме, ИИ)/ Interleukin -23, pg/ml (Ме [LQ; UQ]) |
6,14 (3,07; 16,4) |
1,991 (1,245; 5,228) |
2,365 (1,266; 6,037) |
0,009 |
|
Функциональная активность нейтрофилов/ Functional activity of neutrophils |
||||
|
Фагоцитоз нейтрофилов, активность, % (Ме, ИИ)/ Neutrophil phagocytosis, activity, % (Ме [LQ; UQ]) |
50,0 (32,25; 58,75) |
44,0 (34,0; 60,0) |
44,0 (34,0; 59,0) |
0,985 |
|
Фагоцитоз нейтрофилов, интенсивность, y.e. (Ме, ИИ)/ Neutrophil phagocytosis, intensity, units (Ме [LQ; UQ]) |
2,5 (1,508; 4,740) |
1,52 (0,9; 3,0) |
1,62 (0,94; 3,0) |
0,263 |
|
Фагоцитоз нейтрофилов, y.e. (Ме, ИИ)/ Neutrophil phagocytosis, CU (Ме [LQ; UQ]) |
5,05 (4,275; 7,175) |
3,6 (2,5; 5,4) |
3,9 (2,5; 5,4) |
0,079 |
|
НСТ-тест нейтрофилов спонтанный, активность, % (Ме, ИИ)/ Neutrophils NBT, spontaneous, activity, % (Ме [LQ; UQ]) |
23,0 (10,75; 41,50) |
20,0 (13,0; 32,0) |
20,0 (13,0; 32,0) |
0,834 |
|
НСТ-тест нейтрофилов индуцированный, активность, % (Ме, ИИ)/ Neutrophils NBT, induced, activity, % (Ме [LQ; UQ]) |
25,5 (14,0; 34,0) |
24,0 (14,0; 34,0) |
24,0 (14,0; 34,0) |
0,537 |
|
Лизосомальная активность нейтрофилов, y.e. (Ме, ИИ)/ Neutrophil lysosomal activity, CU (Ме [LQ; UQ]) |
304,5 (254,5; 326,0) |
288,0 (264,0; 322,0) |
291,0 (263,0; 325,0) |
0,717 |
|
Субпопуляционный состав лимфоцитов/ Subpopulation composition of lymphocytes |
||||
|
Т-лимфоциты (CD3+), % (Ме, ИИ)/ CD3+ cells, % (Ме [LQ; UQ]) |
85,21 (65,3; 88,39) |
77,98 (70,94; 83,32) |
78,67 (70,76; 84,79) |
0,674 |
|
Т-лимфоциты (CD3+), кл/мкл (Ме, ИИ)/ CD3+ cells, cells/μl (Ме [LQ; UQ]) |
1160,0 (600,5; 2606,5) |
1831,0 (1267,25; 2295,0) |
1776,0 (1244,5; 2293,0) |
0,344 |
|
Т-хелперы (CD3+CD4+), % (Ме, ИИ)/ CD3+CD4+ cells, % (Ме [LQ; UQ]) |
49,5 (33,8; 54,9) |
45,81 (37,51; 53,87) |
45,95 (36,78; 53,66) |
0,875 |
|
Т-хелперы (CD3+CD4+), кл/мкл (Ме, ИИ)/ CD3+CD4+ cells, cells/μl (Ме [LQ; UQ]) |
663,0 (342,5; 1552,5) |
899,5 (703,5; 1387,0) |
890 (681,5; 1372) |
0,275 |
|
Т-цитотоксические лимфоциты (CD3+CD8+), % (Ме, ИИ)/ CD3+CD8+ cells, % (Ме [LQ; UQ]) |
27,4 (23,73; 42,60) |
29,2 (22,1; 35,0) |
28,95 (22,16; 35,51) |
0,813 |
|
Т-цитотоксические лимфоциты (CD3+CD8+), кл/мкл (Ме, ИИ)/ CD3+CD8+ cells, cells/μl (Ме [LQ; UQ]) |
460,0 (232,0; 1099,0) |
640,5 (485,3; 869,3) |
635,0 (457,0; 891,0) |
0,563 |
|
Т-NK-лимфоциты (CD3+CD56+), % (Ме, ИИ)/ CD3+CD56+ cells, % (Ме [LQ; UQ]) |
5,8 (3,04; 17,31) |
4,36 (2,37; 7,60) |
4,8 (2,45; 8,05) |
0,357 |
|
Т-NK-лимфоциты (CD3+CD56+), кл/мкл (Ме, ИИ)/ CD3+CD56+ cells, cells/μl (Ме [LQ; UQ]) |
60,0 (39,5; 196,5) |
103,0 (29,75; 201,25) |
102,0 (32,0; 200,5) |
0,906 |
|
NK-лимфоциты (CD3-CD56+), % (Ме, ИИ)/ CD3-CD56+ cells, % (Ме [LQ; UQ]) |
4,38 (3,60; 6,24) |
5,68 (2,73; 10,29) |
5,6 (2,8; 9,0) |
0,617 |
|
NK-лимфоциты (CD3-CD56+), кл/мкл (Ме, ИИ)/ CD3-CD56+ cells, cells/μl (Ме [LQ; UQ]) |
66,0 (38,0; 166,0) |
126,0 (46,3; 243,3) |
122,0 (46,5; 232,5) |
0,423 |
|
В-лимфоциты (CD19+), % (Ме, ИИ)/ CD19+ cells, % (Ме [LQ; UQ]) |
7,5 (4,7; 27,7) |
11,1 (5,9; 18,4) |
11,04 (5,84; 18,9) |
0,958 |
|
В-лимфоциты (CD19+), кл/мкл (Ме, ИИ)/ CD19+ cells, cells/μl (Ме [LQ; UQ]) |
146,0 (45,0; 754,5) |
217,5 (111,5; 450,5) |
205,0 (107; 447) |
0,47 |
Концентрация ИЛ-10 в сыворотке крови значимо не различалась у пациентов с различными вариантами поражения суставов. Однако среди пациентов с вовлечением более трех суставов были выявлены статистически значимо меньшие значения концентрации сывороточного ИЛ-10 (рис. 2).
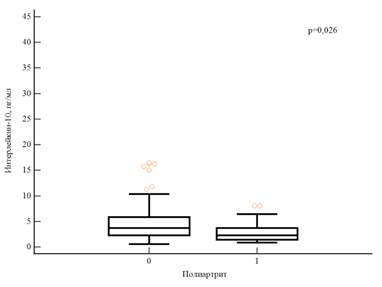
Рис. 2. Концентрация ИЛ-10 в сыворотке крови у пациентов с воспалительными заболеваниями кишечника в зависимости от наличия полиартрита
С целью изучения потенциальной диагностической эффективности сывороточной концентрации ИЛ-10 в отношении выявления полиартрита у пациентов с ВЗК был проведен ROC-анализ, результаты которого представлены на рисунке 3.
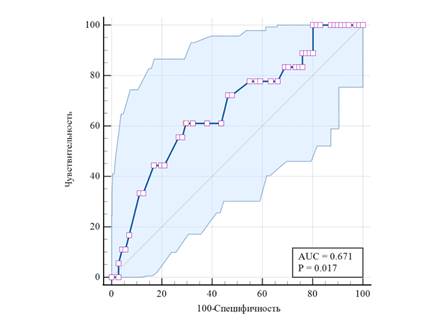
Рис. 3. ROC-кривая диагностической эффективности показателя ИЛ-10 при наличии полиартрита у пациентов с воспалительными заболеваниями кишечника
Пороговое значение ИЛ-10 ≤2,714 пг/мл позволяло диагностировать полиартрит с чувствительностью 61,1% и специфичностью 70,4% (индекс Юдена 0.3153; PPV 34,4; NPV 87,7). По данным логистического регрессионного анализа, снижение ИЛ-10 ≤2,714 пг/мл ассоциировалось с ОШ наличия полиартрита 3,903 (95% ДИ 1,306-11,664; p=0,0148) независимо от пола, возраста и варианта ВЗК (ЯК или БК).
Распространенность артрита снижается с возрастом у пациентов с ВЗК, что не противоречит полученным данным, где пациенты с периферическим артритом были значимо младше [1]. Если говорить о роли участия врожденного иммунитета в патогенезе спондилоартритов, то в настоящее время нейтрофилы и NETs являются ключевыми источниками IL-1β и IL-17, играющими важную роль в хронизации воспаления и остеогенезе при АС [9]. РНК-секвенирование на модели экспериментального спондилоартрита показало, что гены, связанные с функцией нейтрофилов и образованием NETs, были одними из самых активированных [10]. Кроме того, нейтрофилы были идентифицированы как тип клеток с наибольшей экспрессией IL-17 в биоптатах апофизарных суставов больных АС. В то же время модели на животных продемонстрировали, что IL-1β может активировать остеокласты, резорбирующие кость, и индуцировать разрушение суставов, в то время как повышенная экспрессия IL-1β была обнаружена в синовиальной оболочке пациентов со спондилоартритом [9]. В проведенном исследовании не было выявлено взаимосвязей между PAD4 и показателями кислородзависимого метаболизма нейтрофилов. Можно предположить, что нейтрофилы и NETs участвуют в активации других иммунных и структурных клеток, повышая выработку провоспалительных цитокинов и усиливая воспаление не только в кишечнике, но и в периферических суставах. Провоспалительные цитокины, в свою очередь, могут индуцировать высокие уровни маркеров окислительного стресса, что может быть связано с высвобождением NETs. Таким образом, в воспалительном ответе при артрите у пациентов с ВЗК могут участвовать оба пути – высвобождение NET и секреция провоспалительных цитокинов нейтрофилами, которые по принципу положительной обратной связи вызывают высвобождение NETs.
Роль ИЛ-10 в патогенезе ВЗК убедительно доказана. В настоящем исследовании выявлено снижение концентрации ИЛ-10 в крови у пациентов с вовлечением более 3 суставов в артропатии при ВЗК. Получены данные о корреляции полиморфизмов ИЛ-10, ИЛ-10Rα и ИЛ-10Rβ с ранним началом колита у пациентов. GWAS дополнительно выявили важную роль оси ИЛ-10 в развитии ВЗК как у мышей, так и у людей [11; 12]. Сходным образом ИЛ-10 способствует ослаблению экспериментального артрита, предположительно, влияя на баланс между клетками Th-17 и Treg-клетками [13]. ИЛ-10 является мощным иммуномодулирующим цитокином, концентрация которого повышена как в сыворотке, так и в синовиальной жидкости пациентов с ревматоидным артритом. In vitro нейтрализация ИЛ-10 в культурах синовиальных мембран при РА приводила к увеличению экспрессии ФНО-α и ИЛ-1β [14].
Переход синовиальных макрофагов между провоспалительным и противовоспалительным фенотипом может играть ключевую роль в построении внутрисуставного микроокружения. Провоспалительный каскад, индуцируемый ФНО-α, ИЛ-1β и ИЛ-6, тесно связан с макрофагами фенотипа M1, что приводит к продукции прохондролитических медиаторов. Однако ИЛ-10, хемокин CCL-18, инсулиноподобный фактор роста (IGF) и трансформирующий фактор роста (TGF) тесно связаны с макрофагами M2, что приводит к защите хряща и ускорению регенерации. Исследования показывают, что остеоартрит в основном возникает в результате активации врожденного иммунного ответа, индуцированного макрофагами, значительную долю которых составляет фенотип M1. Показано, что ИЛ-10 подавляет инфильтрацию и активацию нейтрофилов в синовиальной оболочке благодаря переходу в сторону М2. У пациентов с остеоартритом ИЛ-10 уменьшает количество специфических рецепторов для ФНО-α и влияние ФНО-α на фибробласты путем подавления PEG2, COX2 и PLA2 и, модулируя пути митохондриального апоптоза, может ингибировать апоптоз хондроцитов [15].
В настоящей работе на основании регрессионного анализа установлено, что уровень ИЛ-10, независимо от пола, возраста и варианта ВЗК, является фактором, ассоциированным с полиартритом любой этиологии. Количественная оценка ИЛ-10 имеет потенциал в качестве вспомогательного сывороточного маркера для быстрой и доступной диагностики артропатий у пациентов с ВЗК.
Основным ограничением настоящего исследования был небольшой размер выборки, что требует дальнейших исследований с большим числом пациентов.
Заключение. Пациенты с ВЗК и периферическим артритом были более молодого возраста. Снижение концентрации ИЛ-10 ≤2,714 пг/мл позволяло диагностировать полиартрит с чувствительностью 61,1% и специфичностью 70,4%.
Библиографическая ссылка
Хусаинова Г.М., Абрамовских О.С., Долгушина А.И., Генкель В.В., Никушкина К.В. ИНТЕРЛЕЙКИН-10 КАК МАРКЕР ПОЛИАРТРИТА У ПАЦИЕНТОВ С ВОСПАЛИТЕЛЬНЫМИ ЗАБОЛЕВАНИЯМИ КИШЕЧНИКА // Современные проблемы науки и образования. 2023. № 5. ;URL: https://science-education.ru/ru/article/view?id=32956 (дата обращения: 29.01.2026).
DOI: https://doi.org/10.17513/spno.32956



