В структуре заболеваний сердечно-сосудистой системы значительную долю составляет ишемическая болезнь сердца (ИБС). В пожилом возрасте ИБС часто сочетается с другими заболеваниями.
К числу широко распространенных патологических состояний относятся нарушения дыхания во сне (НДС). Среди всех нарушений дыхания во сне львиную долю составляет обструктивное апноэ сна (ОАС). Это состояние встречается у 7% взрослого населения, а у терапевтических больных составляет 15% и нарастает с возрастом еще больше, не имея зависимости от других факторов риска [1]. Риск сердечно-сосудистых событий увеличивается в 2,04 раза, инсульта – в 2,15 раза, смертности от всех причин – в 1,54 раза при отсутствии лечения обструктивного апноэ сна, преимущественно тяжелой степени тяжести [2].
У мужчин синдром обструктивного апноэ сне (СОАС) встречается в 1,5–3 раза чаще по сравнению с женщинами. С возрастом эта разница в заболеваемости сглаживается, так как менопауза выступает предиктором развития СОАС. У каждой второй женщины в постменопаузе встречаются проблемы со сном, одной из которых являются нарушения дыхания во сне. В молодом возрасте эти изменения наблюдаются только у 10–15% женщин [3].
Нарушения дыхания во сне также оказывают влияние на возникновение желудочковых аритмий у женщин с ИБС в постменопаузальном периоде. Апноэ сна увеличивает вероятность развития желудочковых аритмий высоких градаций в 2,5 раза, а полиморфной парной желудочковой экстрасистолы – в 7 раз [4]. Морфологические изменения миокарда неразрывны с нарушением его электрофизиологических характеристик. У женщин с артериальной гипертензией суточный ритм «non dipper» рассматривается как самый неблагоприятный, увеличивающий шанс развития жизнеугрожающих желудочковых аритмий в 2,04 раза (ДИ=1,8–12,29; р<0,05) [5, с. 101].
К числу значимых, распространенных аритмий относится и фибрилляция предсердий (ФП). В мире зарегистрировано примерно 33 млн пациентов с ФП, и ежегодно выявляется порядка 5 млн новых случаев данной аритмии [6].
У лиц с ФП нарушения дыхания во сне регистрируются в 3–5 раз чаще, чем в общей популяции. Отмечается и обратная зависимость: распространенность ФП среди лиц с ОАС составляет от 32 до 48% [7].
Нарушения дыхания во сне и ФП часто сочетаются. В сердечно-сосудистой системе создаются условия, способствующие развитию электрофизиологических нарушений. Факторами, провоцирующими возникновение ФП, являются повышение тонуса симпатической нервной системы, системное воспаление, гипоксия, снижение внутригрудного давления, окислительный стресс. Электрическое и структурное ремоделирование предсердий также могут инициировать ФП [8]. При этом большая часть исследований проводилась на мужчинах или смешанной группе.
Целью нашего исследования было изучить влияние нарушений дыхания во сне на возникновение рецидивов фибрилляции предсердий у женщин с ишемической болезнью сердца в постменопаузе.
Материалы и методы исследования
В исследовании приняли участие 88 женщин, находящихся в постменопаузе, с ИБС и пароксизмальной формой ФП. Диагноз ИБС подтверждался: данными анамнеза, клиникой, результатами коронароангиографии и нагрузочных проб, документированным перенесенным ИМ. Пароксизмальная ФП подтверждалась данными ЭКГ, ХМ ЭКГ, выписными эпикризами.
Критериями исключения из исследования были:
– острые формы ИБС;
– острое нарушение мозгового кровообращения;
– острые состояния или обострение хронических заболеваний;
– сахарный диабет;
– заболевания щитовидной железы;
– онкологические заболевания;
– дыхательная, почечная, печеночная недостаточности, сердечная недостаточность IIБ и III стадии;
– пациентки с атриовентрикулярными блокадами, блокадами ножек пучка Гиса, синдромом слабости синусового узла;
– отказ от участия в исследовании.
За исследуемыми в течение 6 месяцев проводилось наблюдение: ежемесячно совершался телефонный звонок. Затем пациентки были разделены на 2 группы: I – женщины, у которых отсутствовали пароксизмы ФП в течение 6 месяцев наблюдения (n=38); II – которые имели 1 и более пароксизм данной аритмии за этот период времени (n=50). Клиническая характеристика пациенток представлена в таблице 1.
Таблица 1
Клиническая характеристика пациенток (M ±SD); (Me (25%; 75%))
|
Показатели |
I группа (n=38) |
II группа (n=50) |
|
Средний возраст, лет |
70,1±8,9 |
68,4±7,8 |
|
Ожирение I–II степени, n (%) |
14 (36,8) |
20 (40) |
|
Длительность постменопаузы, лет |
15,2 (10;21) |
14,4 (9;19) |
|
Инфаркт миокарда в анамнезе, n (%) |
15 (39,5) |
19 (38) |
|
Стабильная стенокардия напряжения II–III ФК, n (%) |
23 (60,5) |
31 (62) |
|
АГ 1–2-й степени, n (%) |
36 (94,7) |
48 (96) |
Всем пациенткам проводилось респираторное мониторирование на аппарате SomnoCheck (Weinmann, Германия). Исследование выполнялось на синусовом ритме. Для оценки степени тяжести НДС использовался индекс апноэ/гипопноэ (ИАГ). ИАГ – это число эпизодов апноэ и гипопноэ, продолжительность которых составляет 10 секунд и более в течение часа сна. Апноэ – это полное отсутствие ороназального потока (снижение амплитуды более 90% от исходной), а гипопноэ – снижение амплитуды ротоносового потока более 30% от исходных значений, сопровождающееся снижением сатурации артериальной крови на 3% и более. Норма ИАГ – менее 5 эпизодов/час. Легкая степень соответствовала показателю ИАГ ≥5 и < 15, средняя ≥15 и < 30; тяжелая ≥30 в час.
С помощью пакета программ STATISTICA 10,0 проводили статистическую обработку данных. При нормальном распределении числовые значения представляли в виде среднего значения ± среднеквадратичное отклонение (M±SD), при распределении, отличном от нормального, – в виде медианы ± 25-й и 75-й процентили (Me (25-75%)). Различия считались достоверными при р<0,05. Оценка значимости различий между группами производилась при помощи критерия χ2, χ2 с поправкой Йетса или двустороннего критерия Фишера. Влияние фактора анализировалось путем расчета отношения шансов (OR) и его доверительного интервала (95% ДИ).
Результаты исследования и их обсуждение
Результаты проведенного респираторного мониторирования позволили выявить женщин с нарушениями дыхания во сне в обеих группах. Всех пациенток разделили на две подгруппы: «НДС–» – без нарушений дыхания во сне (ИАГ <5 эпизодов за час сна); «НДС+» – с нарушениями дыхания во сне (ИАГ >5 эпизодов за час сна). В соответствии с выявленными нарушениями дыхания во сне распределение пациенток представлено в таблице 2.
Таблица 2
Распределение пациенток I и II группы в зависимости от наличия НДС
|
Подгруппы |
I группа (n=38) |
II группа (n=50) |
||
|
Абс. значение |
% |
Абс. значение |
% |
|
|
НДС + |
18 |
47,4 |
38 |
76 |
|
НДС– |
20 |
52,6 |
12 |
24 |
Обструктивное апноэ сна выявлено у 18 пациенток I группы и 38 женщин II группы. Это говорит о том, что 76% пациентов, имеющих рецидивы ФП, страдали нарушениями дыхания во сне. Во II группе таких пациентов было на 28,6% меньше (χ²= 7,65; р=0,006).
Затем было выполнено распределение больных по степени тяжести нарушений дыхания во сне в каждой анализируемой группе. Полученные данные представлены на рисунках 1 и 2.
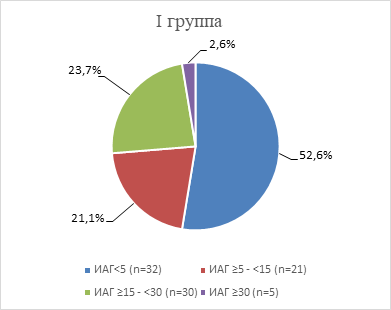
Рис. 1. Степень тяжести НДС в I группе
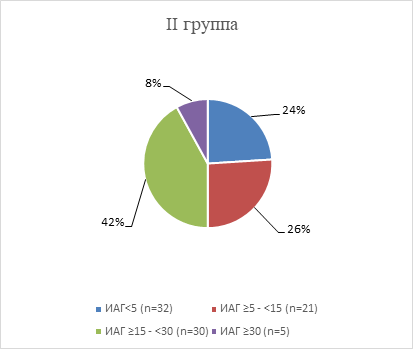
Рис. 2. Степень тяжести НДС во II группе
Согласно полученным результатам, в I группе больше половины женщин (52,6%) не имели обструктивного апноэ сна. А среди пациенток, имеющих НДС, практически равнозначно встречалась легкая (21,1%) и средняя (23,7%) степень тяжести. Легкая степень ОАС регистрировалась на 18,5% чаще, а средняя выявлялась на 21,1% чаще, чем тяжелая (р<0,05 по двустороннему критерию Фишера).
76% женщин II группы имели нарушения дыхания во сне. Почти половина в этой подгруппе (42%) имели среднюю степень тяжести апноэ сна. Средняя степень ОАС регистрировалась на 16% чаще, чем легкая степень тяжести нарушений дыхания во сне (χ²=2,86; р=0,09).
При сравнении результатов между группами было выявлено, что пациентки с легкой степенью апноэ сна в I группе (21,1%) и во II группе (26%) регистрировались без значимых различий (р>0,05). Среднюю степень тяжести чаще (на 18,3%) имели женщины с рецидивами аритмии, но различия были статистически незначимы (χ² с поправкой Йетса =2,46; р=0,12). Пациентки, имеющие среднюю или тяжелую степень НДС, достоверно чаще (на 23,7%) встречались в группе женщин, которые имели хотя бы 1 пароксизм ФП за 6 месяцев наблюдения (χ² =5,06; р=0,03).
С учетом полученных результатов был произведен расчет шансов развития повторных пароксизмов (рецидивов ФП) в зависимости от наличия нарушений дыхания во сне и их степени тяжести (табл. 3).
Таблица 3
Отношение шансов развития пароксизмов ФП в течение 6 месяцев наблюдения
|
Показатели |
Развитие рецидивов ФП |
||
|
OR |
95% ДИ |
р |
|
|
ИАГ<5 |
3,52 |
1,417–8,735 |
p*<0,05 |
|
ИАГ ≥5 – <15 |
1,32 |
0,48–1,359 |
p€>0,05 |
|
ИАГ ≥15 – <30 |
2,33 |
0,92–5,95 |
p*>0,05 |
|
ИАГ ≥30 |
3,2 |
0,35–30,03 |
p#>0,05 |
|
ИАГ ≥15 – <30 и ИАГ ≥30 |
2,8 |
1,13–6,96 |
p*<0,05 |
OR – отношение шансов; ДИ – доверительный интервал; p*– критерий χ²; € - χ² с поправкой Йетса; p# – двусторонний критерий Фишера.
Расчет показал, что вероятность развития рецидивов ФП в течение 6 месяцев наблюдения у женщин с ИБС в постменопаузальном периоде в 3,5 раза выше при наличии нарушений дыхания во сне. При этом у пациенток со средней и тяжелой степенью апноэ сна шансы развития рецидивов данной аритмии были в 2,8 раза выше.
Несомненно, НДС повышают риск возникновения ФП. Показательными являются данные группы G. Traaen и соавт. (2019), проспективно выполнивших скрининговую полисомнографию (ПСГ) у 579 пациентов с пароксизмальной ФП. Диагноз ОАС был подтвержден у 479 (82,7%) пациентов, среди которых доля апноэ средней и тяжелой степеней составила 50% [9]. Однако исследование было выполнено преимущественно на мужской выборке. Оно включало 157 женщин (27,1%) и 422 мужчины (72,9%).
Авторы показали, что увеличение ИАГ на 10 стандартных отклонениях приводит к возрастанию риска развития сердечно-сосудистых заболеваний на 17% [10]. В исследовании Г.Г. Арутюняна (2022) обструктивные нарушения дыхания во сне были выявлены у 56,7% пациентов. Среди них доля ОАС легкой степени тяжести составила 35,5%, а средней и тяжелой – 40,9% и 23,6% соответственно. Однако данное исследование выполнено на группе пациентов с ФП, перенесших катетерную абляцию легочных вен. К тому же оно выполнено на смешанной популяции, в которой 50,5% пациентов составили мужчины. Также в исследовании было установлено, что частота рецидивов ФП после катетерной абляции в группе пациентов с проведением СИПАП-терапии была достоверно меньше при сравнении с группой контроля (17,1% и 52,5%; p=0,003) в сроки наблюдения 12 месяцев [11, с. 60–62].
Определено, что риск рецидива ФП после катетерной абляции у больных СОАС был выше на 31%, чем у пациентов без нарушений дыхания во сне (ОR=1,31). У пациентов, не получающих СИПАП-терапию, этот риск увеличивался на 57% (ОR=1,57). При этом вероятность рецидива ФП у больных без обструктивного апноэ сна и у пациентов с апноэ на фоне СИПАП-терапии достоверно не различались (ОR=1,25, р=0,59). Также было установлено, что риск развития пароксизма ФП возрастал после остановки дыхания [12].
По результатам многофакторного анализа таких данных, как пол, возраст, вес, сопутствующая АГ, проводимая СИПАП-терапия, длительность анамнеза ФП, достоверными предикторами рецидива пароксизма ФП у пациентов с пароксизмальной ФП, перенесших катетерную абляцию легочных вен, и установленной ОАС являлись наличие АГ и некорригированного ОАС. Своевременно начатая СИПАП-терапия обструктивных нарушений дыхания во сне позволяет снизить риск рецидивирования ФП после проведенной катетерой абляции до 46% (ОR=0,1; 95% ДИ=0,02–0,46). Скоординированная работа врачей и пациентов является очень важной составляющей для улучшения клинической эффективности катетерного лечения ФП [11, с. 77–79].
В литературе имеются данные, что при любом способе восстановления ритма в 32% случаев у больных происходили рецидивы ФП, если они имели синдром обструктивного апноэ сна и не получали СИПАП-терапию. У пациентов, которым проводилось лечение по поводу СОАС, частота рецидивов составляла всего 21% [13]. Это подтверждает значимость обструктивных нарушений дыхания во сне в рецидивировании ФП и определяет их как фактор, требующий своевременного проведения лечебных мероприятий. В другой работе было определено, что у пациентов с СОАС и ФП, которым не проводилась СИПАП-терапия, повторные пароксизмы регистрировались в 82% случаев в течение года. При этом эффективная СИПАП-терапия апноэ сна уменьшала количество рецидивов в 2 раза [14].
Заключение. У 76% женщин с ИБС и пароксизмальной ФП, имеющих рецидивы аритмии в течение 6 месяцев, выявлены нарушения дыхания во сне. Вероятность развития рецидивов ФП в течение 6 месяцев наблюдения у женщин с ИБС в постменопаузальном периоде в 3,5 раза выше при наличии нарушений дыхания во сне. При этом у пациенток со средней и тяжелой степенью апноэ сна шансы развития рецидивов данной аритмии были в 2,8 раза выше. Необходимо своевременно выявлять нарушения дыхания во сне у женщин с ИБС и пароксизмальной ФП.
Библиографическая ссылка
Царёва В.М., Осипова М.С. РОЛЬ НАРУШЕНИЙ ДЫХАНИЯ ВО СНЕ В РЕЦИДИВИРОВАНИИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ У ЖЕНЩИН С ИШЕМИЧЕСКОЙ БОЛЕЗНЬЮ СЕРДЦА // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32911 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32911



