Рак молочной железы (РМЖ) – распространенное заболевание, являющееся одной из ведущих причин смертности среди женского населения от злокачественных новообразований, на 2020 год в мире было зарегистрировано 2,26 млн случаев [1]. РМЖ является гетерогенным заболеванием; в соответствии с молекулярными особенностями выделяют следующие подтипы: люминальный A, люминальный B, сверхэкспрессирующий HER2, тройной негативный рак молочной железы (ТНРМЖ) [2]. Люминальный подтип А характеризуется экспрессией генов, связанных с рецепторами эстрогена и прогестерона, однако в данных клетках отсутствует рецептор эпидермального фактора роста 2-го типа (Hеr2/neu). В клетках РМЖ, относящихся к люминальному подтипу B, присутствуют все три описанных выше рецептора (эстрогена, прогестерона, Her2/neu). К третьему подтипу – HER2+ относят клетки РМЖ, в которых наблюдается сверхэкспрессия Hеr2/neu и отсутствуют рецепторы эстрогена и прогестерона [3]. ТНРМЖ характеризуется отсутствием высоких уровней экспрессии генов рецепторов эстрогена, прогестерона и Hеr2/neu, однако демонстрирует сверхэкспрессию генов, связанных с пролиферацией. Гистологически ТНРМЖ обычно имеет высокую степень злокачественности, а также характеризуется агрессивным течением, отсутствием реакции на гормонотерапию и препараты к рецепторам эпидермального фактора роста 2-го типа (трастузумаб), низкой безрецидивной и общей выживаемостью [2].
Благодаря эпидемиологическим исследованиям были выявлены основные факторы риска развития ТНРМЖ. Так, было определено, что поздние первые роды (старше 30 лет) [4], раннее наступление менопаузы (до 50 лет) [5], несбалансированное питание (обилие животных жиров), низкая физическая активность и ожирение влияют на формирование и развитие ТНРМЖ [6]. Помимо внешних факторов, обусловливающих высокую вероятность заболевания ТНРМЖ, важную роль играют молекулярные и генетические изменения в организме. Установлено, что около 10% всех случаев возникновения РМЖ, в том числе и ТНРМЖ, связаны с генетической предрасположенностью. Наиболее распространенные мутации зародышевой линии возникают в генах BRCA1 и BRCA2, PALB2, RAD51 [7]. Несмотря на наличие стандартных панелей для определения мутаций в генах-кандидатах, ведется поиск новых терапевтических мишеней [8]. Одной из таких перспективных мишеней является сигнальный путь Wnt, активация которого, как было показано в ряде исследований, связана с онкогенезом ТНРМЖ, в том числе с формированием у клеток стволовых свойств, проявлением ими повышенной миграционной способности, а также развитием химиорезистентности [9, 10]. В данной работе исследовали влияние ингибитора Wnt-пути XAV-939 на динамику роста опухолевых узлов на мышиных опухолевых моделях ТНРМЖ.
Материалы и методы исследования
Опухолевый материал
Для изучения влияния исследуемого вещества использовали перевиваемый ксенотрансплантат ТНРМЖ, полученный в ФГБУ «НМИЦ онкологии» Минздрава России. Первичный опухолевый материал для создания перевиваемого ксенотрансплантата был получен от пациентки с диагнозом ТНРМЖ. Также от пациентки было получено письменное согласие на передачу биологического материала. Проведение исследования было одобрено локальной биоэтической комиссией ФГБУ «НМИЦ онкологии» Минздрава России.
Создание подкожной ксеногенной модели ТНРМЖ человека
Опухолевый материал, полученный от пациента, был доставлен в SPF-виварий ФГБУ «НМИЦ онкологии» Минздрава России, после чего разделен на равные фрагменты размером 3х3х3 мм и имплантирован подкожно иммунодефицитным мышам для получения 1-й генерации ксенотрансплантата ТНРМЖ. Для последующих генераций опухолевые узлы перевивались от предыдущей генерации к последующей вышеуказанным способом. В данной работе использовали четвертую генерацию ксенотрансплантатов ввиду медленного роста опухолевых узлов в предыдущих генерациях.
Животные-реципиенты
Для данной работы были использованы 40 самок иммунодефицитных мышей линии Balb/c Nude. Для эксперимента мыши были разделены на 4 группы (по 10 животных в каждой): контрольная группа; животные, принимавшие XAV-939; мыши, принимавшие препарат сравнения (паклитаксел); группа с применением комбинации исследуемых препаратов.
Исследуемые вещества и дозировки
Ингибитор Wnt-пути — XAV-939 вводили перорально в дозе 25 мг/кг. Вещество растворяли в стерильной дистиллированной воде. В качестве препарата сравнения использовали паклитаксел в дозе 10 мг/кг. Вещество вводили внутрибрюшинно, растворяли в физиологическом растворе. Режим введения веществ – 2 раза в неделю, в течение 28 дней. Введение веществ начинали при достижении опухолевых узлов в среднем в каждой группе 100±10 мм3.
Анализ противоопухолевой эффективности
С момента начала введения веществ в течение 28 дней контролировали динамику роста опухолевых узлов в группах. Замеры опухолей животных-опухоленосителей осуществляли 2 раза в неделю.
Объем опухолевых узлов вычисляли по формуле:
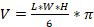 , где
, где
V – объем опухолевого узла; L – длина опухолевого узла; W – ширина опухолевого узла; H – высота опухолевого узла.
Для анализа эффективности исследуемых препаратов вычисляли индекс прироста опухоли согласно формуле:
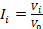 , где
, где
I – индекс прироста опухолевого узла; i – сутки эксперимента; V0 – объем опухоли в день начала лечения.
Также оценивали процент торможения роста опухоли (ТРО, %) согласно формуле:
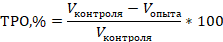
Статистический анализ
Для определения нормальности распределения данных использовали критерий Шапиро–Уилка. Для определения различий между группами ввиду нормального распределения использовали параметрический t-критерий Стьюдента.
Результаты исследования и их обсуждение
В ходе работы был определен объем опухолевых узлов в исследуемых группах. На момент окончания эксперимента наибольший средний объем опухолевых узлов отмечали в контрольной группе – 456,7±20,65 мм3. Наименьший объем опухолевых узлов отмечали в группе с комбинацией исследуемых препаратов – 286,9±10,1 мм3. Значимые отличия в экспериментальных группах в сравнении с контролем отмечали с 22-х суток эксперимента (группа с введением паклитаксела), с 15-х суток (группа с введением комбинации препаратов) и до конца эксперимента. Данные динамики роста опухолевых узлов отображены на рисунке 1, значения представлены в виде средних.
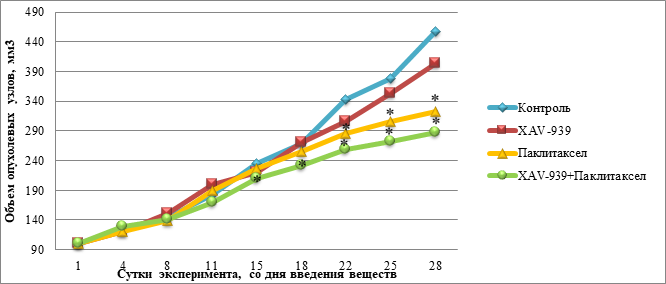
Рис. 1. Динамика роста опухолевых узлов в контрольной группе и в экспериментальных группах: «XAV-939», «Паклитаксел», «XAV-939 + паклитаксел»
Примечание: * – статистически значимые различия между экспериментальными группами «Паклитаксел», «XAV-939 + Паклитаксел» и контрольной группой по t-критерию Стьюдента (p<0,05).
При сравнении данных, характеризующих динамику изменений индекса прироста опухоли, значимых отличий экспериментальной группы (монотерапия XAV-939) от контроля выявлено не было. Динамика изменения индекса прироста опухоли в контрольной группе и в группе с введением XAV-939 представлена на рисунке 2.
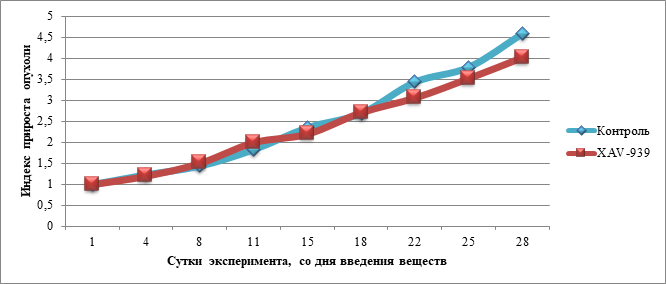
Рис. 2. Динамика изменения индекса прироста опухоли в контрольной группе и в группе с введением XAV-939
При анализе полученных данных выявлено, что индекс прироста опухоли в группе с введением паклитаксела был статистически значимо меньше, чем в контрольной группе, на 22-е, 25-е и 28-е сутки эксперимента. В данный период значения индекса прироста в группе с введением паклитаксела составили: 2,84±0,14; 3,04±0,15; 3,22±0,16 соответственно.
Динамика изменения индекса прироста опухоли в контрольной группе и в группе с введением паклитаксела представлена на рисунке 3.
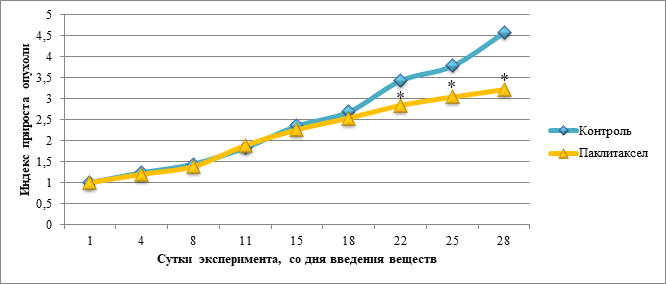
Рис. 3. Динамика изменения индекса прироста опухоли в контрольной группе и в группе с введением паклитаксела
Примечание: * – статистически значимые различия между экспериментальной группой «Паклитаксел» и контрольной группой по t-критерию Стьюдента (p<0,05).
При сравнении полученных данных было выявлено, что индекс прироста опухоли в группе с введением комбинации препаратов XAV-939 и паклитаксел статистически значимо меньше, чем в контрольной группе, начиная с 15-го дня эксперимента. В данный период значения индекса прироста в группе с введением комбинации препаратов составили: 2,099±0,045; 2,31±0,049; 2,59±0,050; 2,71±0,056; 2,86±0,05. Данные, характеризующие динамику изменения индекса прироста опухоли в контрольной группе и в группе с введением комбинации XAV-939 и паклитаксела, представлены на рисунке 4.
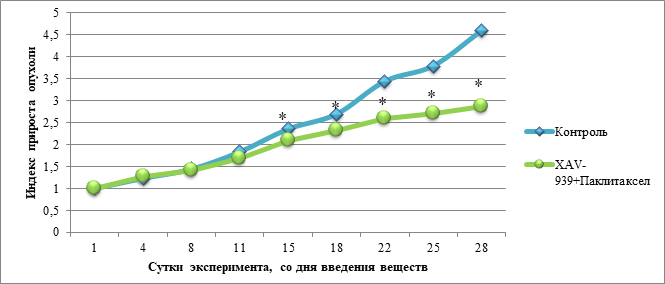
Рис. 4. Динамика изменения индекса прироста опухоли в контрольной группе и в группе с введением комбинации исследуемых препаратов (XAV-939 и паклитаксел)
Примечание: * – статистически значимые различия между экспериментальной группой «XAV-939 + паклитаксел» и контрольной группой по t-критерию Стьюдента (p<0,05).
При анализе полученных данных был определен коэффициент ТРО. Наибольшее значение ТРО отмечали в группе с введением комбинации препаратов XAV-939 и паклитаксел – оно составило 37,34%. Наименьшее значение ТРО отмечали в группе с введением XAV-939 – 11,97%. В группе с введением паклитаксела значение ТРО составило 29,6%. Значения ТРО представлены в гистограмме на рисунке 5.
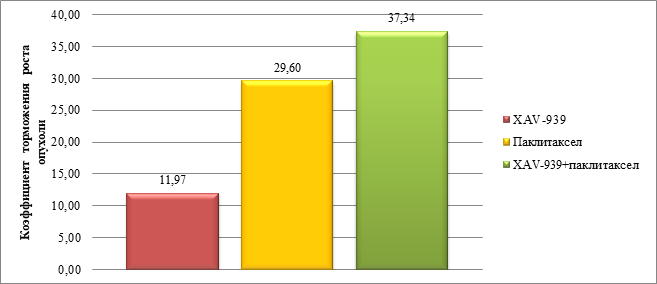
Рис. 5. Коэффициент торможения роста опухоли в экспериментальных группах: «XAV-939», «паклитаксел», «XAV-939 + паклитаксел»
В результате данной работы определили, что в монотерапии исследуемое вещество XAV-939 не проявляло противоопухолевой эффективности. В группе с введением паклитаксела в монотерапии отмечали снижение роста опухолевых узлов, их объемы значимо отличались от значений в контрольной группе. При анализе полученных данных, характеризующих одновременное воздействие двух исследуемых препаратов, отмечали, что XAV-939, не продемонстрировавший противоопухолевую активность в монотерапии, при комбинации с паклитакселом приводил к торможению роста опухолевых узлов, вероятно, усиливая эффективность последнего. При анализе литературы, посвященной исследованию эффективности ингибитора Wnt-пути XAV-939 [11–13], выявили согласованность данных других авторов с результатами, полученными в данной работе [14, 15]. Так, в исследовании R. Shome и S.S. Gosh (2021) было определено, что XAV-939 усиливал противоопухолевую эффективность лапатиниба в отношении клеточной линии тройной негативной аденокарциномы молочной железы человека MDA-MB-231 при исследовании in vitro [12]. При анализе работы D. Shetti с коллегами (2019) было выявлено, что при воздействии на клетки линии MDA-MB-231 паклитакселом и XAV-939 в монотерапии цитотоксическое действие было менее выражено, чем при комбинации данных препаратов. Эффективность данных веществ была определена с использованием МТТ-теста [13]. В работе A.E. Fazary с коллегами (2021) была проведена оценка цитотоксической эффективности XAV-939 и природного биофлавоноида гесперидина в отношении клеток гепатоцеллюлярной карциномы человека (HepG2) и тройной негативной аденокарциномы молочной железы человека MDA-MB-231 с использованием МТТ-теста. В ходе работы было определено, что XAV-939 проявлял большую цитотоксичность, чем гесперидин, кроме того, их комбинация в отношении ТНРМЖ обладала повышенной цитотоксичной эффективностью [14].
Принимая во внимания литературные данные, а также результаты, полученные в ходе нашего исследования, можно предположить, что применение ингибиторов сигнального пути Wnt, а именно XAV-939, в качестве элемента комбинированной терапии может представлять в будущем новый подход к лечению пациентов с ТНРМЖ.
Заключение
В результате данной работы было выявлено, что наибольшей эффективностью в отношении ксенотрансплантатов ТНРМЖ обладала комбинация препаратов XAV-939 и паклитаксел. В данной группе значимое отличие от контроля было отмечено на 15-е сутки эксперимента со дня введения тестируемых веществ. На основании полученных экспериментальных данных можно заключить, что тестируемое вещество является перспективным для дальнейшего изучения его противоопухолевых свойств в отношении ТНРМЖ в комбинации с препаратами стандартной терапии.
Библиографическая ссылка
Ляшенко И.С., Романова М.В., Гончарова А.С., Шатова Ю.С., Пржедецкий Ю.В., Позднякова В.В. ИЗУЧЕНИЕ ПРОТИВООПУХОЛЕВОГО ВЛИЯНИЯ ИНГИБИТОРА WNT-ПУТИ XAV-939 НА МОДЕЛИ ТРОЙНОГО НЕГАТИВНОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ IN VIVO // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32900 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32900



