Тщательное изучение применения антитромботических препаратов в клинической практике привело к заметному улучшению исходов у пациентов с сердечно-сосудистыми заболеваниями с одновременным возрастанием риска геморрагических осложнений. Наиболее сложную категорию представляют пациенты с множественными клиническими факторами риска, у которых во время двойной и тройной антитромботической терапии после чрескожного коронарного вмешательства часто возникают как кровотечения, так и рецидивирующие ишемические события. Решения об оптимальном антитромботическом лечении у этих пациентов являются сложными и часто не подкрепляются четкими рекомендациями.
Целью обзора послужило обобщение современных российских и международных рекомендаций по применению антитромботических препаратов в сложных клинических ситуациях при кардиохирургических вмешательствах.
В обзор вошли современные рекомендации по вторичной профилактике сердечно-сосудистых заболеваний Российского кардиологического общества, Европейского общества кардиологов (ЕОК) и Американской кардиологической ассоциации / Американского колледжа кардиологов. Поиск литературных источников осуществлялся в следующих в базах данных: PubMed, РИНЦ и eLibrary – с использованием ключевых слов: «вторичная профилактика», «чрескожное кардиологическое вмешательство», «острый коронарный синдром», «кровотечения», «ацетилсалициловая кислота», «ингибиторы P2Y12», «двойная антитромбоцитарная терапия», «тройная антитромботическая терапия» в качестве поисковых запросов.
Использование ингибиторов P2Y12 при ЧКВ
Двойная антитромбоцитарная терапия (ДАТТ) стандартно применяется после чрескожного коронарного вмешательства (ЧКВ) для предотвращения коронарных тромботических осложнений [1–3]. Тикагрелор и прасугрел часто называют новыми ингибиторами P2Y12, поскольку они появились на рынке после внедрения клопидогрела и ДАТТ. Как прасугрел, так и тикагрелор снижают количество тромботических осложнений вследствие ингибирования тромбоцитов, что, в свою очередь, сопровождается повышенным риском кровотечения [4–7].
Ингибиторы P2Y12 проявляют свой антиагрегантный эффект посредством ингибирования рецепторов аденозиндифосфата тромбоцитов (АДФ), что предотвращает активацию рецепторного комплекса гликопротеидов IIb/IIIa и последующую активацию и агрегацию тромбоцитов.Сравнительные клинические исследования подтверждают достоинства тикагрелора и прасугрела перед клопидогрелом при лечении пациентов с ОКС [8, 9].
В исследовании ISAR-REACT 5 проводилось сравнение эффективности и безопасности применения прасугрела и тикагрелора при остром коронарном синдроме без подъема сегмента ST (ОКСбпST). Первичная конечная точка представляла собой сочетание сердечно-сосудистой смерти, инфаркта миокарда (ИМ) и инсульта и наблюдалась у 6,3% пациентов, принимавших прасугрел, по сравнению с 9,3% пациентов, принимавших тикагрелор (отношение рисков 1,36, 95%-ный доверительный интервал (ДИ) 1,09–1,70, p=0,006).Это было вызвано, в первую очередь, снижением случаев развития ИМ (3,7% для прасугрела против 4,8% для тикагрелора).Удивительно, но не было выявлено значительных различий в частоте больших кровотечений между прасугрелом и тикагрелором, что могло быть связано с некоторыми техническими ограничениями.Несмотря на эти ограничения, это исследование привело к тому, что ЕОК изменило рекомендацию класса IIb в пользу прасугрела, а не тикагрелора при лечении пациентов с ОКСбпST, готовящихся к ЧКВ [9].
Ранняя и поздняя стратегии
В условиях ОКСбпST оптимальные сроки назначения ингибиторов рецепторов P2Y12 остаются окончательно не ясными.Использование перорального ингибитора P2Y12 до коронарной ангиографии, когда анатомия коронарных артерий неизвестна, также называемое «ранняя стратегия», теоретически может снизить риск ишемии, пока пациенты ждут коронарной ангиографии [1, 8].Кроме того, за счет достижения достаточного подавления тромбоцитов во время проведения ЧКВ это может снизить риск периоперационных тромботических осложнений из-за повреждения сосудов и нарушения «реэндотелиализации» коронарных артерий [10].Тем не менее, ранняя стратегия также может увеличить риск кровотечения во время ЧКВ или коронарного шунтирования.
В условиях стабильной ИБС рекомендуется вводить нагрузочную дозу ингибитора P2Y12 перед ЧКВ, если известна анатомия коронарных артерий (например, выполнена коронарная ангиография) и принято решение о проведении вмешательства [11].При инфаркте миокарда с подъемом сегмента ST (ИМпST) введение P2Y12 должно происходить как можно раньше или, по крайней мере, во время ЧКВ [2, 4].При ОКСбпST можно рассмотреть возможность введения (или «претерапии») клопидогрела и тикагрелора, но руководства рекомендуют не использовать для ранней стратегии прасугрел из-за результатов исследования ACCOAST [12].
Продолжительность ДАТТ после ЧКВ
Как правило, после ЧКВ ДАТТ рекомендуется в течение не менее 6 и 12 месяцев для СИБС и ОКС соответственно [13].Более короткие сроки можно рассмотреть для пациентов с низким риском ишемии и высоким риском кровотечения, а более длительные – для пациентов с высоким риском ишемии и низким риском кровотечения. Важно отметить, что после публикации рекомендаций Американской кардиологической ассоциации / Американского колледжа кардиологов (AHA/ACC) по ДАТТ было проведено несколько клинических испытаний, оценивающих более короткую продолжительность ДАТТ после ЧКВ с установкой стента как в условиях ИБС, так и ОКС [14–16]. В целом, схемы и продолжительность ДАТТ с последующей монотерапией ингибитором P2Y12 широко менялись от испытания к испытанию.Продолжительность ДАТТ варьировала от 1 до 3 месяцев после ЧКВ с последующей монотерапией ингибитором P2Y12 в течение от 12 до 24 месяцев.Эти схемы сравнивали со стандартными методами лечения: ДАТТ в течение 6–12 месяцев после ЧКВ с последующей монотерапией аспирином.В целом, результаты этих исследований продемонстрировали сопоставимую ишемическую эффективность при снижении частоты кровотечений при монотерапии ингибитором P2Y12 по сравнению с ДАТТ (рис. 1).
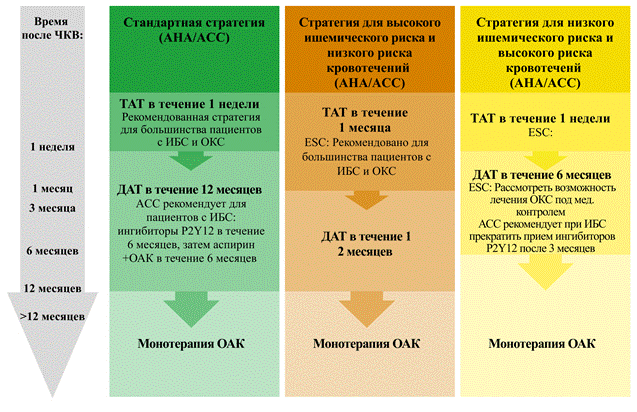
Рис. 1. Подходы к антитромботической терапии у пациентов с фибрилляцией предсердий, перенесших чрескожное коронарное вмешательство [17–19]:
ACC – Американский колледж кардиологии; AHA – Aмериканская кардиологическая ассоциация; ДАТ – двойная антитромботическая терапия;
ДАТТ – двойная антитромбоцитарная терапия; EОК – Eвропейское общество кардиологов; ИБС – ишемическая болезнь сердца; OAК – оральные антикоагулянты; ОКС – острый коронарный синдром; TAT – тройная антитромботическая терапия (OAК + ДАТТ);
ЧКВ – чрескожное коронарное вмешательство
Хотя это еще не включено в клинические рекомендации, для клиницистов разумно сократить продолжительность ДАТТ, особенно у пациентов с более высоким риском кровотечения или анамнезом предшествующих кровотечений во время приема ДАТТ.Однако при применении этих схем в клинической практике необходимо учитывать тип стента.
Однако есть некоторые доказательства того, что более длительные курсы ДАТТ, превышающие 12 месяцев, могут быть полезными.Продолжительность ДАТТ после ЧКВ может быть рассмотрена на срок до 30 месяцев.Этот подход продемонстрировал снижение риска инфаркта миокарда, но был сопряжен с повышенным риском кровотечений [20].Из-за этого трудно идентифицировать пациентов, которые могут быть наиболее подходящими для этой стратегии.Пациенты с критериями высокого риска потенциально могут получить пользу при пролонгации ДАТТ (ОКС при поступлении / ОКС в анамнезе, заболевание периферических артерий, сахарный диабет, дисфункция почек, курение сигарет, фракция выброса левого желудочка <30%, сердечная недостаточность (как со сниженной, так и с сохраненной фракцией выброса), повышенная сложность процедуры ЧКВ, диаметр стента <3 мм, использование венозного шунта при ЧКВ, высокая нагрузка на ИБС, стент старого поколения).Однако важно отметить, что доказательства применения расширенной ДАТТ получены в исследованиях, в которых использовались стенты более старшего поколения [21].Эти стенты имеют более высокий риск позднего тромбоза стента, поэтому преимущества удлиненной ДАТТ при установке новых стентов неизвестны. В конечном итоге подход к продолжительности ДАТТ после ЧКВ должен быть индивидуализирован на основе факторов риска ишемии и кровотечения пациента, которые могут быть оценены с использованием баллов ДАТТ и PRECISE-DAPT [1–4].
Смена препарата из группы ингибиторов P2Y12
Переход с тикагрелора на прасугрел или наоборот называют сменой терапии.При смене препарата необходимо учитывать несколько положений: время наступления события (например, дату установки стента), потенциальные лекарственные взаимодействия при комбинации препаратов и потенциальные требования к ударной дозе.Считается, что лекарственное взаимодействие не происходит при смене агентов в пределах одного и того же класса (например, клопидогрела на прасугрел), однако лекарственное взаимодействие может возникнуть при переключении между классами (например, тикагрелора на клопидогрел) [22].Благодаря быстрому смещению (3–5 дней) и обратимым свойствам связывания рецепторов тикагрелора деэскалация до клопидогрела вызывает прекращение ингибирования тромбоцитов при отмене тикагрелора, что может увеличить риск тромбоза стента.Таким образом, ударная доза клопидогрела обычно рекомендуется независимо от даты установки стента.При приеме прасугрела все еще существует возможность прекращения ингибирования тромбоцитов при деэскалации до клопидогрела, но это связано с необратимым ингибированием тромбоцитов прасугрелом и более длительной компенсацией [23].Для того чтобы клопидогрел проявил свои антиагрегантные свойства, необходимо производить новые тромбоциты, поэтому в этих условиях рекомендуется вводить ударную дозу клопидогрела в течение 30 дней после назначенного события [24].Эксперты выработали консенсусную рекомендацию, основанную на фармакодинамических свойствах препаратов и ранее опубликованной литературе (рис. 2).
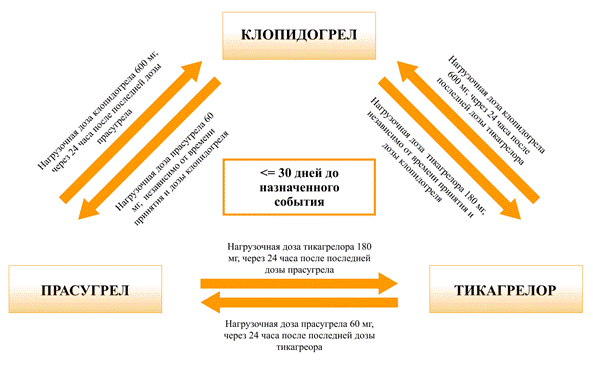
Рис. 2. Рекомендации по переходу между пероральными ингибиторами P2Y12
При использовании сильнодействующих ингибиторов P2Y12 (тикагрелор, прасугрел) наибольшие преимущества наблюдаются сразу после ЧКВ, когда риск повторных тромботических событий наиболее высок.Однако в фазе хронического лечения сохраняется более высокий риск кровотечения.При поддерживании профилактики тромботических событий на ранней стадии были предприняты усилия по снижению риска кровотечения в хронической фазе за счет деэскалации терапии ингибитором P2Y12.Деэскалация – это процесс перехода от мощного ингибитора P2Y12 к менее мощному препарату (например, клопидогрелу). Деэскалация ингибиторов P2Y12 под контролем исследования функции тромбоцитов является жизнеспособным вариантом и может рассматриваться для пациентов с повышенным риском кровотечения (например, при анемии, необходимости в ДАТТ плюс пероральная антикоагулянтная терапия, клинически значимом кровотечении при текущей терапии, социально-экономических факторах,побочных эффектах) [23].В настоящее время руководящие принципы не поддерживают конкретный тест на функцию тромбоцитов, и поэтому врачи ограничены любым тестом, доступным в их учреждении.
Антитромбоцитарная терапия в качестве вторичной профилактики
Как часть тромботического ответа агрегация тромбоцитов играет ключевую роль в разрушении бляшек, и, чтобы уменьшить возникновение этих событий, используются антиагреганты. Для вторичной профилактики инфаркта миокарда и смерти рекомендации ACC / AHA по ведению пациентов с ИБС рекомендуют лечение аспирином от 75 до 162 мг в день как можно дольше (класс Ia). У пациентов с противопоказаниями к применению аспирина разумной альтернативой является клопидогрел (класс Ib). Для некоторых пациентов из группы высокого риска рассматривают возможность лечения ДАТТ (аспирин от 75 до 162 мг + клопидогрел 75 мг в день) (класс IIb) [8]. Аналогичным образом Европейское общество кардиологов (ЕОК) рекомендует антитромботическую терапию аспирином от 75 до 100 мг в день у больных с ИМ в анамнезе или реваскуляризацией хронических коронарных синдромов, имеющих синусовый ритм (класс Ia). Альтернативный вариант: клопидогрел 75 мг в день для пациентов с непереносимостью аспирина (класс Ib) [11].
Антикоагулянтная терапия в качестве вторичной профилактики
Помимо аспирина в низких дозах, антикоагулянтная терапия может быть рассмотрена для пациентов с синусовым ритмом с умеренным и высоким риском ишемии и низким риском кровотечения. Руководства по стабильной ИБС и ОКСбпST рекомендуют добавлять низкую дозу ривароксабана (2,5 мг) два раза в день к аспирину у пациентов, перенесших ИМ более одного года назад, или у пациентов с заболеванием коронарных артерий, чтобы снизить риск ИМ, инсульта и сердечно-сосудистой смерти. Для пациентов с высоким риском ишемии это обозначено как рекомендация класса IIa и рекомендация класса IIb для пациентов с умеренным риском [1, 2, 6, 9, 11]. В настоящее время рекомендации ACC/AHA по ведению стабильной ИБС от 2014 г. не включают антикоагулянтную терапию как вариант, однако эти рекомендации были опубликованы до публикаций клинических испытаний по оценке антикоагулянтов для вторичной профилактики [9, 11]. Основываясь на результатах исследования COMPASS, антикоагулянтную терапию можно рассматривать как вторичную профилактику у пациентов со стабильным атеросклеротическим заболеванием сосудов с повышенным риском ишемии, как это принято в рекомендациях Европейского общества кардиологов (ЕОК) 2019 и 2020 гг.
Тройная антитромботическая терапия
Около 30% пациентов с фибрилляцией предсердий (ФП) также страдают ишемической болезнью сердца, также ФП отмечается у 3–12% пациентов, перенесших ЧКВ [25]. Важно отметить, что антитромботические стратегии при ФП и ЧКВ различны и не взаимозаменяемы из-за различий в физиологии тромба [26]. Пероральная антикоагулянтная терапия (ПОАК) является предпочтительной антитромботической терапией для предотвращения инсульта при фибрилляции предсердий, в то время как двойная антитромбоцитарная терапия (ДАТТ) остается стандартом лечения серьезных неблагоприятных сердечных событий и тромбоза стента после ЧКВ [13]. Тройная антитромботическая терапия (ТАТ) ранее считалась теоретически необходимой и эмпирически рекомендуемой для пациентов с ФП, подвергающихся ЧКВ [27, 28]. Эта комбинация ПОАК и ДАТТ, что, конечно, связано со значительным увеличением больших и малых кровотечений. Например, риск нефатального кровотечения при ТАТ в 4 раза выше, чем при монотерапии АВК, а риск внутричерепного кровоизлияния в 2 раза выше, чем при ДАТТ [29, 30].
С момента первой публикации испытаний, оценивающих ДАТ по сравнению с ТAT в 2013 году, несколько опубликованных клинических испытаний подтвердили, что ДAТ является предпочтительной антитромботической стратегией для большинства пациентов с ФП, подвергающихся ЧКВ.
Американская кардиологическая ассоциация / Американский колледж кардиологии (АНА/АСС) и Европейское общество кардиологов (ЕОК) недавно опубликовали обновленные заявления относительно TAT и ДAT (рис. 1). В целом, все отдают предпочтение ДAТ для большинства пациентов с ФП, перенесших ЧКВ. ТАТ рекомендуется пациентам в период после ЧКВ и во время госпитализации на срок до 1 недели. В то время было принято решение продолжить ТАТ продолжительностью до 30 дней в зависимости от оценки риска ишемии и кровотечения. У пациентов с высоким риском ишемии и низким риском кровотечения ТАТ может рассматриваться в течение первого месяца, а затем ДАТ в течение 6 (ИБС) – 12 (ОКС) месяцев. У пациентов с высоким риском кровотечения продолжительность ТАТ может быть такой же короткой, как пребывание в больнице, за которым следует ТАТ в течение 6 месяцев. После завершения ДAТ для вторичной профилактики рекомендуется монотерапия OAК. В таблице 4 приведены текущие рекомендации клинической практики, обновленные за последние 2 года.
Для пациентов без противопоказаний (например, митральный стеноз от умеренного до тяжелого, механический протез клапана) оральные антикоагулянты прямого действия предпочтительны перед ТАТ и ДAT.Эта рекомендация основана на нескольких клинических испытаниях, демонстрирующих лучшие профили безопасности по сравнению с АВК, в том числе при ДAT. В этом случае предпочтительным ингибитором P2Y12 является клопидогрел.По сравнению с тикагрелором и прасугрелом, применение клопидогрела было связано с меньшим числом кровотечений, и подавляющее большинство пациентов в клинических испытаниях по оценке ТАТ получали клопидогрел [31].Данные об использовании тикагрелора и прасугрела в этих условиях ограничены.
Антитромботическая терапия при транскатетерной имплантации аортального клапана (TAVI)
Антитромботическая терапия после TAVI представляет собой развивающуюся клиническую практику с момента ее внедрения. Первоначально в исследованиях, направленных на оценку технологии TAVI, использовалась ДАТТ. Причины, по которым ДАТТ была выбрана в качестве первоначальной антитромботической стратегии, включают предположение об аналогичных условиях кровотока (что и при использовании коронарных стентов). Однако современная литература оспаривает эту эмпирическую рекомендацию, поскольку она не была тщательно изучена и не применима к пациентам, нуждающимся в длительном приеме ОАК.
Руководства AHA/ACC по заболеваниям клапанов сердца от 2020 года рекомендуют низкие дозы аспирина – 75–100 мг в день – для пациентов, проходящих TAVI, при отсутствии других показаний для OAК (класс 2A). Они также предлагают добавление клопидогрела в течение 3–6 месяцев пациентам с низким риском кровотечения (класс 2B) [32]. В согласованном заявлении ЕОК (2021) предпочтение отдано однократной антитромбоцитарной терапии и OAК при отсутствии недавнего коронарного стентирования [33].
В рекомендациях ЕОК не отдается предпочтение ПОАК или антагонистам витамина К (АВК) после TAVI, и сравнительные данные в этом отношении ограничены. В клинической практике ПОАК продолжают очень часто использоваться для лечения пациентов с ФП, перенесших TAVI. Риск ишемических событий в ПОАК по сравнению с АВК требует дальнейшего изучения.
Таким образом, ESC рекомендует монотерапию ОАК пациентам с показанием к ОАК, подвергающимся TAVI. У тех пациентов, которые недавно перенесли коронарное стентирование, рекомендуется двойная терапия с использованием ОАК и антиагрегантов, как описано ранее, с последующей монотерапией ОАК для вторичной профилактики [34–37].
Антитромботическая терапия после MitraClip
Транскатетерная пластика митрального клапана (TMVr) с помощью устройства MitraClip показана для лечения как хронической первичной, так и вторичной MР. Среди исследований, посвященных оценке прибора MitraClip при TMVr, частота инсульта или ТИА наблюдалась у 4,4% пациентов [38]. Однако не существует научно обоснованных руководств по выбору или продолжительности антитромботических схем. Точно так же стандартная антитромботическая терапия до и во время процедуры не установлена, равно как и роль нагрузочных доз антиагрегантов перед имплантацией устройства. Пациенты, которые постоянно получают антиагрегантную терапию, обычно продолжают ее без перерывов во время процедуры [39, 40]. Пациентам, принимающим пероральные антикоагулянты, следует вести такое же лечение, как и при других чрескожных вмешательствах, которые обычно представляют собой короткий период прерывания антикоагуляции для предотвращения кровотечения. Производитель MitraClip не дает рекомендаций по выбору или продолжительности антитромботической терапии после процедуры.
Рекомендации ACC / AHA по ведению пациентов с клапанной болезнью сердца (2020) не содержат никаких данных в отношении антитромботической терапии при установке MitraClip, равно как и Рекомендации ЕОК по заболеваниям клапанов сердца (2017). Следовательно, разумно, чтобы пациенты, ранее не получавшие антитромбоцитарные препараты, могли начать прием аспирина и клопидогрела сразу после процедуры, учитывая протоколы исследований в последних клинических испытаниях [41–45]. Однако необходимы дальнейшие исследования для оценки использования других антиагрегантов, таких как тикагрелор и прасугрел, в этой ситуации.
Заключение
Оптимизация антитромботической терапии до и после кардиологического вмешательства является важным аспектом лечения. Необходимо оценить риск тромботических заболеваний и кровотечений, чтобы выбрать подходящую схему и продолжительность хронического лечения. В отношении пациентов, которым требуются как антикоагулянтная терапия, так и лечение антитромбоцитарными препаратами, врачи могут применить подход ДAT – антикоагулянтная терапия плюс ингибитор P2Y12, чтобы снизить риск кровотечения при сохранении ишемической эффективности. Подход к антитромботической терапии в TAVI продолжает развиваться, но современные данные и общепринятые утверждения дают основания предположить, что монотерапия антитромбоцитарными препаратами ПOAК подходит для большинства пациентов. Для Mitraclip необходимы дополнительные данные, чтобы лучше определить оптимальные препараты и продолжительность терапии, но ДАТТ с аспирином и клопидогрелом является разумной. В конечном итоге, врач принимает важное решение о выборе антитромботических препаратов для уменьшения кровотечения и предотвращения ишемических событий.
Библиографическая ссылка
Чулков В.С., Чулков В.С., Эктова Н.А., Минина Е.Е., Жмайлова С.В., Оконенко Т.И. АНТИТРОМБОТИЧЕСКАЯ ТЕРАПИЯ У КАРДИОХИРУРГИЧЕСКИХ ПАЦИЕНТОВ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32898 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32898



