Острый респираторный дистресс-синдром (ОРДС) представляет собой остро возникающее диффузное воспалительное поражение паренхимы легких, развивающееся как неспецифическая реакция на повреждающие факторы и приводящее к формированию острой дыхательной недостаточности. ОРДС остается одной из основных причин смертности в отделении интенсивной терапии, ее показатели составляют в среднем 30–40%. ОРДС является клинически гетерогенным синдромом, что частично объясняет трудности в диагностике и лечении пациентов с ОРДС. Его полиэтиологичность определяет особенности морфологических изменений легких и клиническое течение заболевания. Одним из возможных подходов по преодолению препятствий для разработки методов диагностики и лечения ОРДС является выявление однородных групп в общей популяции пациентов с различными этиопатологическими факторами ОРДС [1].
ОРДС развивается у 1/3 госпитализированных пациентов с COVID-19. Практически у 3/4 пациентов с COVID-19, поступивших в отделение интенсивной терапии, имеется ОРДС. ОРДС возникает как из-за прямого воздействия вируса, так и вследствие патологически активированного иммунного ответа. Точный механизм развития ОРДС при COVID-19 до конца не изучен, однако считается, что одним из основных факторов является индукция цитокинового шторма. Активированные клетки иммунной системы выделяют несколько продуктов, таких как миелопероксидаза нейтрофилов, основные и катионные белки эозинофилов, а также образуют избыточное количество провоспалительных цитокинов, включая ИЛ-6 и ФНО-α, что может привести к прогрессии ОРДС и обширному повреждению тканей, а в итоге - к смерти пациента [2].
Другой уязвимой группой являются онкологические больные. ОРДС возникает у половины пациентов отделения интенсивной терапии, получающих лечение по поводу злокачественных новообразований, и является причиной высокого процента смертности в послеоперационном периоде. Пациенты с онкологическими заболеваниями восприимчивы к целому ряду перекрывающихся факторов риска ОРДС, включая первичные поражения легких (пневмония, аспирация, хирургическая и нехирургическая травма грудной клетки и/или легких) и вторичные источники повреждения (лекарственная токсичность, гипертрансфузия, сепсис или септический шок, возникший в результате внелегочных инфекций или неинфекционной этиологии). Длительная терапия таких пациентов становится причиной задержки проведения лечения по поводу основного заболевания. Остаточная органная дисфункция после ОРДС может отсрочить или сделать невозможным последующее лечение рака. Стратегия лечения ОРДС у онкологических больных в значительной степени экстраполирована на основе исследований, посвященных ОРДС среди пациентов в целом. В этой связи необходимы исследования, посвященные проблемам онкологических больных с развившимся ОРДС [3].
К сожалению, диагностика ОРДС не может быть проведена с помощью одного лабораторного метода исследования. В настоящее время диагностика ОРДС основывается на клинических параметрах, таких как кислородная насыщенность крови, уровень дыхательной недостаточности, рентгеновские и компьютерные томографические изображения легких, а также на данных газоанализа артериальной крови. Кроме того, для диагностики ОРДС могут быть использованы некоторые дополнительные методы, такие как эхокардиография, биопсия легких и другие процедуры. Отсутствие специфического биомаркера ОРДС является одним из основных препятствий в предупреждении развития и успешном лечении этого синдрома [4].
В настоящее время все больше данных свидетельствует о том, что изменение экспрессии специфических микроРНК коррелирует с развитием патологического процесса, и микроРНК рассматриваются как потенциальные биомаркеры для диагностики заболеваний. За последние годы проведено большое количество исследований, которые показывают значение микроРНК в развитии элементов иммунной системы. МикроРНК являются ключевыми регуляторами иммунного ответа и влияют на процессы созревания, пролиферации, дифференцировки и активации клеток иммунной системы, на продукцию антител и высвобождение медиаторов воспаления [5; 6].
Циркулирующие микроРНК обнаруживаются в большинстве биологических жидкостей и считаются общепризнанными неинвазивными биомаркерами многих патологий человека. В отличие от внутриклеточных видов РНК, внеклеточные микроРНК стабильны и устойчивы к деградации при комнатной температуре до четырех дней. Они сохраняют свою функциональную активность даже в неблагоприятных условиях, таких как кипячение, многократные циклы замораживания-оттаивания и высокий или низкий показатель рН. Использование микроРНК в качестве циркулирующих биомаркеров привлекательно, поскольку для получения образца не требуется инвазивный отбор проб, такой как биопсия. Однако необходимо учитывать, что обнаружение микроРНК в биологических жидкостях может быть затруднено из-за их низкой концентрации [5; 6].
Таким образом, для глубокого понимания патофизиологии заболевания, разработки методов диагностики и возможности терапевтических вмешательств необходимо проведение комплексной оценки молекулярно-генетических вариаций пациентов с различными этиопатологическими факторами развития ОРДС. В связи с этим целью данной работы стало исследование дифференциальной экспрессии циркулирующих микроРНК в плазме пациентов с ОРДС, ассоциированным с коронавирусной инфекцией и онкологическим заболеванием.
Материалы и методы исследования
В исследование были включены образцы плазмы крови 30 больных с ОРДС (54,3±8,7 года), получивших хирургическое лечение по поводу немелкоклеточного рака легкого (n=11) и колоректального рака (n=19), 30 больных с ОРДС, ассоциированным с COVID-19 (53,1±9,7) и 25 условно здоровых доноров (50,3±6,7), которых использовали в качестве контрольной группы.
Цельную кровь собирали в пробирки с этилендиаминтетрауксусной кислотой в качестве антикоагулянта. Не позже 2 ч после сбора кровь центрифугировали 10 мин. при 1500 g, плазму перемещали в пробирки без РНКаз и центрифугировали 10 мин. при 16000 g и 4°C. Далее плазму переносили в криопробирки и хранили при температуре –80°C. Образцы плазмы с гемолизом были исключены из исследования.
Методом RT-qPCR определяли изменение относительной экспрессии микроРНК hsa-miR-16-5p, hsa-miR-22-3p, hsa-miR-34-5p, hsa-miR-145-5p, hsa-miR-155p, hsa-miR-21-5p, hsa-miR-182, hsa-miR-195-5p, hsa-miR-326. В качестве референсной последовательности использовали микроРНК cel-miR-39. Выделение тотальной РНК проводили с использованием автоматической станции QIAcube Connect (Qiagen, Германия) с применением набора RNeasy Mini Kit (Qiagen, Германия).
Концентрацию растворов ДНК или РНК измеряли на флуориметре Qubit 2.0® (Invitrogen, США) с использованием набора Quant-iT™ dsDNA High-Sensitivity (HS) Assay Kit (Invitrogen, США) или Quant-iT™ RNA High Sensitivity (HS) Assay Kit.
МикроРНК, присутствующие в тотальной РНК, сначала полиаденилировали в общем объеме 10 мкл, содержащем 1 мкл 10-кратного поли(А)полимеразного буфера, 1 мкл 10 мМ АТФ, 2,5 единицы поли(А)полимеразы (New England Biolabs, США) в течение 30 мин. при температуре 37°C. Полиаденилированные микроРНК подвергали реакции обратной транскрипции с использованием универсального обратного праймера, который содержит олиго(dT)последовательность и адаптерную последовательность на 5'-конце. К реакционной смеси (10 мкл) добавляли 4 мкл 5 × RT буфера, 1 мкл 25 мМ dNTP, 1 мкл 10 мкМ универсального праймера и 200 единиц обратной транскриптазы M-MuLV («Евроген», Российская Федерация) и доводили конечный объем до 20 мкл деионизованной водой без нуклеаз. Обратную транскрипцию проводили при 42 °C в течение 45 минут с последующей инкубацией при 85°C в течение 5 минут для инактивации фермента обратной транскриптазы. Полученную таким кДНК разбавляли в 10 раз деионизованной водой без РНКаз. 5 мкл разведенной кДНК использовали в реакциях RT-PCR.
ПЦР-микс содержал 10х реакционный буфер, 200 нМ dNTP, 1x EvaGreen, 1 ед. HSTaqPol («Евроген», Российская Федерация), 250нМ прямого (F) и обратного (R) праймера. RT-PCR проводили с помощью термоциклера CFX96 (Bio-Rad, США) при следующих условиях: начальная денатурация при 95 °C в течение 3 минут с последующими 40 циклами денатурации (95°C в течение 10 секунд), отжига (60°C в течение 30 секунд) и элонгации (72°C в течение 30 секунд). Специфичность праймеров оценивалась с помощью плавления продуктов ПЦР при диапазоне температур 60-95°C. Для оценки изменения относительной экспрессии микроРНК использовали метод 2-ΔΔCt.
Статистический анализ выполняли с помощью теста ANOVA и критерия Тьюки. Межгрупповые различия рассматривали как статистически значимые при р<0,05. Для статистических тестов использовали GraphPad Prism version 8.0 (GraphPad Software, США)
Результаты исследования и их обсуждение
В настоящем исследовании был определен профиль экспрессии циркулирующих микроРНК hsa-miR-16-5p, hsa-miR-22-3p, hsa-miR-34-5p, hsa-miR-145-5p, hsa-miR-155p, hsa-miR-21-5p, hsa-miR-182, hsa-miR-195-5p, hsa-miR-326. Выбор данных микроРНК был обоснован их участием в регуляции воспалительных процессов, основанных на собственных и литературных данных. Уровни относительной экспрессии микроРНК в плазме крови здоровых добровольцев были использованы в качестве референтных значений относительной экспрессии микроРНК. Статистически значимые различия (p<0,05) между группой больных ОРДС, ассоциированным с COVID-19, и контрольной группы продемонстрировали hsa-miR-22-3p, hsa-miR-34-5p, hsa-miR-145-5p, hsa-miR-155p, hsa-miR-21-5p, hsa-miR-182 и hsa-miR-195-5p. У пациентов с ОРДС, ассоциированным с раком, изменение экспрессии относительно контрольной группы показали hsa-miR-16-5p, hsa-miR-22-3p, hsa-miR-145-5p, hsa-miR-155p, hsa-miR-21-5p, hsa-miR-182, hsa-miR-195-5p и hsa-miR-326 (рисунок, таблица).
Изменение относительной экспрессии микроРНК hsa-miR-16-5p, hsa-miR-22-3p, hsa-miR-34-5p, hsa-miR-145-5p, hsa-miR-155p, hsa-miR-21-5p, hsa-miR-182, hsa-miR-195-5p, hsa-miR-326
|
микроРНК |
2-ΔΔCt (СOVID-19) |
p |
2-ΔΔCt (рак) |
p |
|
hsa-miR-16-5p |
0.78 |
0.8475 |
0.19 |
0.0005 |
|
hsa-miR-21-5p |
0.41 |
0.0024 |
5.01 |
0.0014 |
|
hsa-miR-22-3p |
3.87 |
0.0379 |
0.35 |
0.0096 |
|
hsa-miR-34-5p |
2.92 |
0.0066 |
0.83 |
0.3778 |
|
hsa-miR-145-5p |
54.59 |
<0.0001 |
0.53 |
0.0552 |
|
hsa-miR-155p |
5.92 |
0.0245 |
0.21 |
0.0009 |
|
hsa-miR-182 |
0.40 |
0.0130 |
0.10 |
<0.0001 |
|
hsa-miR-195-5p |
4.83 |
0.0142 |
0.42 |
0.0210 |
|
hsa- miR- 326 |
0.82 |
0.7358 |
0.31 |
<0.0001 |
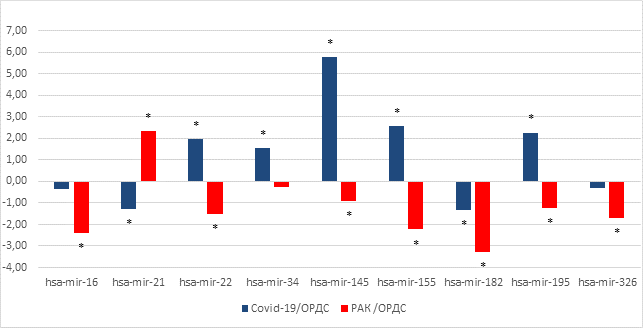
Изменение относительной экспрессии (log22^-ΔΔCt) микроРНК hsa-miR-16-5p, hsa-miR-22-3p, hsa-miR-34-5p, hsa-miR-145-5p, hsa-miR-155p, hsa-miR-21-5p, hsa-miR-182, hsa-miR-195-5p и hsa-miR-326 в плазме крови пациентов с ОРДС, ассоциированным с коронавирусной инфекцией или онкологическим заболеванием (*- р<0,05)
Экспрессия hsa-miR-16-5p значимо снижалась в группе пациентов с ОРДС, ассоциированным с онкологическим заболеванием (р=0.0005), в то время как в группе пациентов с COVID-19 статистически значимых отличий выявлено не было (р=0.8475). hsa-miR-16-5p принимает участие в регуляции воспаления и программированной клеточной гибели. Многие исследования показали противовоспалительный эффект hsa-miR-16-5p при атеросклерозе, остром повреждении легких и сепсисе. Эксперименты на лабораторных животных продемонстрировали, что hsa-miR-16-5p снижает тяжесть острого повреждения легких, регулируя сигнальный путь TLR4/NF-κB, и тем самым ослабляет воспалительную реакцию [7].
Экспрессия hsa-miR-21-5p значимо отличалась во всех клинических группах относительно контрольных значений. В группе пациентов с COVID-19 экспрессия данной микроРНК снижалась (р=0.0024), тогда как у онкологических больных показатель экспрессии возрастал в пять раз (р=0.0014). МикроРНК hsa-miR-21-5p является одной из наиболее изученных микроРНК, связанных с онкологическими заболеваниями. hsa-miR-21-5p является известным онкогеном при многих видах рака человека, включая рак яичников, немелкоклеточный рак легкого и колоректальный рак [5]. Однако биологическая роль hsa-miR-21-5p при остром повреждении легких остается в значительной степени неизвестной. Недавние исследования подтвердили, что сверхэкспрессия hsa-miR-21-5p может значительно снизить апоптоз в альвеолярных эпителиальных клетках [8].
Обнаружено статистически значимое увеличение экспрессии hsa-miR-23-5p в группе пациентов с COVID-19 в 3 раза (p=0.0379), в то время как у онкологических пациентов этот показатель снижался (p=0.0096). hsa-miR-23-5p выступает в качестве супрессора опухолей при некоторых видах рака, включая рак молочной железы, яичников, печени, предстательной железы и шейки матки. Однако hsa-miR-23-5p также может функционировать как онкоген, способствуя прогрессированию рака печени, рака предстательной железы и хронического лимфоцитарного лейкоза [5]. микроРНК hsa-miR-23-5p является одним из регуляторов WNT/b-катенин сигнального пути, который играет ключевую роль в индукции ОРДС [9]. Можно предположить, что изменение экспрессии hsa-miR-23-5p может быть связано с ее ролью в регуляции развития ОРДС.
Экспрессия hsa-miR-34-5p возрастала в группе пациентов с COVID-19 в три раза (р=0.0066), тогда как у онкологических больных изменение относительной экспрессии не имело статистически значимых отличий (р=0.3778). Известно, что ингибирование hsa-miR-34-5p ослабляет воспаление легких и апоптоз в экспериментальной модели ОРДС на лабораторных животных, индуцированной ЛПС, путем инактивации програнулина. Програнулин играет критическую роль в ряде физиологических и патологических процессов, включая заживление ран, воспаление и апоптоз. У лабораторных мышей с дефицитом програнулина наблюдается тяжелое повреждение легких и чрезмерные воспалительные реакции при развитии сепсиса [10].
Экспрессия hsa-miR-145-5p повышалась в группе пациентов с COVID-19 в 54 раза (р<0.0001), тогда как у онкологических больных показатель экспрессии не имел статистически значимых отличий (р=0.0552). Сверхэкспрессия hsa-miR-145-5p инактивирует сигнальный путь TGF-β1/Smad и ослабляет воспалительное повреждение. С другой стороны, нарушение регуляции сигнального пути TGF-β/Smad является патологическим активатором фиброза. Следует отметить, что hsa-miR-145-5p является маркером тяжелой формы течения COVID-19, что может указывать на его важную роль в развитии более тяжелых форм заболевания [11].
МикроРНК hsa-miR-155-5p является одной из наиболее изученных в контексте иммунных и воспалительных процессов. Экспрессия hsa-miR-155-5p возрастала в плазме крови пациентов с COVID-19 в шесть раз (р=0.0066), тогда как у онкологических больных показатель экспрессии снижался (р=0.0009). hsa-miR-155-5p играет важную роль в иммунной регуляции и характеризуется высоким уровнем экспрессии в лимфоидных клетках и умеренным в ткани легких. Сверхэкспрессия hsa-miR-155-5p может подавлять передачу сигналов NF-kB. Ее экспрессия повышена при многих заболеваниях, включая рак, аутоиммунные заболевания, инфекции и болезни сердечно-сосудистой системы. hsa-miR-155-5p регулирует экспрессию генов, контролирующих дифференциацию и активацию T- и В-лимфоцитов, макрофагов и дендритных клеток [12].
Экспрессия hsa-miR-182 значимо снижалась во всех клинических группах (р=0.0130 и р<0.0001) относительно контрольных значений. Показано, что hsa-miR-182 влияет на секрецию провоспалительных цитокинов. hsa-miR-182 подавляет активацию NF-κB, влияя на экспрессию TLR4. Было подтверждено, что hsa-miR-182 напрямую регулирует экспрессию TLR4 на посттранскрипционном уровне путем связывания с 3'-нетранслируемой областью мРНК TLR4 [13]. Следует отметить, что только hsa-miR-182 показала значимые однонаправленные изменения во всех клинических группах, что может рассматриваться как характерная черта ОРДС, не зависящая от этиологии.
Экспрессия hsa-miR-195-5p возрастала в группе пациентов с COVID-19 в 4,83 раза (р=0.0142), тогда как у онкологических больных показатель экспрессии снижался (р=0.0210). hsa-miR-195-5p считается опухолевым супрессором и предполагается, что она действует как противовоспалительный регулятор макрофагов, ингибируя TLR2 и уменьшая уровни IL-1β, IL-6 и TNF-α [14].
Экспрессия hsa-miR-326 значимо снижалась в группе пациентов с раком (р <0.0001), тогда как в группе пациентов с COVID-19 отличий выявлено не было (р=0.7358). hsa-miR-326 первоначально была идентифицирована как микроРНК, связанная с развитием аутоиммунных реакций. Однако последующие исследования показали, что данная микроРНК также действует как онкосупрессор при многих типах онкологических заболеваний [15].
Заключение
Выявленное изменение экспрессии микроРНК hsa-miR-182 в плазме крови пациентов с ОРДС может рассматриваться как характерная черта, не зависящая от его этиопатологических факторов развития, и как потенциальный диагностический биомаркер ОРДС, ассоциированного с коронавирусной инфекцией и онкологическим заболеванием. Возможность применения данного подхода может быть уточнена в дальнейших масштабных исследованиях.
Библиографическая ссылка
Микутин А.В., Аллилуев И.А., Коробка В.Л., Ушакова Н.Д. ИССЛЕДОВАНИЕ ЭКСПРЕССИИ ЦИРКУЛИРУЮЩИХ МИКРОРНК В ПЛАЗМЕ КРОВИ ПАЦИЕНТОВ С ОСТРЫМ РЕСПИРАТОРНЫМ ДИСТРЕСС-СИНДРОМОМ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32896 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32896



