Исследования последних лет указывают на возрастающую роль в развитии заболеваний дыхательных путей у детей «атипичных» возбудителей, в первую очередь Mycoplasma pneumoniae (M. pneumoniae). Иммунологические нарушения при микоплазменной инфекции лежат в основе хронизации заболеваний респираторной системы. Поэтому вопрос изучения распространенности, диагностики и лечения респираторного микоплазмоза остается актуальным. M. pneumoniae-инфекция может встречаться у людей любого возраста, но наиболее часто – у детей-школьников, подростков и молодых людей. [1, с. 478–479]. При респираторном микоплазмозе поражаются дыхательные пути в связи с высокой тропностью микоплазм к эпителию слизистых оболочек респираторного тракта. Диагностика микоплазменной инфекции затруднительна из-за отсутствия специфической клинической картины заболеваний. При поражении верхних дыхательных путей микоплазменной инфекцией характерны двустороннее поражение ЛОР-органов, малосимптомное, рецидивирующее, затяжное течение заболеваний [2]. Респираторный микоплазмоз может протекать как в легкой форме с явлениями ринофарингита, ларингита, бронхита, так и в виде тяжелых пневмоний с дыхательной недостаточностью.
М. pneumoniae обладает рядом факторов патогенности – цитоадгезинами, в первую очередь белком Р1, способствующим адгезии микоплазм к реснитчатому эпителию; токсином CARDS, отвечающим за проникновение внутрь клетки-хозяина [3, 4]. За счет цитохимических реакций M. рneumoniaе вызывает воспаление, напоминающее гиперчувствительность замедленного типа, во время которого развивается цитокиновый дисбаланс с острой системной воспалительной реакцией [5]. Микоплазмы после цитотоксического ответа активируют сначала иммунокомплексные реакции, а затем, через 5–6 недель, и аутоиммунные процессы. Аутоиммунный ответ является важным звеном в этиопатогенезе внереспираторных заболеваний при микоплазменной инфекции и связан со сходством рецепторов клеток-хозяина с микоплазменными адгезинами [6]. Согласно Narita M. et al. (2016) [7], микоплазменная инфекция способна вызывать системный воспалительный процесс за счет цитокин-индуцированных реакций. Это приводит к развитию бронхиальной астмы, перикардиту, эндокардиту, гепатиту, менингита, синдрома Стивенса–Джонсона [5].
Препаратами выбора для лечения микоплазменной инфекции являются макролиды, тетрациклины и фторхинолоны. Согласно данным литературы [8], в последние годы наблюдается рост заболеваемости респираторным микоплазмозом, возбудителем которого являются макролид-резистентные штаммы с мутациями в генах, способные вызывать внереспираторные поражения органов и систем. По последним данным, в Ставропольском крае резистентность к макролидам (азитромицину, кларитромицину) может составлять до 40%. В последние 2 года в связи с масштабным применением левофлоксацина возросла резистентность и к фторхинолонам (до 12%). Доксициклин может быть неэффективен в 25% случаев [9].
Цель исследования – выявить особенности течения микоплазменной инфекции у пациентов с острофазным IgM и положительным IgG к М. pneumoniae, проходивших лечение в 2018–2022 гг. в Консультативно-диагностическом центре и пульмонологическом отделении Краевой детской клинической больницы г. Ставрополя.
Материал и методы исследования
Были проанализированы 2661 амбулаторная и стационарная карта детей, проходивших обследование по поводу микоплазменной респираторной инфекции в 2018–2022 гг. в Консультативно-диагностическом центре и пульмонологическом отделении Краевой детской клинической больницы г. Ставрополя. В исследование вошли дети в возрасте от 0 до 18 лет. Все пациенты из исследуемой группы имели признаки респираторных заболеваний, были осмотрены педиатром или пульмонологом, и им был выполнен иммуноферментный анализ (ИФА) для определения IgM, IgG к М. pneumoniaе. Были сформированы две группы пациентов, разделенных в зависимости от результатов ИФА. В Группу 1 вошли пациенты с инфекционными заболеваниями дыхательных путей и с положительными IgM к М. pneumoniae, что подтверждает диагноз «респираторный микоплазмоз». В Группу 2 вошли дети с респираторными заболеваниями и положительными IgG к М. pneumoniae, что можно расценивать и как наличие микоплазменной инфекции в анамнезе, и как рецидивирующее течение респираторного микоплазмоза. ИФА с определением антител к М. pneumoniae был положительным у 84 детей (у 3,2% обследованных детей). У 50 из них был обнаружен IgM к М. pneumoniae, у 4 детей были выявлены и IgM, и IgG к M. pneumoniae, все эти дети вошли в Группу 1 (всего 54 ребенка). У 30 детей были обнаружены IgG к М. pneumoniae, эти дети вошли в Группу 2. Была проанализирована распространенность клинических форм респираторного микоплазмоза, жалоб, сопутствующих аллергических заболеваний и микст-инфекций в обеих исследуемых группах.
Статистический анализ проводился с использованием программы StatTech v. 3.0.9 (разработчик – ООО «Статтех», Россия). Количественные показатели оценивались на предмет соответствия нормальному распределению с помощью критерия Шапиро–Уилка (при числе исследуемых менее 50) или критерия Колмогорова–Смирнова (при числе исследуемых более 50). В случае отсутствия нормального распределения количественные данные описывались с помощью медианы (Me) и нижнего и верхнего квартилей (Q1 – Q3). Категориальные данные описывались с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполнялось с помощью U-критерия Манна–Уитни. Сравнение частот распределения при анализе четырехпольных таблиц сопряженности выполнялось с помощью критерия хи-квадрат Пирсона (при значениях ожидаемого явления более 10), точного критерия Фишера (при значениях ожидаемого явления менее 10).
Результаты исследования и их обсуждение
Как известно, респираторный микоплазмоз может проявляться различными клиническими картинами: чаще всего – острым ринитом, острым тонзиллофарингитом, острым трахеобронхитом, обструктивным бронхитом. При сравнении встречаемости острого ринита в двух исследуемых группах были получены следующие данные: острый ринит был установлен в 37% случаев (20 детей) в Группе 1 и в 26,7% случаев (8 детей) в Группе 2. Между группами не удалось установить статистически значимых различий (p=0,121, используемый метод: Хи-квадрат Пирсона). С учетом жалоб, данных объективного осмотра, результатов лабораторных и рентгенологических исследований острый трахеобронхит был обнаружен в 16,7% случаев (9 детей) в Группе 1 и в 23,3% случаев (7 детей) в Группе 2, статистически достоверных различий между группами установить не удалось (p=0,456, используемый метод: Хи-квадрат Пирсона). Наиболее частым клиническим проявлением микоплазменной инфекции в обеих группах был обструктивный бронхит: в 57,4% случаев (у 31 ребенка) в Группе 1 и в 50% случаев (15 детей) в Группе 2 (рис. 1).
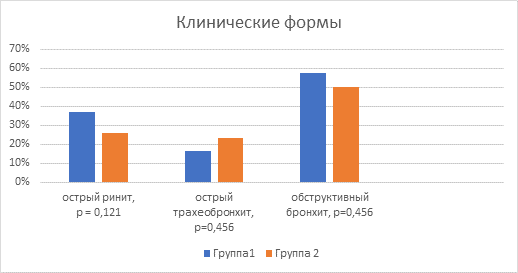
Рис 1. Структура нозологических форм среди детей в обеих группах (%)
Наиболее частой жалобой у детей в обеих группах при микоплазменной инфекции был кашель, выявленный в 75,9% случаев (у 41 ребенка) в Группе 1 и в 86,7% случаев (у 26 детей) в Группе 2. При сравнении продолжительности жалоб на кашель в Группе 1 и в Группе 2 были выявлены статистически значимые различия. Так, жалобы на кашель до 1 месяца статистически достоверно чаще были у пациентов в Группе 1 – в 40,7% случаев (20 детей), в то время как Группе 2 – всего у 10% (3 детей) (p=0,003, используемые методы: Хи-квадрат Пирсона). В 48,1% случаев (26 детей) в Группе 1 и в 26,7% случаев (8 детей) в Группе 2 жалобы на продолжительность кашля были от 1 до 3 месяцев, между группами не установлены статистически значимые различия (p=0,055, используемые методы: Хи-квадрат Пирсона) (рис. 2). Жалобы на кашель более 3 месяцев предъявляли 60% (18) детей Группы 2, и у 11% (6) детей из Группы 1 был такой же продолжительный кашель. Установлены статистически достоверные различия между группами (p<0,001, используемые методы: Хи-квадрат Пирсона).
Почти у половины детей с респираторным микоплазмозом в обеих исследуемых группах были жалобы на заложенность носа c выделениями, преимущественно слизистого характера: в 59,3% случаев (32 детей) в Группе 1 и в 43,3% случаев (13 детей) в Группе 2, не удалось выявить статистически значимых различий между группами (p=0,161, используемый метод: Хи-квадрат Пирсона). На боль в горле жаловались только 9,3% (5 детей) в Группе 1 и 10% (3 детей) Группе 2, не удалось установить статистически значимых различий (p=1,000, используемый метод: критерий Фишера).
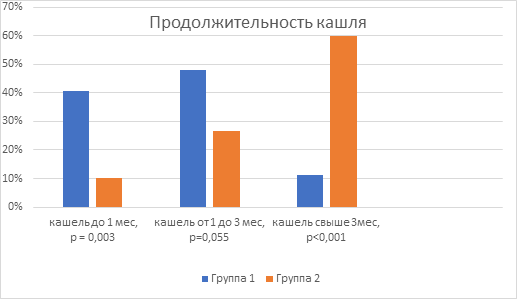
Рис 2. Продолжительность кашля в Группе 1 и в Группе 2 (%)
Следовательно, воспалительные заболевания органов дыхания и в Группе 1, и в Группе 2 носят малосимптомные признаки: кашель, насморк, реже – боль в горле. Сравнительный анализ клинического течения респираторных заболеваний в обеих группах показал, что затяжное течение заболеваний, с сохраняющимся кашлем более 3 месяцев статистически достоверно чаще встречалось в группе пациентов с сохраняющимся высоким уровнем IgG к М. pneumoniеa, что позволяет предположить персистирующий характер микоплазменной инфекции у детей в Группе 2.
Сопутствующие аллергические и инфекционные заболевания в исследуемых группах
С целью выявления сопутствующих заболеваний и диагностики возможных осложнений микоплазменной инфекции большинство детей были проконсультированы врачом-оториноларингологом и аллергологом. Так, половина детей из исследуемой группы с респираторным микоплазмозом были осмотрены врачом-оториноларингологом, в 18,5% случаев (10 детей) в Группе 1 и в 16,7% случаев (5 детей) в Группе 2 было выявлено обострение хронического аденоидита. При обследовании детей у врача-оториноларинголога, аллерголога у 27,8% (15) пациентов в Группе 1 и у 23,3% (7) детей был диагностирован аллергический ринит.
Встречаемость бронхиальной астмы (БА) была выше в Группе 2: так, БА выявлена в 23,3% случаев (7 детей) в Группе 2 и у 5,6% (3 детей) в Группе 1. По результатам анализа в Группе 2 статистически достоверно встречаемость пациентов с БА выше, чем в Группе 1 (р<0,05, используемый метод: Хи-квадрат Пирсона). Также встречаемость детей, отнесенных к группе риска по возникновению БА, выше в Группе 2: 10% (3) детей в Группе 2 и 5% (3) в Группе 1, хотя статистическую достоверность различий между группами установить не удалось (p=0,662, используемый метод: точный критерий Фишера).
В исследуемых группах довольно часто диагностировали и другую аллергическую патологию – инсектную аллергию, аллергический дерматит, аллергический конъюнктивит. Так, сопутствующие аллергические заболевания встречались у 25,9% (14) детей в Группе 1 и у 23,3% (7) детей в Группе 2. При анализе частоты встречаемости таких аллергических заболеваний, как инсектная аллергия, аллергический конъюнктивит и дерматит, статистически значимых различий между исследуемыми группами выявить не удалось (p=0,793, используемый метод: Хи-квадрат Пирсона).
Также у части детей в анализах имелись отклонения, указывающие на сенсибилизацию организма: 20,4% (11) детей в Группе 1 и 36,7% (11) детей в Группе 2 имели повышенный общий IgE, при анализе частоты встречаемости данного показателя между группами не удалось установить статистически значимых различий (p=0,104, используемый метод: Хи-квадрат Пирсона). У 22,2% (12) пациентов в Группе 1 и у 23,3% (7) пациентов в Группе 2 в ОАК наблюдалась эозинофилия (p=0,907, используемый метод: Хи-квадрат Пирсона), а специфические IgE были повышены у 24% (13) детей в Группе 1 и у 16,7% (5) детей в Группе 2 (p=0,428, используемый метод: Хи-квадрат Пирсона). При проведении аллергологического обследования у 9,3% (5) детей в Группе 1 и у 6,7% (2) детей в Группе 2 были положительные кожные пробы (p=1,000, используемый метод: точный критерий Фишера). Статистически значимых различий между Группой 1 и Группой 2 по вышеперечисленным критериям выявить также не удалось.
У 3 детей (5,6% случаев) на фоне респираторного микоплазмоза в Группе 1 была диагностирована артропатия, в анализах одного из этих детей был повышен ревматоидный фактор, эти дети в дальнейшем получали лечение у ревматолога. В Группе 2 детей с артропатией выявлено не было.
Все пациенты проходили обследование на наличие сопутствующей микст-инфекции:полимеразная цепная реакция (ПЦР) слюны, ИФА кровиIgG, IgМк вирусу Эпштейн-Барра (ВЭБ), к герпесу 1-го, 2-го, 6-го типов, к цитомегаловирусу (ЦМВ),Chlamydophila pneumoniae (Cl. pneumoniae).
Положительный тест ПЦР квирусу Эпштейн–Барра, к герпесу 1-го, 2-го типа, к цитомегаловирусу был выявлен у 9,3% (5) детей в Группе 1 и у 10% (3) детей в Группе 2. Статистически достоверных различий в исследуемых группах выявить не удалось (p=0,208, используемый метод: Хи-квадрат Пирсона). Также в исследуемых группах проводилась ИФА-диагностика сопутствующей герпес-вирусной инфекции: определение IgG к вирусу Эпштейн–Барра, цитомегаловирусу, герпесу 1-го типа. Латентная герпес-вирусная инфекция была выявлена у 26,1% (14) детей в Группе 1 и у 20% (6) детей в Группе 2, статистически значимых различий между группами установить не удалось (p=0,552, используемый метод: Хи-квадрат Пирсона) (табл. 1).
Таблица 1
ИФА диагностика герпес-вирусной инфекции
|
Показатели |
Результат обследования |
Группа |
|
|
Группа 1 |
Группа 2 |
||
|
IgG к ВЭБ, ЦМВ, герпесу 1-го типа |
Не обнаружены |
39 (72,2%) |
24 (80,0%) |
|
IgG к ВЭБ |
5 (9,3%) |
0 |
|
|
IgG к ВЭБ, ЦМВ |
6 (11,2%) |
3 (10,0%) |
|
|
IgG к ЦМВ |
3 (5,6%) |
2 (6,7%) |
|
|
IgG к герпесу 1 типа |
0 |
1 (3,3%) |
|
Сопутствующая хламидийная инфекция (Cl. pneumoniae) была выявлена у 7,4% (4) детей только в Группе 1, случаев респираторного хламидиоза в Группе 2 выявлено не было, статистически достоверных различий между группами не установлено (р>0,05, используемый метод: Хи-квадрат Пирсона).
Были оценены данные клинического анализа крови: у детей с микоплазменной инфекцией дыхательных путей в ОАК выявлялся лимфоцитоз – у 42,6% (23) детей в Группе 1 и у 43% (13) детей в Группе 2 (p=0,948, используемый метод: Хи-квадрат Пирсона); моноцитоз – у 20,4% (11) детей в Группе 1 и у 20% (6) детей в Группе 2 (p=0,968, используемый метод: Хи-квадрат Пирсона); нейтропения – у 31,5% (17) детей в Группе 1 и 23% (7) детей в Группе 2 (p=0,428, используемый метод: Хи-квадрат Пирсона). При сравнении показателей ОАК установить статистически значимых различий в исследуемых группах не удалось.
Таким образом, около четверти детей в обеих исследуемых группах имели сопутствующие аллергические заболевания, среди которых самым распространенным был аллергический ринит. При этом БА достоверно чаще встречалась у больных в Группе 2. Также почти у трети детей в обеих группах выявлены микст-инфекции. Наличие подобной смешанной инфекции необходимо учитывать в схеме лечения.
Сложившаяся практика лечения респираторного микоплазмоза
Антибактериальную терапию получали только половина детей в Группе 1 и менее 20% (5) детей в Группе 2. Макролидные антибактериальные препараты были назначены только 42,6% (23) детей в Группе 1. Чаще всего были назначены азитромицин (в 29,6% случаев) и джозамицин (в 11% случаев). В Группе 2 этиотропную терапию этой группой антибиотиков получали 10% (3) детей. При этом 10% (6) детей в Группе 1 и 6,7% (2) детей в Группе 2 получали неэффективную в отношении M. pneumoniae антибактериальную терапию – пенициллины или цефалоспорины, назначенную до проведения ИФА на микоплазменную инфекцию (табл. 2).
Следует отметить, что у пациентов с респираторным микоплазмозом применялись ингаляционные кортикостероиды: пациентам Группы 1 будесонид (пульмикорт) был назначен в 72,2% случаев (39 детям), а пациентам Группы 2 – в 56,6% случаев (17 детям).
Сравнительный анализ клинических данных показал, что статистически достоверными были различия по продолжительности кашля и встречаемости бронхиальной астмы в исследуемых группах. В остальном обе группы были сопоставимы: у пациентов в Группе 1 и в Группе 2 заболевания не имели специфической клинической картины, поражались и верхние, и нижние дыхательные пути, наиболее частые жалобы были на заложенность носа со слизистым отделяемым и кашель. Респираторный микоплазмоз в обеих группах встречался как изолированно, так и в качестве микст-инфекции, ассоциированной с герпесвирусной инфекцией.
Таблица 2
Применение антибактериальной терапии в исследуемых группах
|
Антибиотикотерапия |
Группы больных |
|
|
Группа 1 (n=54) |
Группа 2 (n=30) |
|
|
Антибиотики не назначались |
24 (44,4%) |
25 (83,3%) |
|
Азитромицин |
16 (29,6%) |
2 (6,7%) |
|
Джозамицин |
6 (11,2%) |
1 (3,3%) |
|
Кларитромицин |
1 (1,9%) |
0 |
|
Амоксициллин |
1 (1,9%) |
0 |
|
Цефиксим |
3 (5,6%) |
0 |
|
Цефотаксим |
1 (1,9%) |
1 (3,3%) |
|
Цефтриаксон |
2 (3,7%) |
1 (3,3%) |
Таким образом, у больных Группы 1, судя по уровню IgM к M. pneumoniae, инфекционный процесс продолжается, несмотря на то, что 11% детей на момент обращения в клинику предъявляли жалобы на кашель уже более 3 месяцев, а в 48,1% случаев – более 1 месяца. Пациенты Группы 2, видимо, ранее перенесли микоплазменную инфекцию, поскольку в сыворотке крови обнаруживались высокие уровни IgG к M. pneumoniae. Однако у этих детей в течение длительного времени сохраняется кашель.
Анализ проведенной антибактериальной терапии позволяет считать ее малоэффективной, поскольку 83,3% детей этой группы вообще не получали этиотропной терапии, а у 6,7% больных выбранные антибиотики (бета-лактамы) не влияют на M. pneumoniae. Следовательно, можно думать, что 90% пациентов Группы 2 ранее не получили эффективной антибиотикотерапии микоплазменной инфекции. Если учесть, что наблюдается довольно высокая резистентность M. pneumoniae к макролидным антибиотикам [8; 9, с. 16], эта цифра будет еще больше.
Вызывает беспокойство тот факт, что в этой группе гораздо чаще встречались пациенты, относящиеся к группе риска по БА, а также с установленным диагнозом БА. Можно предположить, что персистирующая микоплазменная инфекция респираторного тракта приводит к гиперреактивности бронхов и через иммуногистохимические реакции вызывает сенсибилизацию организма. Так, при инфекции дыхательного тракта на фоне M. pneumoniae происходит гиперпродукция IgЕ, который участвует в развитии аллергической патологии дыхательных путей. Это соответствует описанному в литературе [10] механизмувоспаления при респираторном микоплазмозе, связанному с Th2-направленным ответом иммунной системы: увеличению высвобождения цитокинов 2-го типа, включая интерлейкины (IL)-4 и -5, и, как следствие, повышению IgE.
Стоит отметить достаточно высокую распространенность микст-инфекции, выявленной в ходе исследования. Респираторный микоплазмоз, ассоциированный с герпес-вирусной инфекцией (положительные ПЦР тесты или ИФА к герпес-вирусам), обнаруживался утрети детей в обеих исследуемых группах. Это приводит к более глубоким изменениям со стороны иммунной системы: уменьшению количества CD3+-, CD4+, СD25+-лимфоцитов, IgА и IgG, и повышению цитокинов, что характеризует иммунный ответ как идущий преимущественно по Тh2-типу [11].
Лечение антибактериальными средствами больных Группы 1 в 57,5% случаев либо не проводилось, либо применялись неэффективные в отношении M. pneumoniae препараты (бета-лактамные антибиотики). Учитывая резистентность M. pneumoniae к макролидным антибиотикам, риск низкой результативности лечения еще более увеличивается.
Заключение
Таким образом, с учетом рисков возможных осложнений, очевидна необходимость совершенствования диагностики и лечения респираторных инфекций, вызванных атипичными микроорганизмами, в частности M. pneumoniae. Необходимо внедрение экспрессных методов выявления респираторных микоплазм, а также определения их резистентности к антибиотикам.
Библиографическая ссылка
Деньгина А.В., Батурин В.А., Кошель И.В. КЛИНИЧЕСКИЕ ОСОБЕННОСТИ МИКОПЛАЗМЕННОЙ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ В ДЕТСКОМ ВОЗРАСТЕ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32865 (дата обращения: 20.01.2026).
DOI: https://doi.org/10.17513/spno.32865



