Синдром системного воспаления (СВ) возникает при ответе организма на повреждение при взаимодействии центральной нервной, эндокринной систем и внутренних органов, которое направлено на сохранение гомеостаза [1]. По отношению к очагу воспаления возникают две взаимодополняющие генетически детерминированные программы: внутренняя (на локальном уровне) и внешняя системная воспалительная реакция, последняя возможна при условии чрезмерно выраженного местного воспаления и/или его барьерной несостоятельности [2, 3]. При черепно-мозговой травме (ЧМТ) локализованное в головном мозге нейровоспаление способствует появлению острого респираторного дистресс-синдрома в легких [4]. Возможной мишенью в виде общего звена патогенеза при сочетании ЧМТ и СВ могут являться волокна соединительной ткани легкого, роль которой малоизучена в механизме развития патологии. Структурно реакция соединительной ткани при патологии и адаптации представлена: склерозом, дистрофией, воспалением, регенерацией и т.д. При оценке типа реакции соединительной ткани необходимо исходить из принципов взаимодействия структурных единиц тканей, в которых генетически детерминировано соотношение стромы и паренхимы. Органометрические характеристики вторичной дольки легких и наличие соединительнотканных перегородок на уровне законов механики жестко определяют резервные возможности внешнего дыхания. Сочетание острого церебрального повреждения и легочной патологии затрагивает стромально-паренхиматозное соотношение нарушению дистальные отделы воздухоносных путей с развитием воспалительной реакции, включая ретикулярные и преколлагеновые волокна. Роль аргирофильных (ретикулярных) волокон в развитии патологии органов дыхания при сочетании ЧМТ и СВ малоизучена, тогда как нарушение их функциональности в последующем оказывает значительное влияние на соединительную ткань бронхов [5]. Цель исследования: провести экспериментальное структурно-функциональное исследование состояния дистальных бронхов легких крыс при сочетании ЧМТ и СВ.
Материалы и методы исследования. Эксперимент проводили на половозрелых крысах-самцах Wistar (масса тела 200–250 г, возраст 12 недель), полученных из питомника лабораторных животных (г. Пущино, филиал Института биоорганической химии им. акад. М.М. Шемякина и Ю.А. Овчинникова РАН). Эксперимент осуществляли в соответствии с положениями Хельсинкской декларации и рекомендациям Директивы 2010/63/EU Европейского парламента и Совета Европейского Союза от 22.09.2010 г. по охране животных. Дизайн исследования одобрен междисциплинарным этическим комитетом ФГБОУ ВО ТГМУ Минздрава России (протокол № 9 от 16.05.2022 г.). Общую анестезию производили с помощью внутримышечного введения золетила 100 в дозе 20 мг/кг массы тела крыс («Virbac», Франция). Для воспроизведения ЧМТ средней степени использовали модифицированную модель падающего груза [6]. Для нанесения травмы применяли установку с грузом (масса 200 г), который падал с высоты 1 м на теменную область головы животного. Для индукции СВ животным с учетом массы тела внутримышечно вводили водный раствор пирогенала (0,7 мл) в дозе 33,3 мкг/кг троекратно на 1-е, 3-и, 4-е сутки (ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России). Животные были распределены на следующие группы: 1 – интактные крысы, без нанесения ЧМТ и СВ (6 крыс); 2 – крысы при нанесении ЧМТ средней степени (6 крыс); 3 – крысы с индуцированным СВ (6 крыс); 4 – травмированные крысы при троекратном введении пирогенала в дозе 33,3 мкг/кг на 1-е, 3-и, 4-е сутки (6 крыс). Ректальную температуру тела крыс измеряли с помощью медицинского цифрового термометра «Amrus AMDT-14 Swing» (Китай), количество лейкоцитов в периферической крови подсчитывали в камере Горяева, % незрелых нейтрофилов оценивали в мазках крови, окрашенных по Романовскому–Гимзе. После общей анестезии на 6-й день производили вскрытие грудной клетки для вивисекции легких, которые фиксировали в 96%-ном этиловом спирте в течение 24 ч, после чего получали кусочек органа размером 10×10×10 мм, проводили его через хлороформ, заливали в парафин и изготавливали срезы толщиной 5 мкм. Препараты окрашивали гематоксилином Эрлиха и эозином, толуидиновым синим, импрегнировали серебром по методу Фута (ООО Биовитрум, Санкт-Петербург). Морфометрическое исследование проводили с помощью программного обеспечения Cell Sens standard Olympus и NIS-Elements (Nikon, Япония). Имунногистохимическое исследование локализации эпитопов CD14 и CD 45 в клетках оценивали с помощью наборов Elabscience с пероксидазной детекцией DAB методом (Аbcam, США).
Статистический анализ результатов проводили с применением программы Statistica 6.0 (StatSoft, США). Значения представлены как среднее значение ± стандартная ошибка среднего (M±m). Данные по группам проанализированы с помощью t-критерия Стьюдента для сравнительных исследований. Различия считались статистически значимыми при р<0,05.
Результаты исследования и их обсуждение. У травмированных животных при сочетании с СВ на 4-й день эксперимента обнаружена субфебрильная гипертермия, которая сохранялась до конца срока наблюдения (6 суток) и сопровождалась повышением количества лейкоцитов в периферической крови (табл. 1).
Таблица 1
Показатели термометрии и количества клеток крови животных
|
Показатель |
1-я группа (n=6) |
2-я группа (n=6) |
3-я группа (n=6) |
4-я группа (n=6) |
|
|
4-й день после начала эксперимента |
|||||
|
Ректальная термометрия, оС |
37,4±0,049 |
37,6±0,045 (1–4)* |
37,9±0,06 (1–3)** |
38,5±0,065 (1–4)*** |
|
|
Количество лейкоцитов х109/л в 1 л крови |
12,1±0,61 |
13,6±0,73 (1–2)*
|
9,7±0,55 (1–3)**
|
9,5±0,7 (1–4)**
|
|
|
% палочкоядерных сегментоядерных лейкоцитов |
4,4±0,72 |
5,2±0,51 (2–4)*
|
8,8±0,65 (1–3)***
|
8,8±0,64 (1–4)***
|
|
|
6-й день после начала эксперимента |
|||||
|
Ректальная термометрия, оС |
37,5±0,05
|
37,6±0,05 |
37,4±0,07 (3–4)** |
37,8±0,07 (1–4)** |
|
|
Количество лейкоцитов х109/л в 1 л крови |
12,3±0,65 |
12,3±0,57 (2–4)*
|
13,2±0,68 (3–4)* |
15,7 ± 0,82 (1–4)** |
|
|
% палочкоядерных сегментоядерных лейкоцитов |
4,1±0,63 |
5± 0,45 (2–4)*
|
6±0,58 (1–3)*
|
6,9±0,58 (1–4)**
|
|
Примечание: 1-я группа – животные без нанесения ЧМТ и введения пирогенала; 2-я группа – животные после нанесения ЧМТ; 3-я группа – животные, которым троекратно вводили пирогенал в дозе 33,3 мкг/мл на 1-е, 3-и, 4-е сутки; 4-я группа – травмированные животные, которым троекратно вводили пирогенал в дозе 33,3 мкг/кг на 1-е, 3-и, 4-е сутки; * достоверное различие между показателями при p<0,05, ** p<0,01, *** p<0,001.
При оценке негативного воздействия среды на организм экспериментальных животных характеристика структурных единиц органов дыхания позволяет провести интерполяцию полученных данных на возможную реакцию человеческого организма. У крыс при наличии 5 долей в легких, в отличие от правого, левое легкое крыс представлено одной долей. Внутрилегочные бронхи (ВБ) легких крыс подразделяются на четыре порядковые генерации. К первой относится экстрапульмонарный каудальный бронх (1200–1500 мкм), между ним и дистальными ВБ (150–300 мкм) находятся бронхи 2-го порядка (400–600 мкм), которые переходят в малые (150–300 нм), которые являются наиболее протяженными по направлению к дорсальному и вентральному краям, латеральной и медиальной поверхностям легких. Проксимальные ВБ третьей генерации имеют складчатую поверхность и покрыты кубическим реснитчатым эпителием, где бокаловидные клетки отсутствуют. Слизистая оболочка дистальных бронхов с нескладчатой поверхностью покрыта кубическим нереснитчатым эпителием с клетками Клара. Обнаружены выраженные изменения дистальных воздухоносных бронхов третьей и четвертой генерации у крыс при сочетании ЧМТ и СВ, тогда как после нанесения только ЧМТ или введения пирогенала таких изменений не выявлено (табл. 2). Также в легких этих крыс отмечалось достоверное уменьшение диаметра просвета бронхов на 6-й день по сравнению с показателями для остальных животных. При окрашивании гематоксилин-эозином и толуидиновым синим в соединительных тканях легкого крыс и дистальных ВБ выявлялись разветвленные и длинные структуры толщиной до 2,4 мкм, которые характерны для незрелых коллагеновых и эластических волокон (рисунок). Тонкие соединительнотканные аргирофильные волокна в виде плотных сплетений располагались в области границы базальной части бронхиального эпителия и собственной пластинки слизистой и адвентициальной оболочек дистальных ВБ (рисунок), количество которых увеличивалась у животных при сочетании ЧМТ и СВ (табл. 2). Такие волокна окружали мышечную пластинку и переходили в область контакта с тканями ацинусов легких и кровеносных сосудов. Также у этих крыс в просвете ВБ 2-го, 3-го и 4-го порядка увеличивалось количество клеток бронхиального секрета с аргентофинными ядрами и ядрышками. На поверхности слизистых оболочек бронхов легких крыс при сочетании ЧМТ и СВ, а также в бронхиальном секрете выявлялись многослойные скопления эндотелин-1 и CD14 позитивных клеток с аргентофильными ядрышками (рисунок).
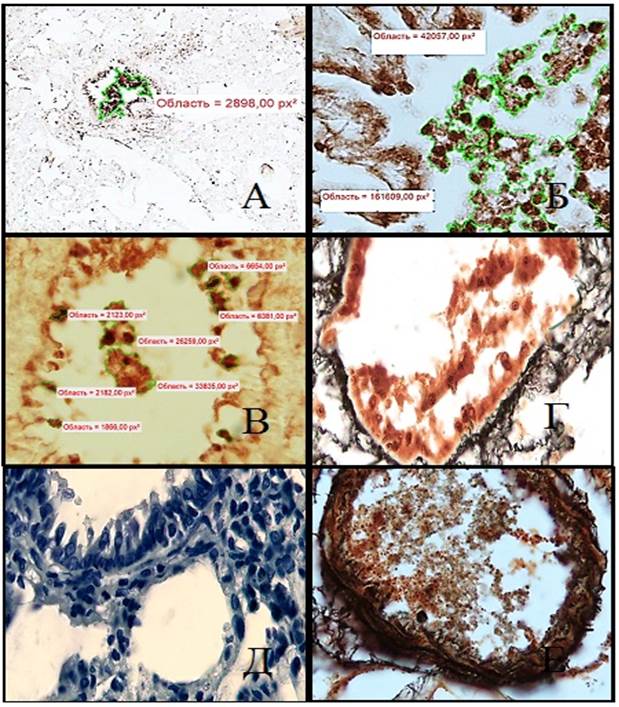
Бронхи легкого травмированных крыс при системном воспалении, 6-й день эксперимента. Бронхиальный секрет с наличием CD14 позитивных клеток в бронхах 4-го (А), 3-го порядков (Б) и клеток, содержащих эндотелин-1 (В) с выделенными областями для морфометрии. Стенка бронха 4 порядка с аргирофильными волокнами и секретом, содержащим клетки (Г). Клетки Клара и нереснитчатый кубический эпителий в бронхе 4-го порядка (Д). Эритроциты с гранулами в бронхиальной артерии (Е). А, Б, В – иммуногистохимическое окрашивание; Г, Е – метод Фута. Д – толуидиновый синий; ув. х1000 а. А – ув. х1000; Б, В, Г, Д, Е – ув. х1000
В легких этих крыс обнаружена частичная обтурация (25–50%) просвета дистальных бронхов (табл. 2). Учитывая сложный характер бронхиального дерева у крыс, авторами было изучено строение терминальных бронхиол (бронхов 4-го порядка), где встречаются клетки Клара в покровном эпителии. Эти клетки имеют булавовидное тело, что отличает их от кубического нереснитчатого эпителия, а их апикальная часть возвышается над ним, формируя второй ряд клеток. В легких травмированных крыс при СВ на поверхности терминальных бронхиол было обнаружено достоверное уменьшение процентного содержания клеток Клара и отмечалась тенденция к понижению их высоты с уменьшением размера ядер.
Таблица 2
Показатели морфометрии тканей легкого животных на 4-й день после начала эксперимента
|
Показатель |
1-я группа (n=6) |
2-я группа (n=6) |
3-я группа (n=6) |
4-я группа (n=6) |
|
Длина ядра клеток Клара, мкм |
9,30±0,49 |
9,1±0,6 (2–4)* |
8,7±0,3 (3–4)* |
7,2±0,34 (1–4)** |
|
Высота клеток Клара, мкм |
23,0±0,98 |
22,0±1,29
|
21,0±2,1
|
18,25±1,04 (1-4)** |
|
Длина ядра клеток кубического бронхиального эпителия, мкм |
8,71 ±0,328 |
8,2 ±0,45
|
8,32 ±0,26
|
7,42±0,32 (1–4)* |
|
Длина клеток нереснитчатого кубического бронхиального эпителия, мкм |
17,58±0,5 |
17,2±0,35 (2-4)** |
16,6±0,44 (3-4)* |
13,39±0,71 (1-4)*** |
|
Обтурация аргирофильными клетками бронхиального секрета ВБ, % |
0,01±0,01 |
0,01±0,01 (2–4)* |
0,01±0,01 (3–4)*** |
15±2% (1–4)*** |
|
Диаметр бронхов 3-го порядка, мкм |
280,3±8,2 |
265,6±10,4
|
270,2±9,8 (3–4)* |
238,5±8,6 (1–4)** |
|
Диаметр бронхов 4-го порядка, мкм |
275,2±7,9 |
263,7±5,7 (2–4)* |
282,9±11,6 (3–4)** |
234,6±8,3 (1–4)** |
|
Толщина базального аргирофильного слоя стенки дистальных бронхов, мкм |
3,99±0,5 |
4,44±0,6 (2–4)** |
4,75±0,5 (3–4)** |
7,63 ±0,4 (1–4)*** |
|
Толщина аргирофильных волокон, мкм |
1,26±0,1 |
1,33±0,1 |
1,47±0,1
|
2,03±0,23 (1–4)* |
|
Средняя оптическая плотность аргирофильных волокон/ пиксель |
1,028±0,053 |
1,16±0,06 (2–3)* |
1,11±0,05 (3–4)* |
1,503±0,12 (1–4)*** |
|
Количество клеток в бронхиальном секрете в поле зрения |
5,4±0,68 |
6,6±0,7 (2–4)** |
7,2±0,9 (3–4)** |
11,3±0,8 (1–4)*** |
|
Площадь позитивной реакции на CD14/ пиксель |
0,67±0,012 |
0,63±0,01 (2–4)* |
0,69±0,01 (3–4)* |
0,729±0,02 (1–4)** |
|
Площадь позитивной реакции на эндотелин-1/ пиксель |
0,397±0,024 |
0,4 ±0,02 (2–4)* |
0,418±0,02 (3–4)* |
0,482±0,01 (1–4)** |
Примечание: 1-я группа – животные без нанесения ЧМТ и введения пирогенала; 2-я группа – животные после нанесения ЧМТ; 3-я группа – животные, которым троекратно вводили пирогенал в дозе 33,3 мкг/мл на 1-е, 3-и, 4-е сутки; 4-я группа – травмированные животные, которым троекратно вводили пирогенал в дозе 33,3 мкг/кг на 1-е, 3-и, 4-е сутки; достоверное различие между показателями для 1-й группы и 2-й, 3-й, 4-й групп при * p<0,05, ** p<0,01, *** p<0,001.
Клиническое заключение о наличии СВ дается при определении таких симптомов, как повышение более 38°С либо понижение менее 36°С температуры тела, частота сердечных сокращений больше 90 в 1 минуту, частота дыхательных движений более 20 в 1 минуту, PaCO2 в крови менее 32 мм рт. ст., количество лейкоцитов в формуле крови более 12х109/л или менее 4х109/л и незрелых форм гранулоцитов более 10% [1]. Для моделирования СВ на животных используют эндотоксины бактерий (липополисахарид, пирогенал) по причине их пирогенных и цитотоксических свойств и появления компенсированости структурных изменений в тканях, которые происходят в ответ на введение доз, значительно (до 300 раз) превышающих стандартные (МПД – 0,0075±0,0025 мкг на 1 кг веса кролика) [7]. Авторами установлено, что у травмированных животных при введении пирогенала отмечается компенсированный характер реакции тканей воздухоносных путей при отсутствии метахромазии волокон соединительной ткани легких. Получены данные об уменьшении внутреннего диаметра просвета дистальных ВБ у этих крыс. При этом тенденция к развитию бронхоспазма происходила на фоне накопления секрета в воздухоносных путях на 6-й день эксперимента. Отмечалось дистрофическое паренхиматозное изменение строения бронхиального эпителия терминальных бронхиол при ЧМТ и СВ. Воспалительный характер реакций дистальных воздухоносных путей подтверждался наличием СD14 и эндотелин-1 позитивных клеток, что указывает на повышенное содержание макрофагов в бронхиальном секрете и наличие биосинтеза эндотелина-1 клетками воспаления, как и сообщалось другими исследователями ранее [7]. Также необходимо отметить участие аргирофильных волокон стенок дистальных ВБ в формировании патологических реакций органов дыхания при сочетании ЧМТ и СВ. Показано, что ретикулярные (коллаген III типа) и преколлагеновые аргирофильные волокна принимают участие в формировании соединительной ткани стенки бронхов и альвеол как в норме [8], так и при коронавирусной инфекции и идиопатическом фиброзе легких [9]. В нашем эксперименте у травмированных крыс при СВ выявлялись соединительнотканные волокна до 2,5 мкм толщиной, функцией которых является взаимодействие с прилегающими структурами адвентиция.
Заключение. При экспериментальном моделировании сочетания ЧМТ и СВ в легких животных обнаруживаются уменьшение диаметра просвета дыхательных путей, структурные изменения дистальных бронхов и высокое содержание в их секрете эндотелин-1 и CD14 позитивных клеток на фоне увеличения толщины аргирофильных соединительнотканных волокон стенки дистальных воздухоносных путей.
Библиографическая ссылка
Зиновьев С.В., Плехова Н.Г., Шуматов В.Б. СТРУКТУРНЫЕ ИЗМЕНЕНИЯ ЛЕГКИХ КРЫС В УСЛОВИЯХ СОЧЕТАНИЯ ЧЕРЕПНО-МОЗГОВОЙ ТРАВМЫ И СИСТЕМНОГО ВОСПАЛЕНИЯ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32843 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32843



