Сердечно-сосудистые заболевания давно признаются мировым сообществом как проблема, достигшая масштабов пандемии. Научные эпидемиологические исследования как в России, так и во всем мире постоянно демонстрируют глобальную распространенность среди населения разных возрастных групп ишемической болезни сердца и инфаркта миокарда, фиксируя высокую долю смертности и инвалидизации от этих заболеваний. При ОИМ часто возникают НРС различных видов и градаций [1]. ОИМ вызывает тяжелую дисфункцию левого желудочка (ЛЖ), которая может сохраняться даже после успешной реперфузионной терапии. Дисфункция ЛЖ в дальнейшем может привести к увеличению числа смертей как от застойной сердечной недостаточности, так и от внезапной сердечной смерти, которая вызвана жизнеугрожающими аритмиями, такими как фибрилляция желудочков и устойчивая желудочковая тахикардия [2, 3].
Фибрилляция предсердий (ФП) является самым распространенным видом нарушений ритма сердца у пациентов со структурным заболеванием сердца и без таковых. По некоторым данным, у 20–30% больных ФП предшествует острый коронарный синдром с подъемом сегмента ST, а у 70–80% больных она развивается во время ИМ [4]. 35% летальных исходов приходится на пациентов с сердечно-сосудистыми заболеваниями, сопровождающимися ФП [5, 6].
Трепетание предсердий (ТП) является вторым по распространенности видом нарушений ритма сердца по встречаемости после ФП и часто сочетается с ней. По некоторым данным отмечено, что частота регистрации ТП увеличивается у пациентов при острых состояниях в среднем на 60% [7].
Стоит отметить, что фибрилляцией желудочков обусловлено большинство смертей. По некоторым данным, частота встречаемости фибрилляции желудочков (ФЖ) у пациентов, перенесших ОИМ, составляет 4,7%. Более 90% пациентов с ФЖ погибают еще на догоспитальном этапе [8]. По данным некоторых исследований, у больных, перенесших ОИМ и имеющих редкие монотопные, поздние желудочковые экстрасистолы (ЖЭ), частота встречаемости ФЖ составляла 4,1%. Если аналогичные нарушения ритма сердца в виде ЖЭ наблюдались чаще, более 1 в минуту, риск мерцания желудочков увеличивался до 8% [9].
Около 5% случаев аритмий при инфаркте миокарда развивается во время реперфузионного повреждения сердечной мышцы в результате избыточной генерации свободных радикалов кислорода в ишемизированной такни на фоне реоксигенации, что приводит к возникновению аномального или усиленного автоматизма и триггерной активности [10].
Кроме электрофизиологических механизмов возникновения аритмий, стоит уделить особое внимание нарушению нейрогуморальной регуляции в патогенезе аритмий. В настоящее время незаслуженно мало внимания уделяется стрессу как триггеру возникновения аритмий [11]. Установлено, что в остром периоде ИМ возникает дисбаланс в нейрогуморальной регуляции сократимости и проводимости миокарда, выражающийся в повышении тонуса симпатической нервной системы и снижении активности парасимпатической нервной системы. Кроме того, с целью поддержания адекватной насосной функции сердца и реактивности сосудов концентрация катехоламинов в крови неуклонно растет. Комплексное влияние активированной симпатической нервной системы и катехоламинов приводит к апоптозу кардиомиоцитов и замещению их соединительной тканью, которая является аритмогенным субстратом [12].
Антагонистом стресс-реализующей системы является стресс-лимитирующая система, которая отвечает на стресс адаптационной реакцией, направленной на поддержание гомеостаза и сохранения жизнедеятельности организма. К стресс-лимитирующей системе относятся опиоидные пептиды, ГАМК-ергическая система, парасимпатическая нервная система и антиоксидантная защита [13]. Опиоидергическая система оказывает защитное влияние на организм, снижая воздействие стрессового, повреждающего фактора путем выделения опиоидных пептидов, таких как эндорфины, энкефалины, динорфины. Многими исследованиями установлено, что опиоидная система принимает непосредственное участие в работе сердца и сосудов, так как в этих органах были обнаружены опиоидные рецепторы [14].
В медицинской практике до сих пор вызывают интерес опиоидные пептиды, несмотря на то, что история их применения насчитывает тысячелетия. Однако вследствие наличия у препаратов опиоидных пептидов множества противопоказаний и ограничений в применении частое использование и назначение высоких дозировок невозможны.
Существует большое количество методов лечения аритмий, как медикаментозных, так и немедикаментозных. Однако, несмотря на широкий арсенал антиаритмических препаратов и немедикаментозных методов лечения, остается нерешенным вопрос адекватной и безопасной терапии аритмий. Существующие на сегодняшний момент методы лечения аритмий обладают широким спектром противопоказаний и побочных эффектов.
В связи с большим числом сердечно-сосудистых заболеваний, в частности ишемических повреждений миокарда, и высоким риском возникновения жизнеугрожающих аритмий до сих пор остается актуальным вопрос повышения эффективности профилактики и лечения этих осложнений.
Транскраниальная электростимуляция (ТЭС) на сегодняшний день является единственным методом, обеспечивающим увеличение концентрации в крови опиоидных пептидов. ТЭС-терапия нашла широкое применение в медицине, и наша задача заключается в изучении антиаритмогенного влияния опиоидных пептидов на ишемизированный миокард.
Цель исследования – обоснование антиаримогенного эффекта опиоидных пептидов у пациентов с впервые выявленными НРС после проведения ЧТКА со стентированием инфаркт-связанной артерии при ОИМ.
Материалы и методы исследования
В нерандомизированное исследование был включен 41 пациент (средний возраст пациентов составлял 62,1±9,6 года), поступивших в стационар с диагнозом ОИМ. Пациентам исследуемых групп была проведена чрескожная транслюминальная, коронарная ангиопластика со стентированием инфаркт-связанной артерии и впервые выявленными нарушениями ритма сердца. Все пациенты в порядке поступления в стационар разделены на две группы. Первая группа – группа сравнения (n=21): пациентам проводилась стандартная терапия ОИМ. В основной группе пациентов № 2 (n=20), кроме стандартной терапии ОИМ, пациентам выполнялись сеансы ТЭС-терапии. Весь период исследования, он же период пребывания в стационаре, был отмечен 3 контрольными точками: 1-я контрольная точка – при поступлении, 2-я контрольная точка – 5-е сутки пребывания в стационаре и 3-я контрольная точка – 10-е сутки госпитализации.
Критериями исключения были:
1) добровольный отказ от проводимого исследования на любом из его этапов;
2) пациенты, имеющие постоянные формы НРС;
3) пациенты с имплантированными электростимуляторами;
4) пациенты, имеющие клапанные заболевания сердца, влияющие на гемодинамику;
5) пациенты, постоянно принимающие антиаритмические лекарственные препараты;
6) пациенты с низкой фракцией выброса – менее 20%;
7) пациенты, имеющие противопоказания к выполнению ТЭС-терапии;
8) пациенты в терминальном состоянии и крайне тяжелом состоянии (шок, кома);
9) дебют острого инфекционного заболевания в период госпитализации;
10) проведение системной тромболитической терапии.
В трех контрольных точках пациентам обеих групп были выполнены: коронарная ангиография и чрескожная транслюминальная ангиопластика со стентированием инфаркт-связанной артерии, трансторакальная эхокардиография (в день госпитализации в стационар), запись ЭКГ в 12 отведениях при скорости лентопротяжения 25мм/с, забор образцов крови с целью определения кардиоспецифических ферментов (креатинфосфокиназы – КФК, креатинфосфокиназы-МВ – КФК-МВ, тропонин I). Для определения концентрации β-эндорфина производился забор венозной крови в вакуумные пробирки Univac в объеме 5мл. Далее проводилось центрифугирование в центрифуге ELMI СМ – 6 со скоростью 1000 оборотов в течение 30минут. Полученные образцы сыворотки распределялись в микропробирки типа Эппендорф 1,5 мл и замораживались при –80°С. Концентрацию β-эндорфина измеряли в сыворотке крови с использованием тест-системы для иммуноферментного анализа (CEA806Hu, ELISA Kit for Beta-Endorphin, Cloud-Clone, Китай).
Методика проведения ТЭС-терапии. ТЭС-терапия проводилась всем пациентам из основной группы ежедневно по одному сеансу в сутки с момента их госпитализации до выписки из стационара с помощью двухпрограммного электростимулятора «ТРАНСАИР-03» (ООО «Центр транскраниальной электростимуляции», Санкт-Петербург). Пациентам основной группы выполнено 10 сеансов ТЭС-терапии с фронто-мастоидальным наложением электродов и частотой 1 сеанс в сутки в следующих биполярных импульсных режимах: с силой тока 2 мА, частотой 77,5 Гц и продолжительность сеанса 15–45мин. Режимы стимуляции подбирали индивидуально, основываясь на субъективных ощущениях пациента.
Для выполнения статистического анализа использовалось компьютерное программное обеспечение IBM SPSS Advanced Statistics 28.0.1.0. Для сравнения групп по количественным переменным использовали непараметрические тесты: U-тест по методу Mann–Whitney. Межгрупповые различия считались статистически значимыми при уровне ошибки p<0,05. Для оценки категориальных переменных использовали точный критерий Фишера или х2 критерий Пирсона (для таблиц сопряженности). Анализ выживаемости был описан методом Каплана–Мейера. Внутригрупповой анализ по трем контрольным точкам выполнен с использованием критерия Краскелла–Уоллиса.
Результаты исследования и их обсуждение
Пациенты обеих групп поступали в стационар с предварительным клиническим диагнозом: ИБС, острый коронарный синдром с подъемом (без подъема) сегмента ST. Далее на основании жалоб, анамнеза, данных физикальных исследований, лабораторных и инструментальных данных сформулирован окончательный клинический диагноз – острый инфаркт миокарда (Q-позитивный / Q-негативный) и локализация ишемического повреждения сердечной мышцы.
Исследование пациентов по основным клинико-демографическим показателям: возраст, половая принадлежность, сопутствующие заболевания, стаж курения, показатели среднего АД и ЧСС, ИМТ, тип стентированной артерии (х2 критерий Пирсона, р=0,354), а также количество стентов (х2 критерий Пирсона, р=0,354) – не обнаружило значимых межгрупповых различий, что позволяет судить об однородности и сопоставимости групп пациентов.
У всех пациентов после выполнения чрескожной транслюминальной коронарной ангиопластики были диагностированы нарушения ритма и проводимости, ранее по анамнезу и медицинской документации НРС не отмечалось. Типы НРС внутри групп распределились следующим образом (табл. 1).
Таблица 1
Характеристика исследуемых групп по НРС при поступлении
|
|
Наджелудочковые экстрасистолы |
Желудочковые экстрасистолы |
Фибрилляция предсердий |
|||
|
Группы |
абс. |
% |
абс. |
% |
абс. |
% |
|
1-я группа |
2 |
10,0 |
9 |
45,0 |
9 |
45,0 |
|
2-я группа |
0 |
0 |
12 |
57,1 |
9 |
42,9 |
В исследуемых группах значимых различий по соотношению типов НРС не обнаружено – х2-Пирсона, р=0,300.
В середине лечения в обеих группах наблюдается восстановление синусового ритма сердца, однако в основной группе правильный ритм сердца превалирует по сравнению с группой № 1. К середине лечения практически у всех пациентов, получающих ТЭС-терапию, отмечался синусовый ритм сердца. Во время статистического анализа получено значение р=0,081 (точный критерий Фишера), отмечаются межгрупповые различия на уровне статистической тенденции (табл. 2).
Таблица 2
Характеристика исследуемых групп по НРС в середине лечения
|
|
Синусовый ритм |
Желудочковые экстрасистолы |
Фибрилляция предсердий |
|||
|
Группы |
абс. |
% |
абс. |
% |
абс. |
% |
|
1-я группа |
15 |
75 |
1 |
5 |
4 |
20 |
|
2-я группа |
20 |
92,5 |
1 |
4,8 |
0 |
0 |
К концу госпитализации у всех пациентов, получающих ТЭС-терапию, произошло восстановление ритма сердца. В группе сравнения у 3 пациентов было зарегистрировано НРС в виде ФП. Однако статистической межгрупповой разницы не было обнаружено (х2 критерий Пирсона, р=0,107) (табл. 3).
Таблица 3
Характеристика исследуемых групп по НРС в конце лечения
|
|
Синусовый ритм |
Фибрилляция предсердий |
||
|
Группы |
абс. |
% |
абс. |
% |
|
1-я группа |
17 |
85 |
3 |
7,3 |
|
2-я группа |
21 |
100 |
0 |
0 |
При анализе скорости восстановления ритма сердца в обеих группах в днях обнаружено, что ритм сердца в основной группе пациентов, получающих ТЭС-сеансы, восстанавливался быстрее: основная группа – 2 дня (2,0–3,5), группа сравнения – 3,5 дня (2,25–5,75), р=0,008.
Согласно анализу выживаемости Каплана–Мейера, восстановление ритма сердца к концу лечения наблюдалось у всех пациентов основной группы, тогда как у пациентов группы сравнения регистрировались нарушения ритма сердца. Также была выявлена тенденция к более быстрому восстановлению ритма сердца в группе пациентов, получающих ТЭС-терапию (рис. 1).
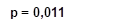
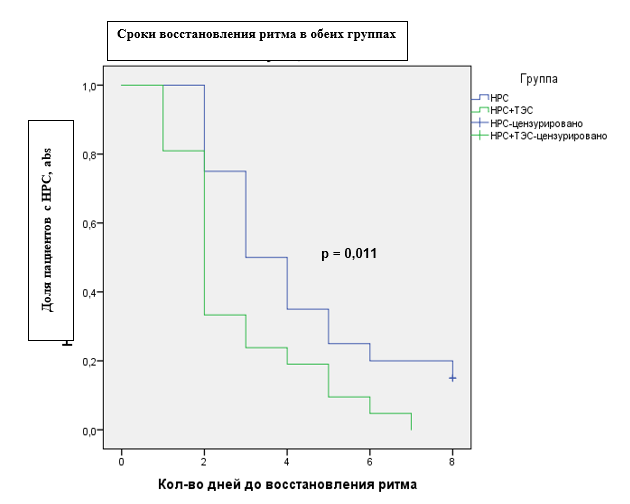
Рис. 1. Сроки восстановления ритма сердца в исследуемых группах. Log Rank (Mantel-Cox)
В нашем исследовании у ТЭС-терапии был выявлен кардиопротективный эффект в виде более быстрого снижения концентрации в крови маркеров альтерации миокарда, а также стресс-лимитирующий эффект, проявляющийся более высокими показателями β-эндорфина в основной группе.
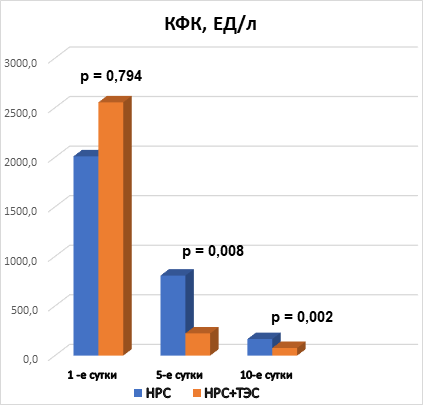
Рис. 2. Межгрупповая динамика КФК, ЕД/л
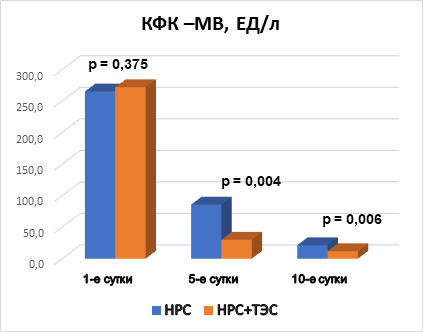
Рис. 3. Межгрупповая динамика КФК-МВ, ЕД/л
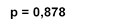
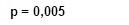
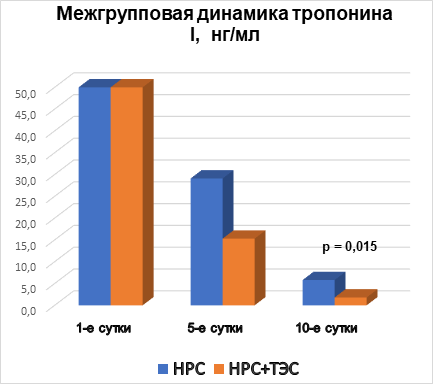
Рис. 4. Межгрупповая динамика тропонина I, нг/мл
Анализируя показатели КФК, КФК-МВ и тропонина I в динамике на 1-е, 5-е и 10-е сутки госпитализации, можно отметить, что при поступлении в стационар межгрупповых различий по всем показателям не выявлено, что говорит об однородности групп. На 5-е и 10-е сутки выявлены статистически значимые различия (р<0,05). Это свидетельствует о том, что у пациентов, получающих ТЭС-терапию, отмечаются более низкие показатели маркеров альтерации миокарда (рис. 2, 3, 4). При этом на 10-е сутки показатели КФК, КФК-МВ достигают нормальных уровней. Однако концентрация тропонина I все еще остается выше нормы, но у пациентов, получающих ТЭС-сеансы, концентрация высокочувствительного тропонина I статистически значимо меньше, чем в группе сравнения (р=0,015) (рис. 2, 3, 4).
Также была выполнена оценка содержания β-эндорфина в динамике у пациентов обеих групп. Межгрупповой статистический анализ показал, что при поступлении группы пациентов были однородны, во второй контрольной точке у пациентов основной группы концентрация β-эндорфина была выше на 39%, в третьей контрольной точке – на 39,5% по сравнению с уровнем эндорфина у пациентов группы сравнения (рис. 5). Стоит отметить, что концентрация β-эндорфина в основной группе пациентов, получающих сеансы ТЭС-терапии, оставалась на стабильно высоком уровне на протяжении всего периода исследования.
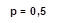
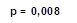
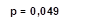
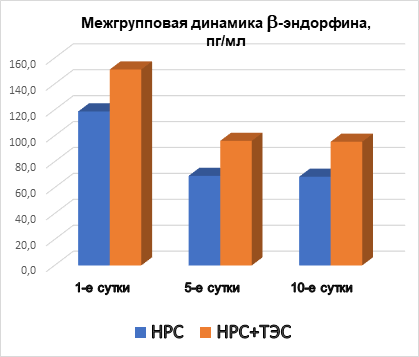
Рис. 5. Межгрупповая динамика b-эндорфина, пг/мл
Таким образом, использование ТЭС-терапии положительно влияет на восстановление сердечного ритма, оказывая стресс-лимитирующее действие на организм через механизм усиления опиоидергического влияния.
Выводы
1. Применение ТЭС-терапии у пациентов с ОИМ и НРС доказало свое антиаритмогенное влияние на миокард в условиях ишемии, путем повышения опиоидных пепетидов и снижения симпатических влияний на миокард. У всех пациентов основной группы произошло восстановление синусового ритма, а в группе сравнения, где пациенты не получали сеансы ТЭС-терапии, у 7,3% больных нормализации ритма сердца не было достигнуто.
2. Применение ТЭС-терапии в сочетании со стандартным лечением пациентов с НРС, впервые возникшими после выполнения ЧТКА при ОИМ, сопровождалось статистически значимым ростом сывороточной концентрации бета-эндорфина на 5-е (39%, р=0,008) и 10-е сутки наблюдения (39,5%, р=0,049), по отношению к показателям группы сравнения.
3. Применение ТЭС-терапии в сочетании со стандартным лечением пациентов с НРС, впервые возникшими после выполнения ЧТКА при ОИМ, сопровождалось статистически значимым уменьшением сывороточной концентрации маркеров альтерации миокарда по отношению к показателям группы сравнения. В основной группе показатели концентрации КФК на 5-е сутки ниже на 72,2% (р=0,008), на 10-е сутки – ниже на 54% (р=0,002); показатели концентрации КФК-МВ на 5-е сутки были ниже на 65% (р=0,004), на 10-е сутки – на 44,8% (р=0,006); концентрация тропонина I – на 5-е сутки ниже на 30,1% (р=0,005), на 10-е сутки – на 69% (р=0,015) по отношению к группе сравнения.
4. Использование ТЭС-терапии в комплексном лечении пациентов, перенесших ОИМ с впервые выявленными НРС, улучшает прогноз в результате восстановления ритма сердца в более короткий промежуток времени, а также предотвращает повторные эпизоды аритмий, что также приводит к сокращению сроков госпитализации.
5. ТЭС-терапия у пациентов с ОИМ, осложненным НРС, оказывает кардиопротективное действие, что подтверждается уменьшением содержания кардиоспецифических ферментов, а также поддержанием оптимального уровня опиоидных пептидов в крови на фоне повышенной активности стресс-реализующей системы.
Библиографическая ссылка
Сорокина Е.А. АНТИАРИТМОГЕННОЕ ВЛИЯНИЕ ОПИОИДНЫХ ПЕПТИДОВ У ПАЦИЕНТОВ, ПЕРЕНЕСШИХ ОСТРЫЙ ИНФАРКТ МИОКАРДА С ВПЕРВЫЕ ВЫЯВЛЕННЫМИ НАРУШЕНИЯМИ РИТМА СЕРДЦА // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32836 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32836



