Известно, что больные, получавшие противоопухолевую терапию, часто сталкиваются с проблемами субфертильности, так как химиотерапия негативно влияет на процесс сперматогенеза, качественный и количественный состав спермиев. Степень нарушения репродуктивной функции варьируется в широких пределах вплоть до бесплодия [1].
Гонадотоксичный эффект противоопухолевой терапии во многом обусловлен смещением равновесия в сторону оксидативного стресса и эндогенной интоксикации с накоплением активных форм кислорода и продуктов липопероксидации, которые пагубно действуют на чувствительные клетки и ткани, в том числе гонады [2-4]. Возникающие изменения последовательности нуклеотидов ДНК, нарушение структуры белков, их аминокислотного состава ведет к развитию мутаций и гибели части клеток [3; 5]. Для снижения системной токсичности используются липосомальные цитостатики, однако концентрация липосомального цитостатика в яичках может быть даже выше, чем свободного препарата [6]. В связи с этим изучение возможности нейтрализации побочных явлений химиотерапии, в том числе гонадотоксичности, с позиций мобилизации антиоксидантной защиты [7] представляется актуальным и обоснованным. В ранее проведенных исследованиях показана эффективность свободной формы этилметилгидроксипиридина сукцината в снижении гонадотоксичности антибластомной терапии в эксперименте [8], однако нет данных о сравнительной эффективности его свободной и липосомальной формы.
Цель исследования. Сравнить эффективность свободного и липосомального этилметилгидроксипиридина сукцината в минимизации гонадотоксичного эффекта липосомальной комбинации цитостатиков (доксорубицин и циклофосфамид) у крыс-самцов с карциномой Walker-256, анализируя изменения показателей сперматогенеза в динамике.
Материал и методы исследования. Эксперименты выполняли на 79 крысах-самцах Wistar (120–230 г), находившихся на базе вивария ФГБОУ ВО «МГУ им. Н.П. Огарёва» при естественном освещении со свободным доступом к корму и воде. Все действия с животными выполняли согласно правилам «Руководства по уходу и использованию лабораторных животных» (Guide for the care and use of laboratory animals) [9]. Клетки штамма карциномы Уокер-256 (106 клеток) инокулировали под кожу хвоста. Применяли официнальные формы доксорубицина гидрохлорида (Ebewe Pharma, Австрия) в дозе 4 мг/кг (в виде 0,04% раствора на изотоническом хлориде натрия), циклофосфамида (Baxter Oncology, Германия) в дозе 45 мг/кг (в виде 0,45% раствора), этилметилгидроксипиридина сукцината («Фармасофт», Россия) в дозах 25 и 50 мг/кг (в виде 5% раствора) в свободной и липосомальной формах. Липосомы получали через гидратацию липидной пленки с использованием роторного испарителя Heidolph (Германия) и экструдера LIPEX (Канада). Очищение липосом от невключившихся препаратов проводили под давлением инертного газа путем ультрафильтрации. Размер липосом оценивали с использованием анализатора размера наночастиц NANO-flex (США). Концентрацию препаратов в липосомах оценивали при помощи спектрофотометра Shimadzu (Япония), которая составила для доксорубицина и циклофосфамида – 1,86 и 21 мг/мл, для этилметилгидроксипиридина сукцината – 25 и 50 мг/мл (для доз 25 и 50 мг/кг соответственно).
В ходе выполнения эксперимента животных рандомизировали на 8 групп, включавших по 7-12 самцов: 1-я группа – интактные крысы (И), 2-я – особи с перевитой карциномой Walker-256 (W) без лечения, 3-я – особи с W, получавшие растворы доксорубицина (4 мг/кг) и циклофосфамида (45 мг/кг) в латеральную хвостовую вену через катетер однократно на 11-е сутки после инокуляции штамма W (W+ДP+ЦФ), 4-я – особи с W, получавшие доксорубицин (4 мг/кг) с циклофосфамидом (45 мг/кг) в липосомах однократно внутривенно в аналогичные сроки после инокуляции штамма W (W+(ДР+ЦФ)л), 5-я – особи с W, получавшие липосомальные цитостатики и свободный этилметилгидроксипиридина сукцинат (ЭС) в дозе 25 мг/кг (W+(ДР+ЦФ)л+ЭС 25), 6-я – крысы с W, получавшие липосомальные цитостатики и свободный ЭС в дозе 50 мг/кг (W+(ДР+ЦФ)л+ЭС 50), 7-я – крысы с W, получавшие липосомальные цитостатики и липосомальный ЭС в дозе 25 мг/кг (W+(ДР+ЦФ)л+ЭС 25л), 8-я группа – крысы с W, получавшие липосомальные цитостатики и липосомальный ЭС в дозе 50 мг/кг (W+(ДР+ЦФ)л+ЭС 50л). Свободный и липосомальный ЭС в обеих дозах вводился в вену ежедневно в течение 5 суток с начала введения цитостатиков.
На 3-и и 7-е сутки после противоопухолевой терапии для 5–7 крыс из каждой группы завершали эксперимент путем дислокации шейных позвонков с последующим проведением микроскопического изучения (100×10) мазков клеточной суспензии тканей семенников после предшествующего окрашивания их по Романовскому - Гимзе [10]. Абсолютные значения спеpматогенных эпителиальных клеток в 1 г ткани тестикул вычисляли путем математических пpопоpций с учетом абсолютного числа спеpматозоидов, подсчет которых проводили в камере Горяева. Статистическую обработку результатов проводили с использованием U-критерия Манна-Уитни. Различия считали достоверными при p<0,05.
Результаты исследования и их обсуждение
На 3-и сутки после химиотерапии количество сперматогоний в группе с применением липосомальных доксорубицина и циклофосфамида (W+(ДР+ЦФ)л) относительно свободной формы данных препаратов (W+ДР+ЦФ) было выше в 10 раз (р<0,001), не отличаясь от интактного показателя (рис. А). Уровень сперматогониальных клеток в группах, где использовался свободный и липосомальный ЭС, также не отличался от интактного показателя.
Число сперматоцитов при применении как свободных, так и липосомальных антибластомных агентов снижалось на 61% и 47,2% соответственно (р<0,01) относительно интактных животных (рис. Б).
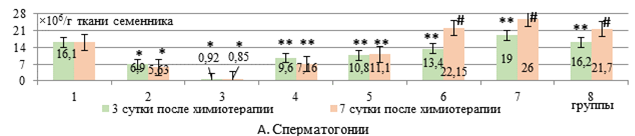
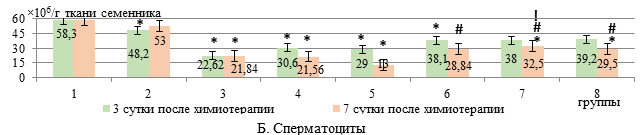
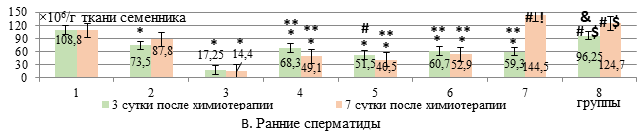
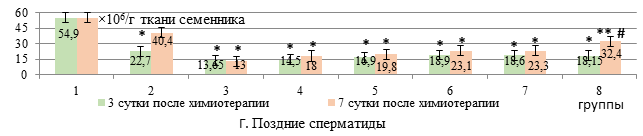
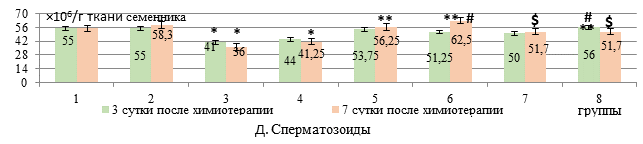
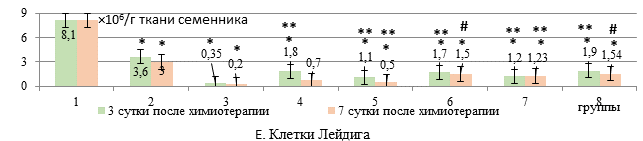
Количественные изменения клеточного состава сперматогенного эпителия (А-Е) у крыс с карциномой Walker-256 при введении липосомального этилметилгидроксипиридина сукцината в сочетании с липосомальными доксорубицином и циклофосфамидом
Примечание: * - различия достоверны (р<0,05) относительно интактных крыс (р<0,05); ** - относительно 3-й группы (W+ДP+ЦФ); # - относительно 4-й группы (W+(ДР+ЦФ)л); ! – относительно 5-й группы (W+(ДР+ЦФ)л+ЭС 25); $ - относительно 6-й группы (W+(ДР+ЦФ)л+ЭС 50); & - относительно 7-й группы (W+(ДР+ЦФ)л+ЭС 25л).
Использование ЭС в свободной и липосомальной форме в исследуемых дозах не оказало значимого влияния на содержание сперматоцитов в сравнении с использованием только цитостатиков.
Количественный состав ранних сперматид снижался на 3-и сутки после введения ДР+ЦФ в свободной форме на 84% (р<0,001) относительно интактных животных, а после использования липосомальных цитостатиков – на 37,2% (р<0,01). На фоне липосомального ЭС в дозе 50 мг/кг число ранних сперматид превышало данный показатель при введении только липосомальных цитостатиков на 41% (р<0,01, рис. В) и не отличалось от интактного параметра. Применение ЭС в липосомах в дозе 50 мг/кг в 1,6 раза эффективнее, чем его использование в «свободной» форме в той же дозе, и липосомального ЭС в дозе 25 мг/кг способствует сохранению числа ранних сперматид.
Число поздних сперматид на 3-и сутки после применения ДР+ЦФ как в свободной, так и в липосомальной форме снижалось на 75% и 73,6% соответственно относительно интактных животных. Дополнительное использование ЭС как в свободной, так и липосомальной формах в исследуемых дозах не приводило к коррекции числа поздних сперматид (рис. Г).
Количество сперматозоидов снижалось только при введении свободной формы цитостатиков – на 25,4% (р<0,05, рис. Д). На фоне липосомального ЭС в дозе 50 мг/кг число сперматозоидов увеличивалось на 36,6% относительно группы со свободной формой цитостатиков и на 27,3% (р<0,05) – относительно группы с липосомальными цитостатиками.
Численность клеток Сертоли не менялась ни в одной из экспериментальных групп.
ДР+ЦФ в свободной форме на 3-и сутки после их введения приводили к снижению числа клеток Лейдига на 95,7% относительно интактных животных (р<0,01). На фоне введения липосомальных цитостатиков число клеток Лейдига снижалось в меньшей степени – на 77,8% относительно интактных крыс, что превышало данный показатель в группе со свободными цитостатиками в 5 раз (р<0,01, рис. Е). При этом дополнительное использование ЭС как в свободной, так и липосомальной формах в исследуемых дозах не способствовало росту числа клеток Лейдига по сравнению с введением только липосомальных ДР+ЦФ.
Таким образом, коррекция показателей сперматогенеза в виде сохранения численности ранних сперматид и количества сперматозоидов на 3-и сутки после введения липосомальных цитостатиков отмечается только при использовании липосомального ЭС в дозе 50 мг/кг.
На 7-е сутки количество сперматогоний в группе с применением липосомальных ДР+ЦФ относительно их свободной формы было выше в 8,4 раза (р<0,001, рис. А).
У животных, которым дополнительно вводился липосомальный ЭС в дозах 25 и 50 мг/кг, фиксировался рост числа сперматогоний в 3,6 и 3 раза (р<0,01) соответственно относительно группы, где использовались только липосомальные цитостатики. Свободная форма ЭС проявила сопоставимый с липосомальной формой эффект лишь в дозе 50 мг/кг, способствуя росту числа сперматогоний также в 3 раза (рис. А).
Схожая динамика изменений отмечалась и в численности сперматоцитов: их количество снижалось на фоне липосомальных цитостатиков на 63% (р<0,01) относительно интактных животных, а дополнительное введение ЭС в липосомах в дозах 25 и 50 мг/кг способствовало росту числа сперматоцитов на 50,7% и 37% соответственно относительно группы, где использовались только липосомальные цитостатики. Свободная форма ЭС проявила сопоставимый с липосомальной формой эффект лишь в дозе 50 мг/кг, на фоне которой число сперматоцитов возрастало на 32% (р<0,05, рис. Б).
Количество ранних сперматид на 7-е сутки после введения липосомальных ДР+ЦФ было снижено на 55% (р<0,01) относительно интактных животных, но превышало этот показатель при использовании свободных цитостатиков в 3,4 раза (р<0,01). Применение липосомальной формы ЭС в дозе 25 мг/кг увеличивало число ранних сперматид в 2,9 раза, а в дозе 50 мг/кг – в 2,5 раза (р<0,01, рис. В) относительно введения только липосомальных цитостатиков, восстанавливая, таким образом, численность ранних сперматид до интактного уровня.
Количество поздних сперматид при введении липосомальных ДР+ЦФ было снижено на 67% относительно интактных животных (р<0,05), как и при использовании свободной формы цитостатиков (на 76%). Прирост численности поздних сперматид отмечался только на фоне дополнительного введения липосомального ЭС в дозе 50 мг/кг – на 80% по сравнению с использованием только липосомальных цитостатиков (р<0,05).
Число сперматозоидов на 7-е сутки после введения липосомальных ДР+ЦФ снижалось на 25% относительно интактных крыс (р<0,05), как и при использовании свободной формы цитостатиков. Увеличение количества сперматозоидов относительно липосомальных цитостатиков отмечалось на фоне свободной формы ЭС в дозе 50 мг/кг – на 51,5% (р<0,01).
Несмотря на сохранную численность клеток Сертоли с тенденцией к ее уменьшению в группе с введением липосомальных цитостатиков, использование липосомального ЭС в обеих исследуемых дозах способствовало росту числа клеток Сертоли в среднем на 90% (р<0,05) по сравнению с введением только липосомальных доксорубицина и циклофосфамида.
Число клеток Лейдига на 7-е сутки после введения липосомальных цитостатиков было снижено на 91% относительно интактных животных, но превышало этот показатель в группе с использованием свободной формы цитостатиков в 3,5 раза (р<0,05). Рост числа клеток Лейдига отмечался на фоне ЭС в дозе 50 мг/кг, причем как в свободной, так и липосомальной форме – в 2 раза (р<0,05) относительно введения только липосомальных цитостатиков.
Таким образом, использование липосомальной комбинации ДР+ЦФ к 7-м суткам после химиотерапии характеризуется большей численностью сперматогоний (в 8,4 раза) и ранних сперматид (в 3,4 раза), а также клеток Лейдига (в 3,5 раза) в тестикулярной ткани по сравнению с введением свободной формы цитостатиков, что свидетельствует о менее выраженном супрессивном влиянии липосомальной формы антибластомных агентов на процессы сперматогенеза. Свободный ЭС в дозе 50 мг/кг, в отличие от 25 мг/кг, оказывает значимое корригирующее влияние на цитологические показатели сперматогенеза на 7-е сутки после введения липосомальной комбинации ДР+ЦФ, способствуя нарастанию числа сперматогоний в 3 раза, сперматоцитов – на 33%, сперматозоидов – на 51,5% и клеток Лейдига – в 2 раза. Липосомальный ЭС в дозе 25 мг/кг сопоставимо с дозой 50 мг/кг способствует росту количества сперматогоний в тестикулярной ткани к 7-м суткам после введения липосомальных цитостатиков в среднем в 3,3 раза, сперматоцитов – на 44%, ранних сперматид – в 2,7 раза и клеток Сертоли – на 90%, однако уступает дозе 50 мг/кг в коррекции числа поздних сперматид и клеток Лейдига.
Заключение. Таким образом, липосомальный этилметилгидроксипиридина сукцинат в дозах 25 и 50 мг/кг, в отличие от обычной формы в аналогичных дозах, способствует сохранению численности ранних сперматид, увеличивая их количество в тестикулярной ткани в 2,9 и 2,5 раза соответственно у крыс с карциномой Walker-256 на 7-е сутки после терапии липосомальными доксорубицином и циклофосфамидом. Липосомальный этилметилгидроксипиридина сукцинат в дозе 25 мг/кг, в отличие от его свободной формы в этой же дозе, способствует росту числа сперматоцитов на 50,7% на 7-е сутки после введения липосомальных цитостатиков. При этом липосомальный этилметилгидроксипиридина сукцинат в обеих исследуемых дозах, в отличие от свободной формы, способствует росту числа клеток Сертоли в среднем на 90%. Однако наиболее эффективная картина в коррекции сперматогенеза после введения липосомальной комбинации доксорубицина и циклофосфамида отмечается на фоне липосомального этилметилгидроксипиридина сукцината в дозе 50 мг/кг: рост численности ранних сперматид (на 41% относительно введения только липосомальных цитостатиков) отмечается уже на 3-и сутки после химиотерапии, а на 7-е сутки – на 80% нарастает количество поздних сперматид и в 2 раза – клеток Лейдига.
Библиографическая ссылка
Сипров А.В., Шубин Д.Ю., Агеев В.П., Гололобова И.А., Акмаева И.А., Хамидов Д.Х., Шиндяйкина В.С. ВЛИЯНИЕ СОЧЕТАННОГО ПРИМЕНЕНИЯ ЛИПОСОМАЛЬНЫХ ФОРМ ЦИТОСТАТИКОВ И ЭТИЛМЕТИЛГИДРОКСИПИРИДИНА СУКЦИНАТА НА ПОКАЗАТЕЛИ СПЕРМАТОГЕНЕЗА У КРЫС С ЭКСПЕРИМЕНТАЛЬНОЙ НЕОПЛАЗИЕЙ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32825 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32825



