В последние годы хроническая болезнь почек (ХБП) приобретает характер неинфекционной эпидемии. Количество пациентов с терминальной стадией (тХБП) прогрессивно увеличивается и к 2030 году, по прогнозам ВОЗ, составит 5,4 млн человек [1]. Применение гемодиализа, с одной стороны, спасает и продлевает жизнь пациентов, с другой - требует дополнительных исследований, направленных на улучшение качества жизни и поиска факторов, связанных с формированием неблагоприятного течения, прогноза и исхода тХБП [2]. Многочисленные исследования посвящены этим вопросам, однако истинный вклад различных, ассоциированных с ХБП патологий, до сих пор не ясен [3-5]. Известно, что одним из органов-мишеней при ХБП является щитовидная железа (ЩЖ) [1]. Наиболее часто выявляемыми функциональными нарушениями ЩЖ у пациентов с тХБП на ЗПТ являются субклинический гипотиреоз (СГ) и синдром эутиреоидной патологии (СЭП), а именно синдром «низкого Т3» [6-8]. Снижение функциональной активности ЩЖ, возможно, не отражает заболевание ЩЖ, а является неким лабораторным феноменом у пациентов с тХБП на ЗПТ, но тем не менее наличие гипотиреоза ассоциировано с неблагоприятными прогнозами [1; 8]. Поэтому изучение показателей тиреоидного статуса у больных с тХБП на ЗПТ представляется актуальным.
СЭП представлен в основном синдромом «низкого Т3» [6-8], обусловленного периферическими изменениями метаболизма и транспорта тиреоидных гормонов в отсутствии заболеваний ЩЖ. Также известно, что синдром «низкого Т3» ассоциирован с неблагоприятными исходами, недостаточностью эффективности гемодиализа, отражает тяжесть соматической патологии и плохой прогноз у таких пациентов [6; 9; 10]. Более того, ряд авторов также подтверждает взаимосвязь низких концентраций свТ3 с риском смертности от всех причин у пациентов, получающих терапию ПГД [6]. Синдром «низкого Т3» рассматривают в качестве независимого предиктора смерти при тХБП. Отсутствие единого мнения о клинической значимости синдрома «низкого Т3», механизмах формирования и его взаимосвязях с неблагоприятными исходами при тХБП порождает широкие дискуссии и требует уточнения.
Для пациентов с тХБП на терапии ПГД характерна не только высокая распространенность функциональных нарушений щитовидной железы, но и ее структурных изменений. Известно, что ТТГ является стимулятором роста тироцитов [11], в связи с чем полагают, что повышение его концентрации, диагностируемое у пациентов с тХБП на ПГД чаще, чем в общей популяции, может быть одной из причин высокой выявляемости структурных изменений ЩЖ в этой группе больных. Однако его роль в механизмах формирования гиперпластических и неопластических процессов при тХБП до конца не изучена. Современная ультразвуковая классификация EU-THIRADS [12], введенная в 2021 году, позволяет не проводить ТАБ пациентам с эхографической картиной EU-THIRADS 1-2 и требует проведения ТАБ узловых образований ЩЖ лишь при УЗ-изменениях, характерных для EU-THIRADS 3-5. При этом пациенты с тХБП не являются исключением с учетом более высокого риска злокачественных новообразований. На сегодняшний день не уточнена категория рисков возникновения тиреоидного рака у пациентов с тХБП, а также его вклад в выживаемость при тХБП, что требует проведения дополнительных исследований.
В связи с вышесказанным целью нашей работы явилось изучение структурных изменений ЩЖ и концентраций тиреоидных гормонов у пациентов с тХБП, получающих терапию ПГД.
Материалы и методы исследования
Проанализированы истории 185 пациентов с тХБП на ЗПТ ПГД. Критериями исключения были тяжелые соматические, онкологические и психиатрические заболевания, гипертиреоз, а также применение левотироксина, трийодтиронина, амиодарона, глюкокортикостероидов, наличие хирургических вмешательств на ЩЖ и терапии радиоактивным йодом в анамнезе.
Результаты лабораторного тестирования показали, что 59,4% пациентов (110 человек из 185) с тХБП, корригируемой ПГД, имеют измененный тиреоидный профиль: СГ выявлялся в 18,9% случаев (35 человек), манифестный гипотиреоз в – 2,2% случаев (4 человека), субклинический тиреотоксикоз в – 5,4% случаев (10 человек), синдром «низкого Т3» в – 33% случаев (61 человек). Больные с тиреотоксикозом и манифестным гипотиреозом далее были исключены из исследования в связи с недостаточной выборкой. Таким образом, в исследование был включен 171 пациент.
Всем пациентам оценивали в сыворотке крови уровни ТТГ, свободного трийодтиронина (свТ3), свободного тироксина (свТ4) и антител к тиреопероксидазе (АТ к ТПО). ТТГ определяли методом иммуноферментного анализа с использованием реагентов 3-го поколения (референсный диапазон 0,4-3,5 мМЕ/л). Для исследования использовали анализатор Beckman Coulter (США). Уровни свТ4 (7,8–14,3 пмоль/л) и свТ3 (3,5–6,4 пмоль/л) оценивали с помощью анализатора ACCESS® IMMUNOASSAY SYSTEMS (США). Количество АТ к ТПО (0,0–10,0 МЕ/мл) определяли при помощи анализатора ORGENTEC TPO ELISA (РФ) методом иммуноферментного анализа. Уровни креатинина (0,053–0,115 ммоль/л) и мочевины (2,5–7,3 ммоль/л) определяли на автоматическом иммунохимическом анализаторе UniCel DxC 800 (Beckman Coulter, США). СКФ рассчитывалась по формуле CKD-EPI. Эффективность ПГД рассчитывали по формуле Даугирдаса (Kt/V) [1]. Адекватность ПГД оценивалась при проведении 3 сеансов ПГД неделю и достижении минимальной эффективной дозы каждой процедуры spKt/V ≥1,4 [1].
Из 171 включенного в исследование пациента у 75 было выполнено УЗИ ЩЖ. УЗИ ЩЖ проводилось при помощи аппарата Hitachi AlokaSSD 500 (Япония), линейным датчиком с частотой 7,5 мГц. Общий объем ЩЖ рассчитывался по методу J. Brunn. Референсными значениями общего объема ЩЖ для мужчин рассматривали до 25 см3, для женщин до 18 см. Структурными изменениями ЩЖ считали: наличие узлов, кист, эхографическую неоднородность структуры ЩЖ, увеличение объема ЩЖ, наличие псевдоузлов. Для интерпретации выявленных изменений эхографической картины узловых образований ЩЖ была использована классификация EU-TIRADS. При выявлении критериев, соответствующих EU-TIRADS 3-5, пациенты направлялись на ТАБ. При ТАБ узлов ЩЖ, сопровождающейся УЗ-контролем, использовались одноразовые шприцы (10 и 20 мл) и ультратонкие иглы диаметром 23-21G.
Статистическая обработка данных проводилась с применением пакета программ прикладного статистического анализа GhaphPad Prism 9 и программы Microsoft Excel 16.0. Межгрупповые различия по количественным показателям оценивались с помощью критерия Манна - Уитни (ненормальное распределение) и критерия Стьюдента (нормальное распределение). Для сравнения групп по качественному бинарному признаку использовался критерий χ2 и точный критерий Фишера. Анализ зависимости между признаками осуществлялся путём вычисления коэффициента корреляции Спирмена (rs). Направленность связей оценивалась по знаку коэффициента корреляции. Критический уровень достоверности нулевой статистической гипотезы принимали равным 0,05.
Результаты исследования и их обсуждение
В исследование включен 171 пациент, среди них 79 женщин (46%) и 92 (54%) мужчины. Медиана возраста обследованных женщин составила 57,0 (48,0–65,0) полных лет, мужчин – 50 (36,0–62,5) полных лет. Женщины были значимо старше, чем мужчины (р=0,005). Основными причинами тХБП, приведшей к терапии ПГД, были: гломерулярная патология почки – 43 человека (25%); тубулоинтерстициальные болезни – 43 человека (25%); кистозная болезнь почек – 17 человек (10%); гломерулярные поражения, возникшие вследствие сахарного диабета – 17 человек (10%); гломерулярные поражения, развившиеся вследствие системных заболеваний соединительной ткани – 21 человек (12%); редкие формы заболеваний почек – 30 человек (18%).
Длительность гемодиализа (ГД) обследованных больных составила от 0 до 35 лет. Медиана длительности ГД составила 5,0 (2,0–9,0) полных лет. Медиана длительности ГД у обследованных женщин составила 6,0 (2,0–9,0) полных лет, у мужчин составила 5,0 (2,0–9,0) полных лет. Не удалось выявить статистически значимых различий по длительности ГД между мужчинами и женщинам (р=0,753). ИМТ обследованных больных составил от 16,89 до 40,27 кг/м2. Медиана ИМТ у обследованных женщин составила 24,90 (22,40–30,30) кг/м2, у мужчин - 24,50 (21,98–27,02) кг/м2. При сопоставлении ИМТ в зависимости от пола не удалось выявить значимых различий (p = 0,122).
У 171 больного из общей группы обследованных также были определены ТТГ, свТ3 и свТ4. Уровень ТТГ был от 0,04 до 16,94 мМЕ/л. Медиана ТТГ – 1,90 (1,18–3,35) мМЕ/л. Уровень свТ3 составил от 2,5 до 7,1 пмоль/л, медиана свТ3 – 3,7 (3,3–4,1) пмоль/л. Уровень св. Т4 был от 5,0 до 16,6 пмоль/л, медиана свТ4 – 9,9 (8,7–11,9) пмоль/л.
По уровню ТТГ обследованных больных с тХБП на ЗПТ корригируемой ПГД распределили по группам: группа больных с субклиническим гипотиреозом (СГ) ТТГ>3,5 мМЕ/л – 20,5% (n=35) и группа больных с нормальным уровнем ТТГ 0,4-3,5 Мме/л – 79,5% (n=136). Данные представлены в таблице.
Клинические характеристики пациентов с терминальной стадией хронической болезни почек, корригируемой программным гемодиализом в зависимости от уровня тиреотропина
|
Показатель |
Пациенты с тХБП на ПГД и субклиническим гипотиреозом (n=35) |
Пациенты с тХБП на ПГД и нормальным уровнем ТТГ (n=136) |
p |
|
Возраст, лет |
57,4±5,2 (23,0-94,0) |
51±2,6 (20,0-83,0) |
0,044 |
|
Пол (м/ж) |
19 (54%)/16 (46%) |
73 (54%)/63 (46%) |
>0,05 |
|
Вес, кг |
79,5 (65,8-87,6) |
70,0 (60,3-82,0) |
0,037 |
|
ИМТ, кг/м2 |
26,0 (23,0-30,0) |
24,2 (21,5-27,4) |
0,018 |
|
свТ3, пмоль/л |
3,8 (3,6-4,1) |
3,6 (3,1-4,1) |
0,024 |
|
свТ4, пмоль/л |
10,8 (9,1-12,8) |
9,6 (8,7-11,5) |
0,045 |
Из представленных данных следует, что пациенты с тХБП, получающие ЗПТ ПГД, были сопоставимы по полу, почечной функции, возрасту начала ХГД, стажу ПГД и spKt/V. Анализ медиан в группе больных с СГ и группе с нормальным уровнем ТТГ показал, что пациенты с СГ при тХБП на ЗПТ, корригируемой ПГД, были значимо старше. Вес и ИМТ значимо выше были в группе с СГ. При этом статистически значимых различий по вышеуказанным параметрам в зависимости от половой принадлежности не выявлено. Уровень тиреоидных гормонов (свТ4, свТ3) был значимо выше у пациентов с СГ в сравнении с больными, имеющими ТТГ в рамках референтного интервала при тХБП на ЗПТ, корригируемой ПГД. Повышение уровня АТ к ТПО выявлялось в 12% случаев (n=4) в группе пациентов с СГ и в 10% случаев (n=14) в группе с нормальным уровнем ТТГ. Корреляционные связи между повышенным уровнем АТ к ТПО и ТТГ, свТ4, свТ3 не выявлены.
При анализе в группах таких показателей, как стаж ПГД, возраст начала ПГД, СКФ, мочевины и креатинина, определяемых до и после ПГД, а также spKT/V, различий в группах не выявлено. Средние показатели стажа ПГД и возраста начала ПГД в основной группе и группе сравнения составили: 6,97±2,27 года vs 7,08±0,25 года, p=0,925; 49,5±5,9 года vs 43,9±2,7 года, р=0,114, соответственно. Медианы СКФ, креатинина, мочевины до сеанса ПГД, в основной группе и группе сравнения составили: 4,4 (3,8-5,5) мл/мин. vs 4,4 (3,75-5,1) мл/мин., р=0,449; 1,01 (0,67-1,12) мкмоль/л vs 0,93 (0,77-1,10), р=0,667; 24,8 (21,3-32,0) ммоль/л vs 25,2 (20,8-31,2) ммоль/л, р=0,581, соответственно. Медианы СКФ, креатинина, мочевины после сеанса ПГД, spKT/V в основной группе и группе сравнения составили: 15,3 (11,8-17,7) мл/мин. vs 14,8 (11,5-17,1) мл/мин., р=0,591; 0,33 (0,27-0,40) мкмоль/л vs 0,34 (0,28-0,41) мкмоль/л, р=0,526; 8,0 (5,9-10,3) ммоль/л vs 8,0 (5,9-10,0) ммоль/л, р=0,738; 1,36 (1,21-1,56) vs 1,39 (1,17-1,56), р=0,763, соответственно.
Анализ показателей тиреоидных гормонов в группе с СГ (n=35) показал, что при ТТГ>3,5 мМЕ/л низкий свТ3 встречается в 11% случаев (4 человека), а в группе с нормальным уровнем ТТГ (n=136) в 42% случаев (57 человек). Общее количество пациентов с синдромом «низкого Т3» из включенных в исследование (n=171) пациентов составило 35,6% (n=61). У пациентов с синдром «низкого Т3» (n=61) эффективность ПГД (spKT/V) была несколько ниже по сравнению с больными с нормальным уровнем Т3 (1,28 (1,13-1,47) vs 1,43 (1,2-1,58), р=0,020), а также был значимо выше уровень мочевины после ПГД (8,1 (6,7-10,6) ммоль/л vs 7,9 (5,7-9,4) ммоль/л, р=0,018).
У 75 больных из 171 было выполнено УЗИ ЩЖ. Структурные нарушения ЩЖ были выявлены у 47 из 75 больных (62,7%). У 40 больных из 75 (53,3%) были выявлены одиночные и множественные узлы. В 10% случаев (5 человек) наличие единичных и множественных узлов было ассоциировано с увеличенным объемом щитовидной железы. Узловые образования либо структурные изменения ЩЖ чаще выявляли у женщин, и выявленные изменения не зависели от возраста. Узловые образования были выявлены у 53,3% больных (n=40). У 87,5% пациентов (35 человек из 40) с выявленными узловыми образованиями УЗ-картина соответствовала классификации EU-TIRADS 2. У этих пациентов по данным УЗИ ЩЖ выявляли следующие эхографические изменения: анэхогенные аваскулярные включения, васкуляризированные образования смешанной структуры с четкими контурами, гипер- и изоэхогенные, частично инкапсулированные с периферической васкуляризацией, «губчатые узлы». УЗ-скан пациентки О., 46 лет, со стажем ПГД 5,5 лет, представлен на рисунке 1.
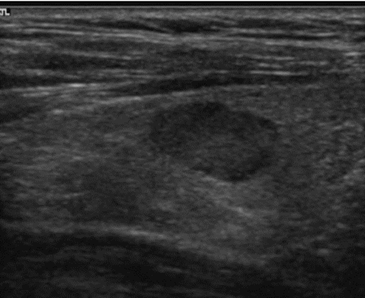
Рис. 1. УЗ-скан пациентки О., 46 лет, стаж программного гемодиализа 5,5 лет
У 14% больных (5 человек из 40), по данным УЗИ ЩЖ, риск злокачественности узлового образования соответствовал EU-TIRADS 3-5. У этих пациентов по данным УЗИ ЩЖ выявляли следующие эхографические изменения: образования изо- и гиперхогенные, округлой и овальной формы, с четкими контурами; образования умеренно гипоэхогенные, округлой и овальной формы, с четкими контурами; гипоэхогенные узлы, неправильной формы с нечеткими контурами и микрокальцинатами (точечные гиперэхогенные включения). Переднезадний размер таких узлов был больше его ширины («выше, чем шире»), что косвенно указывает на вероятность злокачественного роста. УЗ-скан пациентки К., 46 лет, со стажем ПГД 9,5 лет, представлен на рисунке 2. Пациентам с эхографической картиной EU-TIRADS 3-5 была проведена ТАБ узлов ЩЖ. Образцы биопсии были цитологически интерпретированы как доброкачественные (Bethesda II) в 80% случаев (4 пациента), подозрительные на фолликулярную неоплазию (Bethesda IV) в 20% случаев (1 пациент).
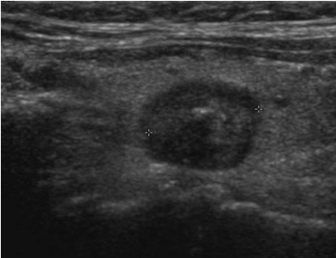
Рис. 2. УЗ-скан пациентки К., 46 лет, стаж программного гемодиализа 9,5 лет
В ходе проведенного исследования нами были оценены структурные изменения ЩЖ и концентрации тиреоидных гормонов у пациентов с тХБП, получающих терапию ПГД. По результатам проведенной работы у пациентов, получающих ПГД, субклинический гипотиреоз был выявлен у 20,5% больных. Известно, что в общей популяции повышение уровня ТТГ ассоциировано с женским полом и старшим возрастом [9; 10]. Также у пациентов с повышенным уровнем ТТГ выявляются высокие концентрации антитиреоидных антител. Основной причиной гипотиреоза в йодобеспеченной популяции является исход аутоиммунного тиреоидита. В обследованной группе пациентов повышение уровня ТТГ не зависело от пола и не было ассоциировано с повышением АТ-ТПО, однако пациенты с СГ были значимо старше. Известно, что снижение функциональной активности ЩЖ ассоциировано с избытком веса, ожирением и инсулинорезистентностью [13]. В группе обследованных больных пациенты с СГ имели значимо больше вес и ИМТ. В представленном исследовании повышение уровня ТТГ не влияло на качество ПГД. Уровни мочевины, креатинина и spKT/V были сопоставимыми в группе больных с СГ и нормальным уровнем ТТГ.
СЭП характеризует тяжелых коморбидных пациентов. По результатам исследования синдром «низкого Т3» был выявлен у 35,6% больных с тХБП на ЗПТ, корригируемой ПГД. Синдром «низкого Т3» был ассоциирован с повышением уровня мочевины после диализа, что указывает на недостаточную эффективность сеансов гемодиализа в обследованной группе больных.
Анализ УЗ-параметров ЩЖ показал, что доминирующей структурной аномалией при тХБП является узловой/многоузловой зоб (53,3% больных) вне зависимости от уровня ТТГ. Известно, что ТТГ является стимулятором пролиферации тиреоцитов [11]. Однако в проведенном исследовании наличие зоба и узловых образований в ЩЖ не зависело от уровня ТТГ. Возможно влияние дополнительных гиперпластических и неопластических факторов на ткань ЩЖ в условиях тХБП помимо ТТГ.
Результаты исследования показали, что доминирующей эхографической картиной при тХБП на ЗПТ ПГД являются УЗ-изменения, характерные для EU-THIRADS 1-2. Однако данные литературы указывают на то, что пациенты с тХБП имеют более высокий риск развития онкологических процессов [14]. Несмотря на этот факт, современная ультразвуковая классификация EU-THIRADS, введенная в 2021 году, не требует проведения ТАБ пациентам с эхографической картиной EU-THIRADS 1-2. При этом пациенты с тХБП не являются исключением, несмотря на наличие более высокого риска злокачественных новообразований, поэтому ТАБ узловых образований ЩЖ в этой группе больных, так же как и в общей популяции, показана лишь при УЗ-изменениях, характерных для THIRADS 3-5. Несмотря на более высокую вероятность выявления онкологического процесса при тХБП [14; 15], на сегодняшний день не уточнена категория рисков возникновения тиреоидного рака у пациентов с тХБП, а также его вклад в выживаемость при тХБП, что требует проведения дополнительных исследований.
Заключение
Таким образом, у пациентов с тХБП, получающих терапию ПГД, наиболее частыми проявлениями тиреоидной дисфункции являются синдром «низкого Т3» и субклинический гипотиреоз. Выявляемость последнего связана со старшим возрастом. Наличие субклинического гипотиреоза при тХБП ассоциировано с более высокими значениями индекса массы тела. Синдром «низкого Т3» у пациентов на ЗПТ ПГД связан со снижением эффективности гемодиализа и выраженностью азотистого дисбаланса. Доминирующая структурная аномалия при тХБП - узловой/многоузловой зоб. Доминирующей ультразвуковой картиной при наличии очаговых образований у пациентов с тХБП на ЗПТ ПГД были изменения, характерные для EU-THIRADS 1-2, не требующие проведения ТАБ. Механизмы гиперпластических и неопластических процессов ЩЖ и категория рисков возникновения тиреоидного рака у пациентов с тХБП требуют уточнения.
Библиографическая ссылка
Алламова Г.Г., Дыгун О.Д., Лукичев Б.Г., Карунная А.В., Волкова А.Р. СТРУКТУРНО-ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ЩИТОВИДНОЙ ЖЕЛЕЗЫ У ПАЦИЕНТОВ, ПОЛУЧАЮЩИХ ТЕРАПИЮ ПРОГРАММНЫМ ГЕМОДИАЛИЗОМ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32812 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32812



