Колоректальный рак (КРР) остается важнейшей проблемой в структуре общей онкологической заболеваемости. Во всем мире колоректальный рак занимает третье место по частоте заболеваемости среди мужчин и второе среди женщин. Так, по данным Всемирной организации здравоохранения (ВОЗ), за 2020 год среди женщин зарегистрировано 865 630 случаев, среди мужчин этот показатель составил 1 065 960. Ежегодная мировая смертность от колоректального рака приближается к 1 млн человек (за 2020 год 935 173 случаев). Как среди мужчин, так и среди женщин колоректальный рак является третьей по частоте причиной смерти от онкологического заболевания. Наиболее часто это заболевание регистрируется в развитых странах [1].
В России за 2019 год зарегистрировано 275,7 случая колоректального рака (рака ободочной, прямой кишки и ректосигмоидного соединения) на 100 000 населения. Кроме того, в этом же году на поздних стадиях (III–IV) зарегистрировано 46,9% случаев рака прямой кишки от общего числа заболевших [2].
Колоректальный рак относится к полиэтиологичным заболеваниям. К факторам риска развития точечных мутаций и, как следствие, полипов или КРР относят экзогенные, эндогенные факторы, генетическую предрасположенность, гендерные факторы, предопределенный возраст, особенности микробиома кишечника и ряд других. К основным факторам риска, которые влияют на развитие колоректального рака, относят: социально-экономическое положение стран и географическую зону проживания населения, расовую принадлежность, возраст, воспалительные заболевания кишечника, длительный анамнез курения. К факторам, наиболее вероятно способствующим развитию рака толстой кишки, можно отнести гиподинамию, избыточную массу тела и ожирение, потребление алкоголя, рацион с большим количеством красного мяса, дефицитом пищи растительного происхождения и низким содержанием микроэлементов [3].
Хронические воспалительные заболевания (ХВЗ) кишечника также играют немаловажную роль в контексте возникновения КРР. При этом риск развития онкологического процесса возрастает при манифестации в раннем подростковом возрасте и при наличии длительного анамнеза ХВЗ кишечника [4].
Особое внимание в изучении факторов риска возникновения КРР уделяется наследственной предрасположенности. Так, при наличии семейного анамнеза КРР у родственников первой линии вероятность возникновения заболевания повышается в 2–3 раза. Однако у трети пациентов, имеющих семейный анамнез, отсутствуют наследственные синдромы. К наиболее известным синдромам относят: Синдром Линча, семейный аденоматозный полипоз, синдром Пейтца–Егерса, ювенильный полипозный синдром [5]. Но только 5% случаев рака толстой кишки являются наследственными, в 30% случаев возникновение заболевания обусловлено наследственной предрасположенностью, и большинство других возникают спорадически [6].
Особенностью рака толстой кишки является множество вариантов молекулярного патогенеза заболевания. В настоящее время использование молекулярных методов в диагностике злокачественных опухолей является одним из основных направлений в исследованиях в связи с тем, что события, происходящие на уровне генома, следует считать ключевыми в возникновении и развитии злокачественных опухолей. Ключевую роль в развитии заболевания играют мутации в определенных генах. Так, условно в зависимости от возникновения мутации их можно разделить на спорадические, наследственные и семейные. Спорадические мутации составляют до 70% всех случаев колоректального рака, чаще всего причиной являются точечные мутации, которые появляются в течение жизни, не связаны с наследственными синдромами. Наиболее часто первичная мутация происходит в АРС (ген-супрессор), что обусловливает образование полипов с тенденцией к озлокачествлению за счет мутаций в генах KRAS, NRAS, TP53, DCC. Примерно 5% случаев приходится на наследственные мутации, в том числе семейный аденоматозный полипоз, характеризующийся образованием потенциально злокачественных полипов на всем протяжении толстой кишки. Основной причиной неполипозного колоректального рака является синдром Линча, связанный с мутациями в генах репарации ДНК (MSH2, MLH1, MLH6, PMS1 и PMS2). Еще 25% случаев возникновения колоректального рака относят к семейным наследственным мутациям, которые не могут быть включены ни в один вариант наследственного рака [7].
Молекулярная диагностика имеет ключевое практическое значение как в прогностическом плане, так и для определения тактики ведения пациентов. У большей части пациентов с колоректальным раком на момент постановки диагноза отмечаются запущенные стадии заболевания, 20% первично диагностированных имеют метастатический процесс. Ключевую роль в лечении метастатического колоректального рака (мКРР) играет лекарственное направление. Так, препараты на основе моноклональных антител против эпидермального фактора роста (EGFR), который в 80% случаев сверхэкспрессируется на опухолевых клетках, являются главной составляющей лекарственной терапии мКРР. К ним относятся цетуксимаб и панитумумаб (действие которых основано на блокировании внеклеточного домена тирозинкиназы EGFR), они способствуют угнетению пролиферации, а также активации апоптоза клеток опухоли [8]. Важным моментом является применение препаратов анти-EGFR при отсутствии мутаций в генах семейства RAS [9] ввиду того, что мутации в эффекторных сигнальных молекулах способствуют активации рецептор-независимого пути, приводя к резистентности терапии препаратами цетуксимаб (химерное моноклональное антитело IgG1) и панитумумаб (гуманизированное моноклональное антитело IgG2). Однако в исследованиях было показано, что клиническая польза в виде стабилизации заболевания у пациентов, получающих анти-EGFR, составляет 8–10 месяцев [10] в связи с тем, что по мере прогрессирования у большинства больных развивается лекарственная устойчивость [11], причиной которой могут служить как внешние, так и внутренние механизмы.
К внутренним механизмам можно отнести аномальную активацию онкогенных сигнальных путей, геномные изменения каскадов RAS/RAF/MEK/ERK и PI3K/AKT/mTOR. Изменение фенотипа раковых стволовых клеток способствует эпителиально-мезенхимальной трансформации опухолевой ткани и, как следствие, развитию устойчивости к терапии [12]. К внешним механизмам следует отнести изменения микроокружения опухоли. Так, анти-EGFR препараты цетуксимаб и панитумумаб способны подавлять опухолевый рост с помощью антителозависимой клеточно-опосредованной цитотоксичности, а дисфункция NK-клеток и макрофагов способствует снижению влияния препаратов на опухоль. Снижение количества эффекторных Т-клеток, повышенная экспрессия PD-L1, аномальный ангиогенез способствуют формированию устойчивости к таргетной терапии.
Влияние иммунной системы на клиническую эффективность традиционных методов лечения рака толстой кишки неоспоримо и во многом зависит от взаимодействия раковых клеток и микроокружения опухоли [13–16]. Иммунные клетки могут оказывать подавляющее действие на опухолевые клетки, а также контролировать рост опухоли в процессе иммунного надзора. Действия иммунной системы способны приводить как к полному уничтожению опухолевых клеток, так и к ускользанию от влияния иммунной системы и, как следствие, прогрессированию опухолевого процесса. Прогрессирование рака может быть вызвано также хроническим воспалением с иммунным инфильтратом, способным подавлять адаптивные иммунные реакции либо стимулировать пролиферацию опухоли, тем самым повышая выживаемость опухолевых клеток путем улучшения процессов ангиогенеза и метастазирования.
Микроокружение опухоли имеет важное значение для определения влияния иммунных клеток на клинический исход заболевания. Так, например, инфильтрация СD8+ Т-клеток связана с лучшим клиническим ответом [17]. По данным ряда авторов, такие клетки, как Th1, макрофаги M1, NK-клетки, положительно влияют на исход заболевания, в то время как присутствие макрофагов М2, MDSCs (миелоидные супрессорные клетки), Th17, В-клеток связано с худшим прогнозом и низким клиническим эффектом. В результате анализа количества и локализации опухоль-инфильтрирующих лимфоцитов (TILS) установлено влияние иммунного инфильтрата на прогрессирование опухоли. Несмотря на то что накопленные к настоящему времени данные позволяют выделить некоторые особенности иммунной инфильтрации опухолей при КРР, остается слабо изученным вклад отдельных цитокинов и других регуляторных молекул в развитие заболевания и в ответ на проводимое лечение.
W.H. Fridman с соавторами [18] проанализировали взаимосвязь между составом и функциональной нагрузкой опухолевого иммунного инфильтрата, его типом, расположением и плотностью TILs, а также их ориентацией относительно опухоли, что позволило авторам разработать представление о различном иммунном контексте (профиле) опухолей КРР. Благоприятный иммунный контекст (профиль) характеризовался инфильтрацией CD45RO+ Т-клетками памяти, CD8+ цитотоксическими Т-лимфоцитами (CTL), располагающимися преимущественно к центру опухоли и ее инвазивному краю, а также наличием Th1, M1макрофагов, преобладанием ряда цитокинов (CXCL9, CXCL10), сигнальных и цитотоксических эффекторных молекул. При неблагоприятном клиническом прогнозе развития КРР наблюдали формирование иммунного контекста (профиля), характеризующегося наличием внутриопухолевых миелоидных супрессорных клеток (MDSC), М2- макрофагов, В-клеток, связанных с выработкой провоспалительных генов, в том числе миелоидных хемокинов, иммуносупрессивных молекул и факторов комплемента [18]. По мнению авторов, микроокружение опухоли играет важную роль в инициации, инвазии и прогрессировании колоректального рака путем установления связи между раковыми клетками и другими типами клеток, в том числе иммунными [19]. Это клеточное взаимодействие опосредуется многими растворимыми факторами, в том числе цитокинами и хемокинами, сигнальными молекулами (например, факторами роста или компонентами внеклеточного матрикса).
Таким образом, к факторам, которые влияют на изменения в опухоли в ответ на проводимое лечение, относятся различное сочетание провоспалительных и противовоспалительных цитокинов, их баланс, стадия опухолевого процесса, уровень экспрессии рецепторов цитокинов, состояние активации стромальных клеток. Использование цитокинов в качестве мишени для терапии КРР остается актуальной темой для исследований, но требует более глубокого анализа широкого спектра взаимодействия цитокинов и опухолевых клеток колоректальной карциномы, что является необходимым условием для разработки точных и эффективных терапевтических методов.
Цель исследования: систематизация современных представлений об особенностях участия цитокинов, хемокинов и ряда других биологически активных молекул в развитии опухолей КРР.
Материалы и методы исследования
Для оценки информации о роли отдельных цитокинов и возможности их использования для выделения отдельных групп пациентов с разными иммунологическими характеристиками или различной вероятностью ответа на лечение нами был проведен систематический обзор публикаций в системах PubMed, Scopus (на английском языке) и eLIBRARY (на русском языке). Были найдены публикации, соответствующие критериям поиска, за период с 1995 по 2022 гг.
Критерием включения публикаций в обзор был анализ взаимодействия между колоректальной карциномой и иммунными клетками. Поиск осуществлялся по ключевым словам («колоректальная карцинома», «колоректальный рак», «цитокины», «хемокины») или отдельным группам исследуемых веществ (GM-CSF, IFN-γ, IL-2, IL-4, IL-5, IL-6, IL-7, IL-8, IL-10, IL-13, IL-15, IL-17A, IL-18, IP-10, MCP-1, MIG, MIP-1α, MIP-1β, RANTES, TNF-α).
Результаты исследования и их обсуждение
К настоящему времени накоплен определенный объем сведений, отражающих некоторые особенности влияния ряда цитокинов на течение колоректального рака.
GM-CSF – гранулоцитарный макрофагальный колониестимулирующий фактор определенно оказывает иммунонезависимое влияние на прогрессирование опухоли путем поддержания ее микроокружения, тем самым стимулируя рост образования и его метастазирование [20]. Экспрессия GM-CSF в большей степени повышена в первичных опухолях толстой кишки по сравнению со здоровой популяцией и продуцируется неопластическими эпителиальными клетками толстой кишки. Микроокружение опухоли: фибробласты, моноциты, антигенпрезентирующие клетки – также имеют на своей поверхности рецепторы к GM-CSF, что обусловливает их накопление в опухолевой ткани. Показано, что гиперэкспрессия GM-CSF, индуцируя высвобождение VEGF эпителиальными клетками толстой кишки, инициирует тем самым ангиогенез через ERK-сигнальный путь, что способствовало более быстрому образованию рака, ассоциированного с колитом [21]. Отличительной особенностью GM-CSF является способность воздействовать на дендритные клетки, результатом чего может выступать стимуляция противоопухолевого ответа, а при воздействии на макрофаги – ингибирование пролиферации клеток [22].
IFN-γ – в толстой кишке наиболее часто экспрессируется лимфоцитами, активированными дендритными клетками. Рецептор IFN-γ регистрируется практически на всех ядросодержащих клетках. IFN-γ усиливает презентацию промоутеров CD8+, Т-, NK-клеток антигенам класса I ГКГС и способствует развитию опосредованной макрофагами цитотоксичности, как следствие, стимулирует противоопухолевый иммунный ответ [23]. Показана связь между высоким уровнем IFN-γ в сыворотке крови и отсутствием метастазов в лимфатических узлах и отдаленных метастазов колоректального рака [24]. Действие IFN-γ на клетки КРР с индукцией фосфорилирования STAT1 и ингибированием сигнальных путей EGFR приводит к сдерживанию пролиферации клеток.
IL-2 – является важным цитокином, участвующим в индукции Т-клеточно-опосредованного иммунного ответа путем запуска развития и пролиферации Т-лимфоцитов, активации NK-клеток и В-лимфоцитов, а также участвует в развитии регуляторных T-клеток, продуцируется в основном CD4+ Th1 и CD8+ лимфоцитами. До настоящего времени взаимосвязь между IL-2 продуцируемыми Т-клетками и особенностями опухолевых клеток при КРР и его микроокружением до конца не известна.
IL-4 – способствует усилению пролиферации Т- и В-лимфоцитов, участвует в регуляции секреции иммуноглобулинов. Известно, что IL-4 сверхэкспрессируется при предраковых состояниях толстой кишки (гиперпластические, аденоматозные полипы и др.), а при возникновении аденокарциномы уровень IL-4 остается нормальным и способен увеличиваться при появлении метастатических очагов колоректального рака. При аномальной активации STAT6 в совокупности с IL-4 способствует активации метастатических процессов в опухоли и, как следствие, коррелирует с плохой выживаемостью пациентов с раком толстой кишки [25].
IL-6 – сверхэкспрессия интерлейкина 6 в тканях КРР, а также повышение уровня сывороточного IL-6 коррелируют с большим размером опухоли, появлением метастазов и худшим прогнозом течения заболевания. Способствовать этому может накопление MDSC в опухолевой ткани; взаимодействие IL-6 с его рецептором приводит к активации STAT3, что, в свою очередь, обусловливает стимуляцию пролиферации раковых клеток и ускорение прогрессирования опухоли [26].
IL-7 – относится к цитокинам, стимулирующим гемопоэз, участвует в пролиферации и дифференцировке пре-В и пре-Т лимфоцитов. IL-7, в отличие от других цитокинов, является тканевым интерлейкином. M. Krzystek-Korpacka et al. первыми пришли к заключению, что системное повышение концентрации IL-7 связано с метастатическим колоректальным раком, а также с локализацией опухолевого процесса, что может иметь важное значение для практики [27].
IL-8 – этот цитокин в основном действует на миелоидные клетки, усиливая их мобилизацию, способствуя тем самым прогрессированию опухоли за счет их иммуносупрессивного действия [28]. Пациенты с КРР характеризовались значительным увеличением концентрации IL-8 в опухолевой ткани по сравнению со здоровой тканью, что, по мнению исследователей, отражает участие данной молекулы в ангиогенезе опухоли и приводит к повышенному риску рецидива и плохому прогнозу дальнейшего течения заболевания. IL-8 через свой рецептор активирует AKT и MAPK сигнальные пути, способствуя экспрессии генов, ответственных за пролиферацию, инвазию и ангиогенез, результатом чего являются рост опухоли, раннее метастазирование и химиорезистентность [29].
Известно, что повышение уровня IL-10 в крови на дооперационном уровне коррелирует с более плохим прогнозом [30]. Связывание IL-10 с рецептором активирует несколько сигнальных путей, таких как STAT1, STAT3, STAT5, однако до конца не ясно, какой из этих путей активируется при колоректальном раке, что требует дальнейшего исследования [31].
IL-13 – цитокин, имеет сходные регуляторные элементы с IL-4. Показано, что повышение концентрации данных цитокинов тесно связано с онкогенезом и метастазированием [32]. Так, сверхэкспрессия IL-4 и IL-13 в опухолевом микроокружении может способствовать прогрессированию опухоли через механизмы стимуляции трансформации макрофагов к М2 активированному фенотипу.
IL-15 – представитель семейства IL-2 с выраженным воздействием на процессы активации, пролиферации и выживания клеток. Этот цитокин продуцируется стромальными, эпителиальными, миелоидными клетками (моноцитами, макрофагами, дендритными клетками), при этом противоопухолевая активность IL-15 обусловлена воздействием на цитотоксические Т- и NK-клетки. Bernhard Mlecnik с соавторами в своей работе доказал, что пациенты с КРР в комбинации с делецией IL15, которая приводит к снижению экспрессии цитокина, имеют значительно более высокий риск рецидива опухоли и худшую общую выживаемость [33]. Главным образом действие IL-15 основано на реализации противоопухолевой цитотоксичности и модуляции воспалительного микроокружения опухоли. Как и для других цитокинов, для IL-15 характерна двойственная роль в процессах взаимодействия опухоли и иммунной системы: при определенных, не вполне изученных условиях он обусловливает выраженную противоопухолевую активность цитотоксических лимфоцитов, однако при других условиях наблюдается и проопухолевая активность данного цитокина [34].
IL-17A – иммунные клетки CD4+ являются основным источником цитокина при колоректальном раке и в окружающих тканях. По данным ряда авторов, уровень IL-17A в сыворотке крови был повышен у пациентов с КРР, коррелировал с размером опухоли и циркулирующими опухолевыми клетками, а также предсказывал плохую выживаемость [35].
IL-18 – является противоопухолевым цитокином. При наличии полиморфизма А607С в гетерозиготном состоянии обусловливает повышенный риск развития КРР [36]. Некоторые мутации белков рецептора IL-18 связаны с болезнью Крона и воспалительными заболеваниями кишечника. Этот цитокин также способствует активации иммунитета, опосредованного цитотоксическими клетками, в том числе CD8+ Т-лимфоцитами и NK-клетками. Однако показано, что в результате взаимодействия цитокина с рецептором на опухолевых клетках происходит активация сигнальных путей, влияющих на их пролиферацию и дифференцировку [37].
Помимо роли отмеченных цитокинов в определении биологических свойств опухолей, их способности к метастазированию и ответе на проводимое лечение, особая роль отводится такой группе молекул, как хемокины. С функциональной точки зрения эти молекулы регулируют такие процессы, как: хемотаксис активированных иммунокомпетентных клеток, адгезия клеток к эндотелию сосудов и друг с другом, миграция опухолевых клеток и ряд других.
IP-10 – интерферон-гамма-индуцированный белок 10, также известный как хемокиновый лиганд 10 с мотивом CXC (CXCL10), обладающий различной биологической активностью в виде регуляции адгезии лимфоцитов к эндотелию, процессов хемотаксиса, ингибирования колониеобразования клетками, а также противоопухолевой активностью. Синтезируется несколькими типами клеток (моноцитами, эндотелиальными клетками и др.) в ответ на действие IFN-γ. Было показано, что CXCL10 может быть рассмотрен как независимый прогностический фактор рецидива рака. Повышенная концентрация IP-10 в сыворотке крови в совокупности с наличием отдаленных метастазов рассматривается как крайне неблагоприятный прогноз [38].
MCP-1 – является мощным хемокином и часто продуцируется опухолевыми клетками, которые считаются основным источником данной молекулы. Основная роль хемокина заключается в привлечении из крови моноцитов в область воспалительной реакции, в том числе в опухоль. Выявлено, что MCP-1 регулирует порочный круг связи между опухолевыми клетками и макрофагами, тем самым способствуя прогрессированию опухоли [39]. Туморассоциированные макрофаги (ТАМ) являются одним из основных элементов стромы опухоли. Синтезируются в основном из моноцитов крови в ответ на хемоаттрактанты, в том числе MCP-1. Тем самым хемокин влияет на количество и распределение ТАМ, косвенно воздействуя на провоспалительные и противоопухолевые процессы [40].
MIG – является лигандом хемокина CXCR3, участвует в реализации иммуновоспалительных реакций при активации IFN-γ. Важность изучения CXCR3 с его лигандами, экспрессируемыми на Т-регуляторных клетках и макрофагах при колоректальной карциноме, обусловлена доказанной стимуляцией метастатических процессов и более худшим прогнозом по сравнению с пациентами, у которых экспрессия CXCR3 не была выявлена [41].
MIP-1α – CCL3, хемокин, продуцируется в основном макрофагами, дендритными клетками, лимфоцитами, которые активируют ССR5 (хемокиновый рецептор). Основной эффект данного хемокина – провоспалительный, заключается в активации хемотаксиса и трансэндотелиальной миграции клеток. Кроме того, в ответ на CCL3 в фибробластах и макрофагах индуцируются синтез и высвобождение других провоспалительных цитокинов, таких как IL-1, IL-6 и TNF-α. Эти хемокины влияют на моноциты, Т-лимфоциты, дендритные клетки, NK-клетки и тромбоциты [42]. Они также активируют гранулоциты человека, что может привести к острому нейтрофильному воспалению.
RANTES – регулирует активацию, экспрессию и секрецию нормальных Т-клеток, относится к провоспалительным хемокинам. Взаимодействие хемокина с соответствующим рецептором способствует запуску каскадных путей (PI3K/AKT, NF-kB, ERK/MEK), что может приводить к неконтролируемой пролиферации и созданию благоприятных условий микроокружения для выживания опухолевой клетки. P.K. Baier с соавторами [43] показали, что высокие уровни хемокинов, в том числе RANTES (CXCL5), вносят больший вклад в рост опухоли и иммуносупрессию, чем в эффективный противоопухолевый иммунитет. Таким образом, возникает вопрос о необходимости проведения исследований, направленных на нейтрализацию хемокинов при колоректальном раке.
TNF-α – фактор некроза опухоли, является ключевым медиатором воспаления [44]. Исследования TNF-α показали взаимосвязь повышения концентрации в сыворотке крови со стадией колоректальной карциномы, что может быть использовано на диагностическом этапе для формирования групп риска пациентов с более плохим прогнозом течения заболевания. Также выявлена взаимосвязь положительного коррелирования прогрессирования колоректальной карциномы с увеличением концентрации фактора некроза опухоли в сыворотке крови [45].
Помимо влияния на возникновение и течение колоректального рака, иммунное микроокружение влияет на эффективность проводимого лечения, выбор которого, в свою очередь, зависит от статуса гена RAS [46].
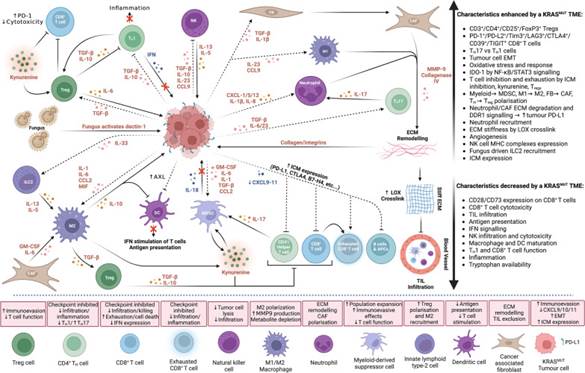
Опухолево-иммунные и иммуно-опухолевые взаимодействия в микроокружении опухоли с мутацией в гене KRAS [46]
Мутации в гене KRAS при колоректальном раке встречаются в 30–60% случаев [47]. Ускользание от иммунной системы происходит несколькими механизмами, в первую очередь это возможно за счет изменения опухолевого микроокружения путем увеличения MDSC и Treg клеток, ремоделирования стромы и индукции TGF-β, а также ассоциированных с опухолью фибробластов и дифференцировки цитокинов (VEGF, IL-6, IL-8). Интегральные современные представления относительно взаимного влияния иммунокомпетентных клеток и КРР представлены на рисунке.
Мутантный ген KRAS способен изменять опухолевое микроокружение, тем самым влияя на распределение иммунных клеток. Так, например, передача сигнала по пути KRAS, ингибирование TTP связаны с изменениями ряда цитокинов и хемокинов (IL-8, GM-CSF, CXCL5, IL-10, VEGF, PEG-2), в результате чего запускаются каскадные изменения в микроокружении в виде повышения уровня миелоидных клеток-супрессоров (MDSC) и Treg, происходят трансформация ассоциированных с раком фибробластов (CAF), повышение экспрессии эндотелиального Fas-лиганда, способного ингибировать выход CD8+ Т-клеток из кровотока. Также мутация в гене KRAS посредством угнетения функции MYC способствует увеличению передачи сигналов интерферона, что, в свою очередь, снижает продукцию иммуносупрессивных цитокинов в опухоли, а также приводит к усилению инфильтрации и активации CD8+ Т-лимфоцитов и увеличению презентации главного комплекса гистосовместимости (ГКГ) [48].
Действуя совместно, KRAS и MYC стимулируют онкогенез, а также активно изменяют опухолевое микроокружение несколькими путями. Так, например, повышенная экспрессия IL-1 и IL-6 приводит к усилению регуляции перепрограммирования иммунных клеток (IDO-1) в инфильтрирующие опухоль лимфоциты (TILs) посредством передачи сигнала по пути STAT3 [49].
Онкогенная передача сигналов KRAS способна приводить к повышенной экспрессии IL-8, IL-10, GM-CSF, CXCL1, CXCL12, CCL2 и MIF, а также к снижению уровня IL-18 с последующим изменением опухолевого микроокружения, делая его резистентным к иммунотерапии. Секреция этих иммунных факторов влияет на привлечение нейтрофилов, уменьшение воспаления с помощью Th1, ингибирование макрофагов, трансформацию М2-подобных макрофагов в опухоль-ассоциированные макрофаги (ТАМ), инфильтрацию MDSC и запуск экспрессии хемотаксического фактора [48]. Экспрессия связанных с KRAS цитокинов может вызывать изменения в механизмах врожденной иммунной системы и, как следствие, препятствует активации адаптивной иммунной системы, ухудшая ответ на проводимое лечение.
Заключение
Для полноты понимания иммунных процессов, происходящих при опухолевых заболеваниях, в частности при развитии КРР, наиболее перспективным является комплексный подход в оценке концентрации различных биологически активных соединений, вовлеченных в рассматриваемые процессы. С этой точки зрения особое внимание привлекает технология мультиплексного анализа, позволяющая в небольшом объеме биологического материала определить широкий спектр целевых молекул, отражающих состояние некоторых звеньев иммунной системы в организме онкологического больного, в том числе на фоне проведения лекарственной терапии.
В литературе встречаются разрозненные данные о влиянии тех или иных цитокинов и хемокинов на возникновение, течение, исход колоректального рака. Известно, что развитие и прогрессирование колоректального рака связаны с изменением цитокинов в сыворотке крови, но уровень значений этих иммунных факторов четко не определен.
В связи с этим назрела необходимость комплексного, системного подхода к анализу цитокинов у пациентов с колоректальным раком для выявления корреляционных связей с прогнозом течения заболевания, в том числе на фоне проводимого лекарственного лечения, включающего применение препаратов на основе моноклональных антител.
Библиографическая ссылка
Кит О.И., Владимирова Л.Ю., Сагакянц А.Б., Тишина А.В., Златник Е.Ю., Дженкова Е.А., Новикова И.А. РОЛЬ ЦИТОКИНОВ И ХЕМОКИНОВ В РАЗВИТИИ КОЛОРЕКТАЛЬНОГО РАКА // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32805 (дата обращения: 17.02.2026).
DOI: https://doi.org/10.17513/spno.32805



