Гиперплазия эндометрия – распространенное заболевание, ассоциированное с риском развития рака тела матки. Инциденс злокачественной трансформации в течение года является максимальным при гиперплазии эндометрия с атипией – 8,2%, тогда как при гиперплазии без атипии – только 2,6% [1]. Частота рака эндометрия на момент диагностики атипической гиперплазии оценивается в 32,6–48,5% [1, 2]. По данным Государственной медицинской статистики (форма № 7), в Российской Федерации рак тела матки по распространенности занимает 3-й ранг в структуре онкологических заболеваний у женщин. В 2021 году распространенность равнялась 191,6:100000 населения, или 8,1% всех онкозаболеваний. Смертность в течение первого года после диагностики составила 7%, общая смертность – 1,9% [3, с. 4, 138–144].
Известные факторы риска гиперплазии эндометрия связаны в первую очередь с абсолютной или относительной гиперэстрогенией (ожирение, сахарный диабет, ранняя менархе, поздняя постменопауза и др.) или с генетической предрасположенностью (например, синдром Линча) [4, 5]. Роль воспаления, дисбаланса ростовых факторов и канцерогенов все еще малоизучена. Вместе с тем, ожирение – наиболее значимый фактор риска [5], помимо эндокринного дисбаланса формирует персистирующее воспаление низкой активности [6], являющееся, в свою очередь, одним из патогенетических механизмов канцерогенеза [7]. Не исключена и роль профессиональных факторов, в первую очередь химических, так как пик заболеваемости приходится на трудоспособный возраст, 50–54 года [5]. В условиях воздействия неблагоприятных факторов производственной среды заняты 21,2% работающих женщин, в том числе в контакте с химическим фактором – 4,7% [8, с. 143]. В условиях современного производства в число наиболее распространенных токсикантов входят органические растворители. Данный класс веществ характеризуется системностью действия и возможностью канцерогенного эффекта [9, с. 144, 182–187]. Токсичность органических растворителей увеличивается при наличии ожирения за счет кумуляции и однонаправленного влияния на продукцию кислородных радикалов [9, с. 144, 182–187]. Механизм действия органических растворителей позволяет предположить возможность их вмешательства в патогенез гиперпластических предраковых заболеваний эндометрия, данный вопрос требует изучения.
Современная диагностика гиперплазии эндометрия основана на гистологическом исследовании [5]. Определенная субъективность морфологической оценки, очаговый характер поражения эндометрия определяют целесообразность поиска дополнительных прогностических критериев. При этом важным является прогнозирование не только самого заболевания, но и его особенностей, в первую очередь – атипической гиперплазии. В связи с этим предоставляет интерес оценка прогностической значимости факторов риска. Для управления профессиональным риском здоровью работающих женщин требуются данные о прогностической значимости параметров условий труда.
Цель исследования – установить фенотип гиперплазии эндометрия у работающих в контакте с органическими растворителями в зависимости от наличия ожирения и выявить наиболее значимые факторы прогноза гиперплазии эндометрия с атипией.
Материалы и методы исследования. Выполнено одноцентровое одномоментное неинтервенционное клиническое исследование. Основная исследуемая группа – 140 женщин с гиперплазией эндометрия, подвергавшихся воздействию органических растворителей на рабочем месте, группа сравнения – 140 больных гиперплазией эндометрия без профессионального риска здоровью. Ожирение было у 70 больных основной группы и 68 – контрольной, р<0,01.
Группы сформированы на основании следующих критериев включения и невключения. Критерии включения – письменное информированное согласие больной на участие в исследовании, диагноз «гиперплазия эндометрия», возраст от 50 до 65 лет включительно, менопауза в течение 2 лет и более, в основную группу – контакт с органическими растворителями в связи с выполнением трудовых функций не менее 5лет, в группу сравнения – отсутствие на рабочем месте воздействия химического фактора (в том числе в концентрациях менее предельно допустимых) за весь период трудовой деятельности, в подгруппы с ожирением – индекс массы тела 30 и более, окружность талии более 80 см, отношение окружности талии к окружности бедер более 0,85.
Критерии невключения – отсутствие информированного согласия на участие в исследовании, неспособность/неготовность понимать и выполнять требования протокола исследования, наличие противопоказаний к диагностическим мероприятиям, предусмотренным протоколом исследования, прием эстроген-гестагенных препаратов в настоящее время или в течение 1 месяца и более в анамнезе, индекс массы тела менее 18, наличие подтвержденных злокачественных новообразований любой локализации, воспалительных заболеваний органов малого таза, хронических воспалительных заболеваний другой локализации, синдрома поликистозных яичников, тяжелого сахарного диабета в стадии декомпенсации, цирроза печени или гепатита с печеночной недостаточностью, анамнестические данные об отсутствии родов, раннем возрасте начала менструаций, семейном анамнезе рака яичников, толстой кишки или матки.
Место работы больных основной группы – предприятия машиностроения (код ОКВЭД 2020 30.30.32), профессия – маляр. Основным неблагоприятным фактором производственной среды был химический, а именно наличие в воздухе рабочей зоны ксилола, толуола, ацетона, бензина с превышением предельно допустимых концентраций в 1,2–5,0 раз. В большей степени были увеличены значения максимальных разовых (пиковых) концентраций. Химический фактор воздействовал в течение всей рабочей̆ смены. Стаж работы в контакте с органическими растворителями равнялся 21,5 (18; 28) года, в подгруппе с ожирением – 22 (18; 28) года, без ожирения – 21 (19; 27) год, р=0,422.
К моменту включения в исследование 29 (20,7%) больных прекратили работу в контакте с органическими растворителями: в подгруппе с ожирением – 14 (20,0%), без ожирения – 15 (21,4%) человек. Период после прекращения работы в контакте с химическим фактором равнялся 3 (1; 5) года, в подгруппе с ожирением 3 (1; 5) года; без ожирения – 2,5 (1; 5) года.
Диагноз гиперплазии эндометрия у всех больных был основан на результатах гистологического исследования [5, 10]. Ожирение диагностировали по критерию ВОЗ – индекс массы тела более 25. Диагноз абдоминального ожирения соответствовал критерию Международной Федерации Диабета (International Diabetes Federation, IDF) 2005 – окружность талии более 80 см [11].
Исследуемые страты были сопоставимы по возрасту – 58 (49; 58) лет в подгруппе профессионального риска с ожирением, 57 (45; 64) лет в подгруппе профессионального риска без ожирения, 56 (46; 65) лет и 57 (45; 63) лет в группе сравнения у больных с ожирением и нормальной массой тела соответственно, р=0,352. Также подгруппы не различались по продолжительности менопаузы – 12 (6; 14) лет, 12 (5; 14) лет, 11 (5; 16) лет и 12 (5; 15) лет соответственно, р=0,583, распространенности курения – 12 (17,1%), 13 (18,6%), 13 (19,1%) и 14 (19,1%) курящих лиц, р=0,629. У больных с ожирением была выше частота миомы матки – 18 (25,7%) и 19 (27,9%) случаев в группах с наличием и отсутствием профриска в сравнении с 14 (20%) и 10 (13,8%) в подгруппах без ожирения, р=0,002. Основным коморбидным экстрагенитальным заболеванием была артериальная гипертензия, частота в основной группе больше в сравнении с группой сравнения. При этом у лиц с профессиональным риском частота артериальной гипертензии в подгруппах с ожирением и нормальной массой тела не различалась – 19 (27,1%) и 17 (24,3%), в группе сравнения – была больше при ожирении – 11 (16,2%) и 7 (9,7%), р=0,009.
Лечение и диспансерное наблюдение всех больных проводили в соответствии с действующими Федеральными клиническими рекомендациями по гиперплазии эндометрия.
Все процедуры исследования соответствовали принципам Хельсинкской Декларации Всемирной медицинской ассоциации, а также этическим нормам и правилам, изложенным в Бюллетене Высшей аттестационной комиссии Министерства образования России № 3 от 2002г. Исследование одобрено этическим комитетом ФГБОУ ВО НГМУ Минздрава России.
Всем больным выполнены общеклиническое и гинекологическое исследование, трансвагинальное УЗИ органов малого таза, гистероскопия с биопсией или лечебно-диагностическое выскабливание полости матки с гистологическим исследованием ткани эндометрия методами световой микроскопии и иммуногистохимии, с определением экспрессии эстрогеновых и прогестероновых рецепторов на клетках эпителия и стромы, маркера пролиферации белка Ki-67. Концентрации белков в сыворотке крови измеряли методом твердофазного иммуноферментного анализа сэндвич-типа. Исследованы уровни интерлейкинов 1β и 6, фактора роста фибробластов-2 (FGF-2), тромбоцитарного фактора роста (PDGF AB), трансформирующего фактора роста β1 (TGFβ1), адипонектина, лептина, С-реактивного белка. Концентрацию в крови фибриногена измеряли методом Клаусса. Общий анализ крови выполнен на автоматическом гематологическом анализаторе.
Статистическая обработка данных проведена с использованием программ SPSS23 и Statistica9.0. Нулевую гипотезу отклоняли при р=0,01 с учетом поправки Бонферрони. Соответствие данных нормальному распределению оценивали методом Колмогорова–Смирнова.
Выполнены стандартные методы описательной статистики. Для непрерывных переменных при нормальном распределении данные представлены в виде среднего и стандартного отклонения (M±SD), при распределении, отличном от нормального, – в виде медианы и межквартильного интервала (Me (Q1; Q3)). Ординальные и номинальные (качественные) переменные выражены в долях. По непрерывным переменным группы сравнивали методом Крускала–Уоллиса, по качественным – критерием χ2.
Для определения взаимосвязей использовали метод логистической регрессии. Зависимыми (прогнозируемыми) переменными были (1) факт формирования гиперплазии эндометрия в условиях воздействия органических растворителей и (2) атипическая гиперплазия у больных с профессиональным фактором риска. Выполнены однофакторный и многофакторный анализы. Перед многофакторным анализом выполняли проверку независимых переменных на коллинеарность, в случае выявления взаимосвязей в модель включали одну (наиболее клинически значимую) из таких переменных. В результате в качестве независимых переменных были оценены возраст, статус курения, продолжительность менопаузы, индекс массы тела, окружность талии, частота аномальных маточных кровотечений, гематокрит в период аномального маточного кровотечения, наличие анемии, толщина М-Эхо, Ki-67, рецепторы эстрогенов, прогестерона на клетках эндометрия, стромы, концентрации в крови С-реактивного белка, фибриногена, интерлейкинов 1β, 6, трансформирующего фактора роста β1, тромбоцитарного фактора роста АВ, фактора роста фибробластов-2, адипонектина, лептина; в группе рабочих – максимальные разовые и среднесменные концентрации в воздухе рабочей зоны бутилацетата, ксилола, толуола, бензина, ацетона, стаж работы, продолжительность постконтактного периода. Построение многофакторных моделей осуществляли последовательным включением факторов. Для оценки качества модели использованы критерии 2 Log правдоподобие, R-квадрат Кокса и Снелла, R-квадрата Найджелкерка. Практическая ценность многофакторных моделей определена методом построения ROC-кривых соотношений чувствительности и специфичности. Площадь под ROC-кривой, большая или равная 50%, означала приемлемую различающую способность модели.
Результаты исследования и их обсуждение
Частота гиперплазии эндометрия с атипией была больше в группе работающих в условиях воздействия химического фактора – у 37 (26,4%), в группе сравнения – у 12 (8,5%) больных, χ2=15,4, р>0,001. При стратификации по наличию ожирения частота атипической гиперплазии эндометрия была максимальной в подгруппе рабочих с ожирением – 24 (34,3%) случая, в подгруппе без ожирения – 13 (18,6 %), в группе сравнения у женщин с ожирением и нормальной массой тела – 7 (10,3 %) и 5 (6,9 %) соответственно, χ2=21,7, р>0,001.
В однофакторном регрессионном анализе с развитием гиперплазии эндометрия в условиях воздействия органических растворителей с вероятностью р>0,01 были взаимосвязаны (ОШ и 95% ДИ): атипический гистологический вариант гиперплазии эндометрия (3,832, 1,901–7,723), толщина М-эхо (1,217, 1,021–1,451), уровень экспрессии Ki-67 в эндометрии (1,164, 1,121–1,210), сывороточные концентрации провоспалительных цитокинов интерлейкина 1β (1,532, 1,378–1,708), интерлейкина 6 (1,304, 1,173–1,450), профиброзных ростовых факторов PDGF-AB (1,158, 1,118–1,198), TGF-β1 (1,183, 1,001–1,339), FGF-2 (1,2652, 1,013–1,632), лептина (0,822, 0,626–0,997).
В подгруппе воздействия химического фактора с атипическим вариантом гиперплазии эндометрия с вероятностью р>0,01 были связаны (ОШ, 95% ДИ): среднесменные концентрации ксилола в воздухе рабочей зоны (2,25, 1,84–4,72), максимальные разовые концентрации толуола в воздухе рабочей зоны (2,68, 1,90–5,19), стаж работы (1,872, 1,515–2,313), окружность талии (1,135, 1,077–1,197), толщина М-эхо (1,236, 1,098–1,557), уровень экспрессии Ki-67 в эндометрии (1,303, 1,187–1,431), рецепторов эстрогенов на эпителии эндометрия (1,093, 1,041–1,149) сывороточные концентрации провоспалительных цитокинов интерлейкина 1β (1,257, 95% ДИ 1,052–1,394), интерлейкина 6 (1,216, 1,028–1,439), профиброзного ростового фактора PDGF-AB (1,349, 1,165–1,563), лептина (1,088, 1,029–1,151).
Методом многофакторной логистической регрессии с последовательным включением факторов в модель определены параметры, независимо и в наибольшей степени ассоциированные с формированием гиперплазии эндометрия в условиях воздействия органических растворителей. Такими факторами были: экспрессия Ki-67 в ткани эндометрия, концентрация в крови PDGF-AB и интерлейкина-1β (табл. 1).
Таблица 1
Факторы, ассоциированные с развитием гиперплазии эндометрия при воздействии органических растворителей (многофакторный анализ)
|
Параметр |
В |
Отношение шансов |
95% ДИ |
Тест Вальда |
р |
|
Константа |
–13,54 |
10-6 |
|
38,76 |
<0,001 |
|
Ki-67, % |
0,055 |
1,057 |
1,001–1,116 |
3,86 |
0,049 |
|
PDGF-АВ, нг/мл |
0,138 |
1,148 |
1,104–1,194 |
7,84 |
<0,001 |
|
Интерлейкин-1β, нг/мл |
0,351 |
1,421 |
1,095–1,845 |
6,98 |
0,008 |
Взаимосвязь описывается формулой:
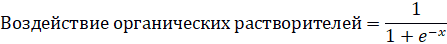
в которой x= –13,54+0,055×Ki-67+0,138×PDGF-АВ+0,351×ИЛ-1β,
где: воздействие органических растворителей – формирование гиперплазии эндометрия в условиях контакта с органическими растворителями на рабочем месте;
Ki-67 – экспрессия белка Ki-67 в ткани эндометрия, измеренная методом иммуногистохимии и выраженная в процентах;
PDGF-АВ – концентрация в крови тромбоцитарного фактора роста АВ, измеренная методом твердофазного иммуноферментного анализа и выраженная в нг/мл;
ИЛ-1β – концентрация в крови интерлейкина 1β, измеренная методом твердофазного иммуноферментного анализа и выраженная в нг/мл.
По результатам ROC-анализа точкой отсечения было значение уравнения регрессии, большее или равное 0,202. При этом диагностическая чувствительность модели составляла 95,0%, специфичность – 87,9%. Площадь под кривой «чувствительность – специфичность» равнялась 0,962 (95% ДИ 0,936–0,988), р<0,001 (рис. 1А). Значение 2 Log правдоподобия модели равнялось 70,5, R-квадрата Кокса и Снелла – 0,678, R-квадрата Найджелкерка – 0,805. Таким образом, модель объясняет до 80,5% дисперсии внешнего этиологического фактора.
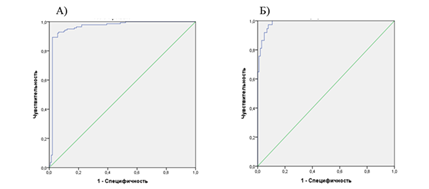
Кривая операционных характеристик многофакторного анализа: А – фенотипа гиперплазии эндометрия в условиях воздействия органических растворителей, переменная отклика – факт воздействия профессионального фактора; Б – дополнительного критерия атипической гиперплазии эндометрия у работающих в условиях воздействия органических растворителей
Аналогичным способом был разработан многофакторный критерий атипического варианта гиперплазии эндометрия для лиц высокого профессионального риска (табл. 2). Переменная отклика была выбрана с учетом клинической значимости атипической гиперплазии эндометрия как предракового состояния.
Таблица 2
Факторы, ассоциированные с атипической гиперплазией эндометрия у больных, подвергавшихся воздействию органических растворителей
|
Параметр |
В |
Отношение шансов |
95%ДИ |
Тест Вальда |
р |
|
Константа |
–91,5 |
0,000484 |
|
12,17 |
<0,001 |
|
Стаж, лет |
0,725 |
2,065 |
1,400–3,044 |
13,39 |
<0,001 |
|
Концентрация толуола в воздухе рабочей зоны, максимальная разовая мг/м3 |
0,122
|
1,130 |
1,039–1,227 |
8,26 |
0,004 |
|
Окружность талии, см |
0,220 |
1,247 |
1,045–1,487 |
6,01 |
0,014 |
|
PDGF-AB крови, нг/мл |
0,107 |
1,113 |
1,007–1,230 |
4,36 |
0,037 |
Была получена следующая формула:
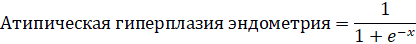
в которой х=–91,5+0,725×стаж + 0,122×МРК толуола + 0,220×ОТ + 0,107× PDGF-AB,
где: атипическая гиперплазия эндометрия – гистологический вариант гиперплазии эндометрия с атипией;
стаж – стаж работы в контакте с органическими растворителями, лет;
МРК толуола – максимальная разовая концентрация толуола в воздухе рабочей зоны, мг/м3;
ОТ – окружность талии, см;
PDGF-AB – концентрация в крови PDGF-AB, нг/мл.
По результатам ROC-анализа точкой отсечения было значение решения уравнения логистической регрессии, большее или равное 0,262. При этом диагностическая чувствительность модели равнялась 91,9%, специфичность – 95,1%. Площадь под кривой «чувствительность – специфичность» составила 0,987 (95% ДИ 0,974–0,998), р<0,001 (рис. 1Б).
Значение 2 Log правдоподобия модели равнялось 25,34, R-квадрата Кокса и Снелла – 0,622, R-квадрата Найджелкерка – 0,909. Модель объясняет до 90,5% дисперсии атипического гистологического типа у женщин с гиперплазией эндометрия, подвергавшихся воздействию органических растворителей.
Таким образом, в результате проведенного исследования были установлены ассоциации воздействия органических растворителей с фенотипическими и патогенетическими особенностями гиперплазии эндометрия в условиях воздействия органических растворителей – высокой частотой атипической гиперплазии, увеличением толщины М-эхо, пролиферативной активностью клеток эндометрия (увеличением экспрессии белка Ki-67), увеличением концентрации в крови провоспалительных интерлейкинов 1β и 6, профиброзных и ростовых факторов TGF-β1, FGF-2, PDGF-AB. При этом у женщин, работающих в условиях воздействия органических растворителей, определяли взаимосвязи с атипическим вариантом гиперплазии эндометрия как гигиенических параметров, маркеров пролиферации, воспаления, ростовых факторов, так и параметров, характеризующих чувствительность эндометрия к эстрогенам, а также отражающих тяжесть ожирения. В многофакторном анализе были значимы и гигиенические, и метаболические показатели. Можно предположить синергизм влияния на развитие атипической гиперплазии эндометрия химического фактора и ожирения. Выявленные ассоциации с молекулярными факторами показывают, что в числе механизмов влияния органических растворителей на развитие предракового процесса эндометрия могут быть развитие системного воспаления, а также модификация профиля ростовых факторов. Вероятно, эти же процессы могут отвечать за синергизм с ожирением [6].
Ранее проведенными исследованиями определены связи уровня Ki-67 с гиперплазией с атипией [12], взаимосвязь с воздействием органических растворителей ранее изучена не была. Интерлейкины 1 и 6, TGF-β1, FGF-2, PDGF-AB – молекулы, уровень которых в исследуемой когорте отличал группу гиперплазии эндометрия при воздействии органических растворителей, известны как одни из регуляторов процесса канцерогенеза [13–15]. У исследуемых больных определены связи с атипической гиперплазией эндометрия рецепторов эстрогенов, что соответствует ранее известным данным о патогенезе этого заболевания [5].
Заключение. Перспективными многофакторными критериями наличия у больных с высоким профессиональным риском неблагоприятного атипического варианта гиперплазии эндометрия являются стаж работы в условиях воздействия органических растворителей, максимальная разовая концентрация толуола в воздухе рабочей зоны, окружность талии, концентрация в крови PDGF-AB. Полученные данные подчеркивают важность оценки условий труда при определении прогноза и стратегии ведения больных.
Библиографическая ссылка
Маринкин И.О., Шпагина Л.А., Лисова Е.С., Шпагин И.С., Котова О.С., Кармановская С.А. ПРОГНОЗ ГИПЕРПЛАЗИИ ЭНДОМЕТРИЯ С АТИПИЕЙ У ЖЕНЩИН, РАБОТАЮЩИХ В УСЛОВИЯХ ВОЗДЕЙСТВИЯ ОРГАНИЧЕСКИХ РАСТВОРИТЕЛЕЙ // Современные проблемы науки и образования. 2023. № 4. ;URL: https://science-education.ru/ru/article/view?id=32784 (дата обращения: 07.01.2026).
DOI: https://doi.org/10.17513/spno.32784



